Особенности диагностики и лечения стероид-индуцированных нарушений углеводного обмена у пациентов с воспалительными заболеваниями кишечника на клиническом примере
- Аннотация
- Статья
- Ссылки
- English

Введение
Опыт применения глюкокортикостероидов (ГКС) при лечении различных иммуновоспалительных заболеваний, в том числе воспалительных заболеваний кишечника (ВЗК), насчитывает несколько десятилетий и свидетельствует об их высокой эффективности. В то же время развитие нежелательных явлений, особенно при системном применении ГКС, является серьезной проблемой в клинической практике [1, 2]. В настоящее время ГКС используют при лечении ВЗК только с целью индукции ремиссии при обострении язвенного колита или болезни Крона (БК), и период их назначения ограничен 12 неделями [3, 4]. Глобальной целью терапии ВЗК является достижение долгосрочной бесстероидной ремиссии [5].
Спектр неблагоприятных эффектов ГКС во многом обусловлен их видом, дозой и длительностью применения. Стандартная тактика назначения ГКС при ВЗК направлена на снижение возможных осложнений, однако не исключает их появления. К нежелательным явлениям с необходимостью мониторинга относится гипергликемия, развитие которой в свою очередь может быть связано с повышенным риском осложнений ВЗК [6]. Установлено, что пациенты с ВЗК и сахарным диабетом (СД) имеют более высокую частоту госпитализаций с необходимостью неотложной помощи по сравнению с пациентами с ВЗК без СД [7].
Клиническое наблюдение
Пациентка Л., 1977 г. р., поступила в отделение гастроэнтерологии Челябинской областной клинической больницы (ЧОКБ) с жалобами на жидкий стул с примесью крови в каждой порции до пяти раз в день, тенезмы, похудение на 7 кг за последние три месяца.
Анамнез заболевания. Считает себя больной с 2018 г., когда впервые отметила появление примеси крови в стуле. По результатам дообследования выставлен диагноз язвенного колита в форме проктита легкой степени тяжести по Truelove – Witts. Пациентке было назначено местное лечение суппозиториями с 1 г месалазина, на фоне которого достигнута клинико-эндоскопическая ремиссия. В дальнейшем пациентка продолжала местную терапию месалазином (1 г ректально три раза в неделю). С 2022 г. отметила появление крови в стуле. Гематохезия сохранялась на фоне эскалации дозы ректальных форм месалазина, в связи с чем к лечению были добавлены пероральный месалазин в максимальной терапевтической дозе и ректальные формы ГКС в течение двух месяцев с положительным эффектом в виде отсутствия примеси крови в кале. В дальнейшем на фоне поддерживающей терапии месалазином внутрь и ректально чувствовала себя удовлетворительно до 2024 г., когда стала отмечать помарки крови в стуле и учащение дефекаций до четырех раз в сутки. Амбулаторно рекомендовано увеличение дозы месалазина до 4 г в сутки, однако положительный эффект не был достигнут. В течение трех месяцев до госпитализации пациентка отмечала постепенное ухудшение симптомов: учащение стула с кровью до пяти раз в сутки, появление ложных позывов к дефекации, снижение массы тела на 7 кг. В связи с отсутствием эффекта от амбулаторного лечения пациентка госпитализирована в гастроэнтерологическое отделение ЧОКБ.
Анамнез жизни. У пациентки гипертоническая болезнь. Прием лозартана в дозе 25 мг в сутки позволил достигнуть целевых уровней артериального давления. С целью контрацепции пациентка принимает комбинированный пероральный контрацептивный препарат диеногест + эстрадиола валерат. В анамнезе отмечает курение в течение 10 лет, индекс курения 2,5 пачка/лет (прекратила курить 15 лет назад).
При поступлении состояние удовлетворительное, телосложение нормостеническое, индекс массы тела (ИМТ) 21,14 кг/м2. Температура тела 36,4 °С. Кожные покровы обычной окраски, чистые. Распределение подкожно-жировой клетчатки равномерное. Окружность талии 75 см. Периферические лимфоузлы не пальпируются. Костно-мышечная система внешне не изменена. Дыхание через нос свободное. Грудная клетка внешне не изменена, межреберные промежутки не расширены. Границы легких в пределах нормы. При аускультации легких дыхание везикулярное, хрипов нет, частота дыхательных движений 17 в минуту. Прекардиальная область внешне не изменена. При аускультации сердца тоны ритмичные, шумов нет, частота сердечных сокращений 82 удара в минуту, артериальное давление 125/80 мм рт. ст. Язык влажный, чистый. Живот не увеличен, симметричен, участвует в акте дыхания, при пальпации мягкий, болезненный в левой подвздошной области. Печень не увеличена. Селезенка не пальпируется. Мочеиспускание свободное, безболезненное.
По данным лабораторных методов обследования выявлены ускорение скорости оседания эритроцитов до 50 мм/ч, увеличение уровня С-реактивного белка до 24,2 мг/мл в сыворотке крови. ДНК цитомегаловируса методом полимеразной цепной реакции в крови не обнаружено. Токсины А и В Clostridioides difficile в кале не выявлены. Фекальный кальпротектин составил 230 мкг/г.
Пациентке проведена илеоколоноскопия в полном объеме, по результатам которой слизистая оболочка сигмовидной кишки и прямой кишки диффузно гиперемирована, резко отечная, контактно кровоточит, с язвами полигональной формы от 1 до 3 см, средней глубины, дно язв покрыто фибрином, сосудистый рисунок отсутствует, складки не определяются, просвет кишки сужен из-за отека слизистой. Заключение: язвенный колит выраженной степени активности с поражением прямой кишки и сигмовидной кишки.
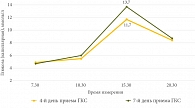
В соответствии с клиническими рекомендациями [3] пациентке были назначены азатиоприн в дозе 2,5 мг на 1 кг массы тела в сутки (150 мг) и преднизолон внутрь в дозе 1 мг на 1 кг массы тела в сутки (60 мг). С целью контроля гликемии на фоне приема ГКС в соответствии с исследованием, одобренным этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования Южно-Уральского государственного медицинского университета Министерства здравоохранения Российской Федерации (выписка из протокола № 6 от 09.09.2024), проведена оценка уровня глюкозы капиллярной крови четыре раза в сутки: натощак перед едой (в 7.30), через два часа после еды дважды (в 10.30 и 15.30) и перед сном (в 20.30). Гликемический профиль оценивали два раза в неделю. Пациенткой было подписано информированное добровольное согласие на медицинское вмешательство. На фоне приема преднизолона отмечен положительный клинический эффект в виде сокращения частоты стула до двух раз в день, уменьшения примеси крови, отсутствия тенезмов. На четвертые сутки приема 60 мг преднизолона внутрь через два часа после обеда (в 15.30) зафиксирован диабетический уровень гликемии: 11,7 ммоль/л. На седьмой день приема ГКС в это же время (15.30) зафиксирована гликемия 13,7 ммоль/л (рис. 1). До начала терапии ГКС определен уровень гликированного гемоглобина, который составил 5,9%.
Пациентке установлен диагноз: «язвенный колит, хроническое рецидивирующее течение, левостороннее поражение, среднетяжелая атака. Стероид-индуцированный сахарный диабет». Целевой уровень гликированного гемоглобина – менее 6,5%, целевой уровень гликемии натощак – до 6,5 ммоль/л, через два часа после еды до 8,0 ммоль/л.
Проведена консультация эндокринолога, рекомендовано начать прием гликлазида 30 мг в сутки. На фоне лечения у пациентки отмечено наступление клинической ремиссии, уровень глюкозы крови находился в пределах целевых значений. Через три месяца после отмены преднизолона при продолжающейся сахароснижающей терапии глюкоза натощак – 4,2 ммоль/л (венозная), глюкоза через два часа после обеда – до 8,0 ммоль/л (капиллярная), гликированный гемоглобин (HbA1c) – 5,7%. С учетом стойкой нормализации гликемического профиля при прекращении терапии ГКС рекомендована отмена гликлазида.
Обсуждение
Распространенность нарушений углеводного обмена, вызванных ГКС, неизвестна, по результатам большинства исследований их частота находится в пределах от 12 до 30% [8–11]. Риск развития гипергликемии существенно зависит от дозы, способа и длительности применения ГКС. Наибольшее количество работ посвящено пероральным и внутривенным формам ГКС, для которых доказано, что эскалация дозы ведет к увеличению риска гипергликемии. В исследовании J. Wu и соавт. (2019) были изучены более 100 000 пациентов с иммуноопосредованными заболеваниями без СД, которым проводили терапию ГКС, в том числе 29 000 пациентов с ВЗК. Результаты исследований показали дозозависимое увеличение риска развития стероид-индуцированного СД (СИСД): через год наблюдения совокупный риск составил 2,1% при суточной дозе < 5 мг и 5,0% при суточной дозе ≥ 25,0 мг эквивалентной преднизолону [12]. Данные о развитии стероид-индуцированной гипергликемии и СД в когорте больных ВЗК малочисленны и предполагают их высокую распространенность. M. McDonnell и соавт. (2020) показали, что 60% пациентов с ВЗК, получивших внутривенную терапию ГКС, столкнулись с гипергликемией, в том числе лица без предшествующего СД в 57% случаев имели высокий уровень гликемии (более 11,1 ммоль/л) [13]. Схожие данные получили B. Mitchell и соавт. (2019) при постоянном электронном мониторинге глюкозы крови у пациентов с ВЗК без предшествующего СД: на фоне терапии КС у 60% диагностирован СИСД [14].
Повышение уровня глюкозы при назначении ГКС обусловлено различными механизмами. К ним относятся: прямое повреждающее действие на β-клетки поджелудочной железы [15, 16], влияние на липидный обмен [17, 18], усиление глюконеогенеза в печени [19]. Скелетные мышцы в большей степени участвуют в опосредованном инсулином захвате глюкозы, а ГКС ингибируют инсулинозависимые переносчики в миоцитах (глюкозные транспортеры 4-го типа) [19, 20]. Влияние на выработку различных нейромедиаторов – нейропептида Y, проопиомеланокортина и агути-связанного белка может стимулировать аппетит, что приводит к увеличению суточного калоража и повышению уровня циркулирующих жирных кислот [17].
Взаимосвязь между нарушениями углеводного обмена и ВЗК является предметом дискуссий [21]. Высказываются предположения о единых путях патогенеза, включающих изменения кишечной микробиоты и нарушения эпителиального барьера кишки [22, 23]. Данные факторы сопряжены с активацией Т-хелперов 17-го типа, которые в свою очередь являются важным звеном патогенеза БК и сахарного диабета первого типа [24, 25]. Вклад наиболее изученных факторов риска сахарного диабета второго типа (СД 2) (пожилой возраст, высокий ИМТ [26], нарушение толерантности к глюкозе [27], гестационный СД, семейный анамнез СД) в генез СИСД при ВЗК нуждается в детальном рассмотрении. Так, в представленном клиническом примере у пациентки отсутствовали традиционные факторы риска за исключением возраста старше 45 лет и артериальной гипертензии.
Общепринятыми терминами, характеризующими нарушение углеводного обмена на фоне приема ГКС, являются следующие [28]:
- СИСД – гипергликемия, впервые возникшая на фоне использования ГКС у пациентов без СД в анамнезе;
- Стероид-индуцированная гипергликемия – декомпенсация СД на фоне использования ГКС.
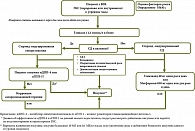
Диагностика СИСД должна проводиться в соответствии с общепринятыми критериями [29]: уровень глюкозы в плазме натощак ≥ 7,0 ммоль/л; уровень глюкозы в плазме крови через два часа после нагрузки ≥ 11,1 ммоль/л; HbA1c ≥ 6,5%; случайный уровень глюкозы в крови ≥ 11,1 ммоль/л. При этом необходимо учитывать особенности гипергликемии во время терапии ГКС при использовании диагностических тестов [30, 31] (таблица).
До настоящего времени не определены частота и кратность контроля глюкозы крови у пациентов, получающих ГКС. Рекомендации диабетологического общества Великобритании предлагают устанавливать диагноз СИСД или гипергликемии при концентрации глюкозы крови более 12 ммоль/л при случайном определении [32]. Авторы рекомендуют проводить мониторинг гликемии у пациентов без ранее установленного СД не реже одного раза в день: при приеме ГКС в утренние часы – перед обедом или ужином, или через один-два часа после обеда или ужина. При уровне глюкозы в крови менее 12 ммоль/л следует продолжать тестирование один раз в день перед обедом или ужином или после них. Если последующие значения уровня глюкозы в капиллярной крови превышают 12 ммоль/л, частоту тестирования следует увеличить до четырех раз в день. С учетом общепринятой при ВЗК схемы назначения преднизолона или метилпреднизолона, относящихся к ГКС со средней продолжительностью действия, рационально определение постпрандиальной гликемии во второй половине дня. В продемонстрированном клиническом случае максимальные цифры гликемии были зарегистрированы после 15 часов в первую неделю приема, что может служить основанием для дальнейших исследований и рекомендаций по диагностике стероид-индуцированных нарушений углеводного обмена (рис. 2).
Рекомендации по выбору терапии стероид-индуцированных нарушений углеводного обмена варьируют в руководствах разных стран, а исследования по поводу эффективности пероральной сахароснижающей терапии и инсулинотерапии значительно отличаются друг от друга дизайном, изучаемой патологией и видом ГКС. Общепризнаны требования относительно необходимости коррекции питания и введения ежедневных умеренных физических нагрузок в качестве составной части комплексного лечения СИСД [33]. Среди пероральных сахароснижающих лекарственных средств наиболее изученными в данной клинической ситуации являются препараты сульфонилмочевины. E. Mills и соавт. (2015) указывают, что препараты сульфонилмочевины могут быть эффективны для тех пациентов, которым назначают ГКС средней продолжительности действия в утреннее время [34]. Ряд работ позволяют рассматривать метформин как эффективный вариант лечения стероид-индуцированных нарушений углеводного обмена [35, 36]. Помимо этого метформин активно изучается как потенциальный препарат для лечения различных иммуноопосредованных заболеваний, в том числе ВЗК [37–39]. Тем не менее преимущества использования метформина для лечения пациентов с СИСД при ВЗК до сих пор не ясны. Результаты исследований ингибиторов дипептидилпептидазы 4 и агонистов рецепторов глюкагоноподобного пептида 1 при CИСД на сегодняшний день ограничены и не позволяют дать однозначные рекомендации [40–42]. Как и в случае с пероральными сахароснижающими средствами, существует лимитированное количество исследований с подтверждением эффективности инсулинотерапии при стероид-индуцированных нарушениях углеводного обмена. Считается, что базально-болюсный режим введения инсулина является наиболее гибким вариантом контроля гипергликемии, в том числе у пациентов, принимающих ГКС [11, 43, 44]. Однако при терапии инсулином особого внимания требует мониторинг гликемии: при снижении дозы ГКС может потребоваться снижение дозы инсулина для профилактики ятрогенной гипогликемии [32].
Тактика ведения пациентов с СИСД, продолжающих получать ГКС на амбулаторном этапе, должна включать регулярный контроль гликемии с использованием глюкометра и продолжение медикаментозной терапии. При постепенном снижении дозы ГКС может потребоваться деэскалация сахароснижающей терапии, темпы которой должны быть подобраны индивидуально. Если после прекращения приема ГКС гипергликемия сохраняется, необходимо провести переоценку клинической ситуации. Это связано с тем, что часть пациентов, у которых была обнаружена гипергликемия на фоне терапии ГКС, имели ранее существовавший и недиагностированный СД 2. В этой связи особую важность приобретает предварительная оценка факторов риска СД и возможность определения уровня HbA1с до начала терапии ГКС. Общепринятой тактики наблюдения пациентов с СИСД после отмены ГКС нет, многие авторы рекомендуют, помимо контроля гликемии натощак, проведение ПГТТ через шесть недель после окончания приема ГКС [45]. HbA1с в данной ситуации надлежит исследовать не ранее чем через три месяца [32], единой позиции о необходимости дальнейшего мониторинга этого показателя нет. Также до настоящего времени не уточнено, как влияет СИСД на течение ВЗК и являются ли стероид-индуцированные нарушения углеводного обмена фактором, связанным с дальнейшим развитием кардиометаболических нарушений. Необходимы дальнейшие исследования для оптимизации мониторинга гликемии у пациентов с ВЗК, получающих ГКС, подбора сахароснижающей терапии и амбулаторного ведения пациентов с СИСД с целью повышения качества медицинской помощи данной категории пациентов.
Заключение
Диагностика стероид-индуцированных нарушений углеводного обмена у пациентов с ВЗК является сложной задачей с необходимостью междисциплинарного подхода с привлечением эндокринолога. Приведенный клинический случай демонстрирует особенности диагностики СИСД у пациентов, принимающих ГКС: необходимость определения постпрандиальной гликемии в вечернее время и оценки факторов риска развития СД. Необходимы дальнейшие исследования для разработки алгоритма ведения пациентов с ВЗК и СИСД на стационарном и амбулаторном этапах.
A.I. Dolgushina, PhD, Prof., A.S. Sluchanko, V.L. Tulganova, PhD, A.A. Saenko, PhD, G.M. Khusainova, PhD, Ya.I. Zaripova, V.S. Mikhailutsa
South Ural State Medical University, Chelyabinsk
Chelyabinsk Regional Clinical Hospital
Contact person: Alyona S. Sluchanko, pauttova@yandex.ru
The use of glucocorticoids (GCs) is effective in inducing remission of inflammatory bowel diseases (IBS), but is associated with risks of complications, in particular hyperglycemia. The frequency of hyperglycemia during GCs treatment requires clarification. A 47-year-old female patient was hospitalized in the gastroenterology department with a moderate left-sided ulcerative colitis. GCs was prescribed for the induction of remission. Capillary glucose monitoring was performed four times a day (fasting glucose level, postprandial glucose level 2 hours after breakfast and lunch, before bedtime glucose level). Such glucose control made it possible to fix postprandial hyperglycemia in the afternoon (3:30 PM). The patient was diagnosed with steroid-induced diabetes mellitus (SIDM) and prescribed treatment with an oral hypoglycemic drug, against which target levels of glycemic control were achieved.
The given clinical example demonstrates the features of the diagnosis of steroid-induced diabetes. This case demonstrates the need to develop recommendations for the diagnosis and treatment of SIDM, as well as monitoring patients with IBD who are undergoing GCs treatment. These recommendations require an interdisciplinary approach due to the characteristics of steroid-induced carbohydrate metabolism disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.