Роль микробиоты ротовой полости в развитии заболеваний желудочно-кишечного тракта
- Аннотация
- Статья
- Ссылки
- English
Введение
В полости рта человека обитает одно из наиболее разнообразных микробных сообществ организма, включающее более 700 видов бактерий, архей, грибов, вирусов и простейших [1]. Основу микробиома ротовой полости составляют представители филумов Actinomycetota, Bacteroidota, Bacillota, Fusobacteriota, Pseudomonadota, Saccharibacteria и Spirochaetota. Среди них доминируют такие роды, как Corynebacterium, Rothia, Actinomyces, Prevotella, Capnocytophaga, Fusobacterium, Streptococcus, Granulicatella, Neisseria и Haemophilus [2]. Микроорганизмы полости рта способны колонизировать различные биотические и абиотические поверхности, включая зубы, слизистую оболочку, имплантаты и реставрационные материалы. При этом они формируют биопленки – структурированные микробные сообщества, заключенные во внеклеточную матрицу, состоящую из полисахаридов, белков, липидов и нуклеиновых кислот. Процесс образования биопленки начинается с адгезии ранними колонизаторами, такими как Streptococcus, которые используют слюнные гликопротеины в качестве субстрата [3]. По мере роста микробной массы формируются сложные многослойные структуры с градиентами оксигенации, что создает условия для прикрепления протеолитических облигатных анаэробов – поздних колонизаторов, таких как Fusobacterium nucleatum (F. nucleatum), Porphyromonas gingivalis (P. gingivalis), Tannerella forsythia (T. forsythia) и Treponema denticola (T. denticola). Особое значение в формировании биопленки имеет F. nucleatum, выполняющая роль связующей бактерии, способствующей агрегации других видов благодаря экспрессии поверхностных адгезинов [4, 5].
Различные экзогенные и эндогенные факторы, а также возраст оказывают существенное влияние на состояние полости рта и ее микробиома. К таким факторам относятся наследственность, наличие ряда хронических заболеваний (ожирение, сахарный диабет (СД) 2-го типа) [6]. Нарушения равновесия микробиоты полости рта, вызванные как внешними, так и внутренними факторами, могут приводить к дисбиозу и развитию воспалительных заболеваний, таких как кариес и пародонтит. В норме в ротовой полости преобладают представители филума Bacillota (ранее Firmicutes), однако при пародонтите увеличивается доля патогенных видов, включая P. gingivalis (Bacteroidota), T. forsythia (Bacteroidota), T. denticola (Spirochaetota) и F. nucleatum (Fusobacteriota), что способствует развитию воспаления и разрушению альвеолярной кости. Таким образом, состав и структура биопленок играют ключевую роль в патогенезе наиболее распространенных стоматологических заболеваний [7].
Результаты исследований свидетельствуют о связи дисбиоза микробиома ротовой полости с развитием различных хронических заболеваний, таких как ожирение, СД 2-го типа, болезнь Альцгеймера, ревматоидный артрит, сердечно-сосудистые и онкологические заболевания [8].
Современные данные свидетельствуют о значительном влиянии паттернов питания на состав и устойчивость микробиома полости рта. Наибольшее воздействие оказывают простые углеводы, способствующие росту кислотопродуцирующих бактерий, в частности Streptococcus mutans, участвующих в развитии кариеса [9]. Микробиом ротовой полости не только реагирует на состав пищи, но и активно участвует в метаболизме питательных веществ, включая расщепление сахаров и гликопротеинов. Кроме того, антиоксиданты и противовоспалительные компоненты растительных продуктов модулируют иммунный ответ и микробное равновесие в полости рта [10].
Влияние курения и табачного дыма проявляется в снижении количества Pseudomonadota и увеличении – представителей Bacillota (ранее Firmicutes) и Actinomycetota, что отражает сдвиг в сторону патогенных сообществ. Курение также снижает активность пероксидазы и нарушает метаболизм эпителиальных клеток, способствуя анаэробному гликолизу [11].
Помимо питания, курения и алкоголя, на микробиом полости рта влияют гигиена полости рта, системные заболевания и прием лекарственных препаратов. Недостаточная гигиена способствует накоплению зубного налета и размножению патогенных микроорганизмов [12]. Системные заболевания, такие как нарушения обмена веществ (СД), сердечно-сосудистые и аутоиммунные заболевания, могут нарушать микробный баланс вследствие изменения иммунной активности и pH среды [13]. Антибиотики и иммунодепрессанты влияют на состав микробиоты, провоцируя дисбиоз и способствуя росту Candida [14].
Цель исследования – систематизация и анализ современных данных о взаимосвязи дисбиоза микробиома ротовой полости с заболеваниями желудочно-кишечного тракта (ЖКТ).
Ось «ротовая полость – кишечник»
Концепция оси «полость рта – кишечник» описывает сложные взаимосвязи между двумя крупнейшими микробными экосистемами в организме человека – ротовой полостью и кишечником [15]. Ротовая полость и кишечник представляют собой тесно связанные звенья пищеварительной системы, обладающие уникальными, но взаимосвязанными микробиомами. Взаимодействие между ними осуществляется через энтеральный, гематогенный пути передачи и иммунные механизмы [16]. В нормальных условиях миграция бактерий из полости рта в кишечник ограничена благодаря защитным барьерам – химическим в виде соляной кислоты желудка и биологическим в виде колонизационной резистентности. Однако патогены, такие как P. gingivalis, F. nucleatum, Klebsiella и другие, способны преодолевать эти барьеры, особенно у лиц с пониженной секрецией кислоты, например при применении ингибиторов протонной помпы [17]. Исследования свидетельствуют, что изменения микробного состава слюны, ассоциированные с пародонтитом, могут способствовать развитию кишечного дисбиоза [18]. Рассматриваются две основные гипотезы, объясняющие относительное увеличение численности бактерий ротовой полости в кишечнике. Согласно первой, так называемой гипотезе экспансии, микроорганизмы полости рта проникают в кишечную экосистему и активно колонизируют ее, согласно второй – гипотезе маркера, – предполагается, что увеличение доли бактерий ротовой полости в кишечнике отражает снижение численности других, резидентных представителей кишечной микробиоты [19].
Транслокация бактерий из ротовой полости в кишечник может осуществляться гематогенным путем. При воспалительных заболеваниях пародонта нарушается целостность эпителиального барьера, что позволяет патогенным микроорганизмам, таким как P. gingivalis, F. nucleatum и другие пародонтальные патогены, проникать в кровеносные сосуды [20]. Исследования показывают, что оральные бактерии способны транслоцироваться в желудочно-кишечный тракт через гематогенный и энтеральный пути, что может усугублять различные заболевания ЖКТ [21]. Этот процесс может способствовать усилению системного воспаления вследствие продукции провоспалительных цитокинов, таких как фактор некроза опухоли α (ФНО-α) и интерлейкин 6 (ИЛ-6). К возможным негативным последствиям также можно отнести нарушение целостности слизистых барьеров и изменение состава кишечного микробиома, что, в свою очередь, может усугублять воспалительные процессы в различных органах и тканях [22].
Иммунные пути играют существенную роль во взаимодействии микробиоценозов ротовой полости и кишечника [23]. Дисбиоз ротовой полости способен активировать иммунные клетки и модулировать воспалительные процессы в кишечнике. Оральные бактерии активируют врожденную иммунную систему через паттерн-распознающие рецепторы (PRR), включая Toll-подобные рецепторы (TLR) [24]. При попадании в кишечник патогенные бактерии, такие как P. gingivalis, активируют TLR4 и другие рецепторы врожденного иммунитета. Этот процесс приводит к активации транскрипционного фактора NF-κB и запуску каскада воспалительных реакций. А, например, штаммы бактерий рода Klebsiella, выделенные из слюны пациентов с воспалительными заболеваниями кишечника (ВЗК), могут колонизировать кишечник и вызывать воспалительный ответ [25].
P. gingivalis, один из основных этиологических факторов пародонтита, обладает высокой вирулентностью и способна стимулировать как врожденный, так и адаптивный иммунитет [26]. Присутствие этого микроорганизма в кишечнике ассоциировано с дисбактериозом, воспалительными заболеваниями кишечника, колоректальным раком, метаболическим синдромом и системными воспалительными заболеваниями. Влияние P. gingivalis на ассоциированную с кишечником лимфоидную ткань (GALT-комплекс) ведет к активации дендритных клеток, дифференцировке Т-клеток и секреции цитокинов, способствуя системной иммунной дисрегуляции [27]. Аналогично F. nucleatum и T. denticola могут транслоцироваться в кишечник, нарушать иммунную регуляцию и метаболическую активность кишечной микробиоты [28]. Оральные бактерии взаимодействуют с кишечной микробиотой, нарушая баланс между полезными и патогенными микроорганизмами. Они могут подавлять рост полезных бактерий, таких как представители родов Bifidobacterium и Lactobacillus, и способствовать размножению патогенов [29].
Микроорганизмы ротовой полости способны существенно изменять микробиом кишечника, влияя на его состав, барьерные функции и иммунные реакции. Эти изменения могут играть роль в развитии различных заболеваний, что подчеркивает важность поддержания здоровья полости рта для общего благополучия организма.
Заболевания желудка
Микробиота полости рта играет значительную роль в патогенезе заболеваний желудка, включая гастрит, предраковые заболевания, такие как атрофический гастрит с кишечной метаплазией, а также рак желудка. Исследования демонстрируют изменения в составе микробиома ротовой полости у пациентов с этими состояниями, что подчеркивает его потенциал как диагностического биомаркера и фактора риска [30].
У пациентов с гастритом наблюдается снижение α-разнообразия микробиома полости рта по сравнению со здоровыми лицами, что отражено в значениях индекса Шеннона [31]. Секвенирование 16S рРНК показало снижение численности таких видов, как Veillonella parvula, Corynebacterium matruchotii, Kingella oralis, Atopobium rimae и Aggregatibacter aphrophilus, наряду с увеличением доли Streptococcus infantis, Treponema vincentii, Campylobacter rectus, Selenomonas flueggei и представителей рода Leptotrichia у пациентов с гастритом. Эти изменения указывают на потенциал использования микробиоты языка как диагностического биомаркера гастрита [32]. Кроме того, было показано, что в слюне пациентов с гастритом повышено содержание Lactobacillaceae, Porphyromonas и Faecalibaculum, что также может свидетельствовать в пользу участия микробиоты полости рта в патогенезе заболевания [33].
При переходе атрофического гастрита к раку желудка, особенно на стадиях атрофического гастрита и кишечной метаплазии, наблюдается увеличение разнообразия микробиоты желудка с одновременным увеличением присутствия микроорганизмов, ассоциированных с полостью рта [34]. В частности, P. gingivalis, Campylobacter gracilis и Granulicatella elegans могут присутствовать в желудочном соке при гастрите [35]. После эрадикации Helicobacter pylori в составе микробиоты сохраняются патогенные представители полости рта, включая Peptostreptococcus, Parvimonas, Prevotella и Rothia. Вместе с тем при кишечной метаплазии определенные виды, такие как S. mutans и S. sanguinis, были представлены в меньшем количестве в микробиоте как полости рта, так и желудка [36].
Рак желудка остается одним из наиболее распространенных и смертельных видов онкологических заболеваний [37]. Несмотря на роль хронической инфекции H. pylori как одного из основных этиологических факторов, растущее число случаев H. pylori-негативного рака желудка указывает на возможный потенциальный вклад и других микроорганизмов [38]. Также продемонстрирована связь гигиены полости рта с риском злокачественных новообразований: нерегулярный уход и чистка зубов связаны с увеличением риска рака желудка. По данным одного из исследований наличие пародонтита по результатам опроса (анкетирования) было связано с повышенным риском аденокарциномы желудка и смертности, что подтверждает потенциальную пользу выявления наличия пародонтита при оценке рисков [39].
Микробиом разных участков полости рта (слюна, налет на языке, зубной налет, ткани пародонта) был связан с предраковыми поражениями желудка [40]. Состав микробиоты слюны относительно стабилен и отражает состояние различных экологических ниш ротовой полости. Так, метагеномные исследования выявили следующие изменения в составе микробиоты: наличие Peptostreptococcus stomatis, Johnsonella ignava, Neisseria elongata и N. flavescens у пациентов с метаплазией [41]. Изменения состава микрофлоры поверхности языка были связаны с наличием предраковых состояний, а Campylobacter concisus оказался более распространен у пациентов с атрофическим гастритом. Также выявлены значимые микробные изменения в зависимости от текстуры налета, включая увеличение Alloprevotella, Atopobium и Megasphaera, что подчеркивает диагностический потенциал этих бактерий [42].
Пародонтальные патогены, включая F. nucleatum, P. gingivalis, T. denticola и Aggregatibacter actinomycetemcomitans, также могут играть определенную роль в предраковых изменениях [43]. Описано, что F. nucleatum способствует прогрессированию опухолей ЖКТ и ассоциирована с наличием гастрита, в то время как для T. forsythia продемонстрировано наличие обратной взаимосвязи [44]. H. pylori в тканях пародонта чаще обнаруживается у пациентов с атрофическим гастритом и пародонтитом, что указывает на возможное участие оральной H. pylori в обострении пародонтита и патогенезе гастропатий [45]. У пациентов с плоскоклеточным раком пищевода выявлено снижение общего разнообразия микробиоты полости рта и увеличение доли Prevotella, Streptococcus и Porphyromonas, что указывает на возможное участие этих бактерий в канцерогенезе [46].
Таким образом, дисбиоз полости рта тесно связан с предраковыми заболеваниями желудка и может играть роль не только в их диагностике, но и в терапии.
Заболевания кишечника
Воспалительные заболевания кишечника, такие как болезнь Крона и язвенный колит, представляют собой хронические воспалительные состояния, при которых наблюдается патологическая активация иммунной системы, что приводит к деструктивному неспецифическому воспалению слизистой оболочки и более глубоких слоев кишечной стенки, сопровождающемуся рецидивирующим течением с чередованием периодов обострения и ремиссии, а также широким спектром кишечных и внекишечных проявлений [47]. Дисбиоз микробиоты ротовой полости может играть существенную роль в патогенезе ВЗК. В норме слизистый барьер препятствует проникновению микроорганизмов, однако при нарушении его целостности оральные бактерии, включая F. nucleatum и P. gingivalis, способны колонизировать кишечник, индуцируя локальные иммунные ответы, включая активацию Th1-клеток, ИЛ-9, CD4+- и T-клеток [48].
Дополнительный вклад в патогенез кишечных заболеваний вносит взаимодействие бактерий, характерных для полости рта, с местной микробиотой. Поступая в кишечник, они могут конкурировать с комменсальными бактериями, вытесняя пробиотические штаммы, такие как Faecalibacterium prausnitzii, и усиливать рост условно патогенных микробов. Это ведет к потере микробного разнообразия, нарушению метаболических функций микробиоты и увеличению проницаемости кишечного барьера [49] и способствует развитию воспалительных процессов в кишечнике. Кроме того, пародонтит, являясь хроническим воспалительным заболеванием, сопровождается увеличением видового разнообразия и бактериальной нагрузки в поддесневой биопленке, и часто сопутствует ВЗК. У пациентов с обоими заболеваниями наблюдается более тяжелое течение пародонтита и выше выраженность воспалительных изменений [50].
Исследования показали, что при язвенном колите отмечается повышение представленности в слюне Veillonella и Prevotella, что коррелирует с повышенными уровнями системных и локальных воспалительных маркеров, таких как ИЛ-1β. Подобные изменения микробиома наблюдаются и в поддесневой биопленке, особенно у детей с болезнью Крона, где зафиксировано повышение содержания Capnocytophaga spp. и Rothia spp. [51].
Для болезни Крона характерно повышенное присутствие бактерий, типичных для полости рта, включая роды Veillonella, Haemophilus, Streptococcus и Fusobacterium, в фекалиях и биоптатах кишечника [52]. Примечательно, что микробиом ротовой полости у пациентов с болезнью Крона также имеет отличия от здоровых людей. В частности, было показано, что численность Veillonella dispar, Megasphaera stantonii, Prevotella jejuni, Dolosigranulum pigrum и Lactobacillus backii была выше у взрослых с болезнью Крона [53].
Особое внимание вызывает роль F. nucleatum в патогенезе колоректального рака. Этот микроорганизм, редко встречающийся в кишечнике у здоровых людей, способен распознавать и связываться с опухолевыми клетками через рецепторы N-ацетил-D-галактозамина (Gal-GalNAc) и ингибировать активность натуральных киллеров (NK-клеток) через фактор адгезии F. nucleatum (Fap2), взаимодействующий с иммуноглобулиновым рецептором Т-клеток с доменами Ig и ITIM (TIGIT) на иммунных клетках. В совокупности это способствует иммуносупрессии в микросреде опухоли и позволяет злокачественным клеткам избегать гибели [54].
P. gingivalis также была обнаружена в опухолевых тканях, где она может способствовать усилению воспаления и злокачественной трансформации клеток. Данная бактерия продуцирует липополисахариды (ЛПС), гингипаины и другие факторы вирулентности, которые активируют Toll-подобные рецепторы (в особенности TLR2 и TLR4), инициируя продукцию провоспалительных цитокинов (ИЛ-6, ИЛ-8, ФНО-α) и активируя транскрипционный фактор NF-κB [55, 56]. Хроническое воспаление, вызванное этими сигнальными путями, является признанным катализатором опухолевого роста, ангиогенеза и метастазирования.
Кроме того, в образцах биопсии опухолевой ткани наряду с F. nucleatum и P. gingivalis обнаруживаются T. denticola, P. intermedia и Peptostreptococcus anaerobius. Последний, например, способствует образованию активных форм кислорода, повреждению ДНК и нарушению клеточного цикла, поддерживая таким образом канцерогенез [57].
Совокупность данных подтверждает гипотезу о наличии оси «полость рта – кишечник», при которой оральная микробиота способна влиять на состав и функцию кишечного микробиома, вызывая развитие воспалительных и опухолевых заболеваний [58].
Заболевания печени и поджелудочной железы
Метаболически ассоциированная жировая болезнь печени (МАЖБП) представляет собой форму патологии печени, тесно связанную с метаболическим синдромом и сопровождающуюся системными последствиями, включая высокий сердечно-сосудистый риск [59]. Одним из факторов, участвующих в патогенезе МАЖБП, является дисбиоз микробиоты полости рта, особенно повышенное содержание таких микроорганизмов, как P. gingivalis, Treponema, Filifactor и Desulfobulbus. P. gingivalis признан прямым фактором риска МАЖБП, его липополисахариды способны транслоцироваться в кишечник, вызывая дисбиоз и активацию воспалительных сигнальных путей в печени, включая TLR2, ФНО-α и ИЛ-17, а также активируя звездчатые клетки печени, способствуя фиброзу [60]. Аналогичные эффекты демонстрирует A. actinomycetemcomitans, влияя на микробиоту кишечника и метаболизм глюкозы [61].
Дисбактериоз при МАЖБП сопровождается снижением разнообразия микробиоты кишечника, увеличением доли провоспалительных бактерий (Bacteroidota, Fusobacteriota, Escherichia-Shigella) и уменьшением содержания защитных бактерий (Bacillota). Нарушение кишечного барьера позволяет микробным продуктам, включая ЛПС и метаболиты, проникать в печень через воротную вену, где они активируют воспалительные и фибротические процессы [62]. В рамках оси «кишечник – печень» продукты метаболизма микробиоты, включая короткоцепочечные жирные кислоты (SCFA), триметиламин-N-оксид и компоненты клеточной стенки, воздействуют на печень, нарушая гомеостаз глюкозы, липидов и иммунные механизмы [63].
Дополнительно установлено участие микробиоты полости рта в патогенезе МАЖБП. Колонизация печени P. gingivalis, выявленная в тканевых срезах, сопровождается активацией фиброзообразующих путей, включая TGF-β1 и галектин-3. Протеазы, транспортируемые везикулами внешней мембраны P. gingivalis, нарушают инсулинзависимую сигнализацию в гепатоцитах [64]. Клинические данные показывают, что устранение P. gingivalis приводит к снижению воспаления и фиброза печени. Терапия пародонта может оказывать системный противовоспалительный эффект, снижая уровни печеночных трансаминаз (АЛТ, АСТ) у пациентов с МАЖБП и улучшая состояние микробиоты [65].
У пациентов с циррозом печени наблюдается характерное увеличение численности микробиоты ротовой полости в кишечнике, что связано с нарушением секреции желчи и желудочной кислоты. Метагеномные исследования выявили преобладание бактерий ротовой полости в кишечной микробиоте при циррозе, а системная терапия для лечения заболеваний пародонта способствует снижению эндотоксемии и нормализации микробного метаболизма [66].
Что касается гепатоцеллюлярной карциномы (ГЦК), то она часто развивается на фоне хронических заболеваний печени, включая МАЖБП. Изменения в микробиоме полости рта у пациентов с ГЦК включают снижение альфа-разнообразия и увеличение доли таксонов, таких как Cyanobacteria, продуцирующих гепатотоксины (например, микроцистины), которые могут играть роль в канцерогенезе печени [67]. P. gingivalis, Fusobacteria и другие патогены также чаще выявляются при ГЦК. В совокупности данные подтверждают наличие взаимосвязи между микробиотой ротовой полости, кишечника и функцией печени, подчеркивая значимость концепции оси «рот – кишечник – печень» в патогенезе заболеваний печени и потенциал терапии, направленной на восстановление микробного гомеостаза [68].
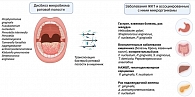
При раке поджелудочной железы выявлены характерные изменения состава орального микробиома: у пациентов наблюдается снижение количественного содержания Neisseria elongata, S. mitis, P. gingivalis и A. actinomycetemcomitans наряду с повышением уровня Granulicatella adiacens и представителей рода Leptotrichia. Эти данные свидетельствуют о возможной этиопатогенетической связи между дисбиозом оральной микробиоты и развитием рака поджелудочной железы [69]. Увеличение количества Capnocytophaga, Citrobacter, Haemophilus и Parvimonas также наблюдалось в микросреде опухолей поджелудочной железы, при этом для некоторых из них показана онкогенная активность в других органах [70]. На рисунке представлены патогены, характерные для дисбиоза микробиома ротовой полости и заболеваний ЖКТ.
Возможности профилактики и терапии
Микробиом ротовой полости играет важную роль в патогенезе заболеваний полости рта и ЖКТ, однако механизмы его влияния на указанные патологии остаются недостаточно изученными, а эффективные клинические подходы к лечению пока не разработаны. Современные стратегии профилактики и терапии таких заболеваний включают устранение патогенных микробов, применение антибиотиков, пребиотиков, генной инженерии, систем таргетной доставки и коррекцию образа жизни [71].
Микробиом оказывает значительное влияние на устойчивость опухолей к химиотерапии и иммунотерапии. В частности, F. nucleatum способствует резистентности колоректального рака к оксалиплатину через индукцию аутофагии и снижение уровня miR-4802 и miR-18a, регулирующих экспрессию генов [72].
Механическая гигиена полости рта, включая чистку зубов, способствует снижению количества пародонтопатогенов, однако ее неспецифичность может приводить к потере полезной микрофлоры. Это обосновывает необходимость точечной антибактериальной терапии, предпочтительно местной, что позволяет повысить концентрацию препаратов в очаге инфекции и снизить системные побочные эффекты [73]. Применение антибиотиков, например комбинации амоксициллина и метронидазола, демонстрирует эффективность в снижении уровня P. gingivalis, P. intermedia и T. forsythia, однако сопровождается риском развития резистентности, особенно при длительном применении, как показано у детей, получающих амоксициллин [74].
Микробиом полости рта подвержен влиянию пищевых привычек. Употребление чая связано с увеличением разнообразия микрофлоры, включая таксоны, такие как Fusobacterium, тогда как потребление кофе не оказывает значимого влияния. Курение ассоциировано с изменениями микробного состава, включая снижение Proteobacteria и увеличение Streptococcus, что указывает на потенциально неблагоприятное влияние на микробиоту и общее состояние здоровья [75].
Пробиотики, определяемые как живые микроорганизмы, оказывающие положительное воздействие на здоровье хозяина, находят все большее применение в стоматологии. Они способствуют росту полезных бактерий, подавлению патогенов и регуляции иммунного ответа [76]. Пробиотики, такие, как Streptococcus salivarius M18 и K12, Lactobacillus plantarum, L. reuteri, L. salivarius и Bifidobacterium lactis, доказали свою эффективность в подавлении патогенов, предотвращении воспаления и кариеса. S. salivarius продуцирует бактериоцины и оказывает противовоспалительное действие, взаимодействуя с эпителием десны. L. reuteri и L. salivarius уменьшают галитоз и кариесогенность вследствие ингибирования роста S. mutans и снижения кислотности зубного налета [77]. B. lactis HN019 улучшает пародонтальные показатели и снижает уровни воспалительных цитокинов, а L. plantarum подавляет рост S. mutans и Candida albicans, нарушая формирование биопленок [78].
Пептиды, короткие цепочки аминокислот, приобретают все большее значение в стоматологии благодаря своим антимикробным, реминерализующим и противовоспалительным свойствам [79]. Антимикробные пептиды (AMP), такие как дефензины и кателицидины, селективно нарушают мембраны микробных клеток, сохраняя при этом целостность эукариотических клеток. Естественные пептиды слюны, например гистатины, оказывают фунгицидное действие, особенно против C. albicans, через образование пор в мембранах патогенов и выведение ионов, таких как калий. Пептид P11-4 представляет собой инновационное средство для реминерализации зубной эмали: он формирует структуру, способствующую осаждению гидроксиапатита и восстановлению твердых тканей зуба, особенно в сочетании с фторидами [80].
Заключение
Современные данные свидетельствуют, что микробиом ротовой полости не только представляет собой локальную экосистему, обеспечивающую гомеостаз полости рта, но и оказывает системное влияние, в частности на состояние ЖКТ. Нарушения его состава и функциональной активности ассоциированы с развитием широкого спектра заболеваний ЖКТ, включая гастрит, язвенную болезнь, воспалительные заболевания кишечника, синдром раздраженного кишечника и колоректальный рак. Одним из ключевых патогенетических механизмов является миграция периодонтопатогенных бактерий, таких как P. gingivalis, F. nucleatum, P. intermedia и T. forsythia, из ротовой полости в кишечник, где они способны нарушать локальный микробный баланс, индуцировать воспаление, модулировать иммунные реакции и изменять метаболические процессы. Кроме того, растет интерес к роли оральной микробиоты в формировании устойчивости к терапии злокачественных новообразований ЖКТ вследствие инактивации препаратов, изменения барьерной функции и влияния на опухолевое микроокружение. В этом контексте микробиом ротовой полости рассматривается как перспективный биомаркер и терапевтическая мишень. Дальнейшие исследования необходимы для уточнения причинно-следственных связей и разработки персонализированных стратегий микробиомной коррекции в клинической практике.
Конфликт интересов Конфликт интересов отсутствует.
Источник финансирования Научно-исследовательская работа по подготовке рукописи проведена за счет средств субсидии на выполнение государственного задания FGMF-2025-0003.
G.E. Leonov, A.V. Starodubova, PhD
Federal Research Centre for Nutrition, Biotechnology and Food Safety, Moscow
N.I. Pirogov Russian National Research Medical University, Moscow
Contact person: Georgy E. Leonov, golerus@gmail.com
The oral microbiome represents one of the most diverse microbial ecosystems in the human body, comprising over 700 bacterial species. Its balance can be disrupted by various endogenous and exogenous factors, such as genetic predisposition, chronic diseases, and age-related changes, contributing to dysbiosis and inflammatory processes.
The "oral-gut axis" concept reflects the interconnection between the microbial communities of the oral cavity and the gastrointestinal tract, which interact via enteral and hematogenous transmission routes as well as immune mechanisms. Oral microorganisms can migrate to different segments of the gastrointestinal tract, influencing the composition of the gut microbiota, intestinal barrier integrity, and immune responses. Oral dysbiosis has been associated with gastric pathologies, including gastritis, precancerous lesions, and gastric cancer.
The translocation of oral bacteria to the gut may lead to the competitive displacement of commensal microbiota and a reduction in microbial diversity. The oral microbiome, particularly Porphyromonas gingivalis, has been implicated in the development of non-alcoholic fatty liver disease through gut colonization and activation of fibrogenic pathways. In pancreatic cancer, specific alterations in the oral microbiome have been identified, including a decrease in Neisseria elongata and Streptococcus mitis and an increase in Granulicatella adiacens.
This review summarizes current evidence on the relationship between oral dysbiosis and gastrointestinal diseases, emphasizing the importance of maintaining oral health for the prevention of systemic disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.