количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Язвенная болезнь и Маастрихт-4: внедрение в клиническую практику
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Гастроэнтерология" №6
- Аннотация
- Статья
- Ссылки
Приведены наиболее эффективные схемы эрадикации Helicobacter pylori с учетом региональной резистентности в рамках соглашения Маастрихт-4. Исследуются возможности применения различных ингибиторов протонной помпы (ИПП), их механизм действия и эффективность, лекарственное взаимодействие.
В статье даются рекомендации по тактике ведения пациентов с учетом современных данных о методах лечения язвенной болезни желудка (ЯБЖ) и язвенной болезни двенадцатиперстной кишки (ЯБДПК) в свете рекомендаций Маастрихт-4.
Приведены наиболее эффективные схемы эрадикации Helicobacter pylori с учетом региональной резистентности в рамках соглашения Маастрихт-4. Исследуются возможности применения различных ингибиторов протонной помпы (ИПП), их механизм действия и эффективность, лекарственное взаимодействие.
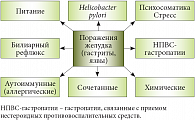
Рис. 1. Причины развития язвенной болезни желудка и язвенной болезни двенадцатиперстной кишки

Рис. 2. Влияние секреторной функции на прогноз заболевания при инфицировании Helicobacter pylori

Рис. 3. Результаты исследования соответствия международным стандартам врачебных назначений по обследованию и лечению пациентов с язвенно
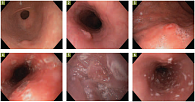
Рис. 4. Случайные находки, выявленные при эзофагогастродуоденоскопии: 1) полип пищевода; 2) папиллома пищевода; 3) атипичная эрозия желудка; 4)

Таблица 1. Причины возникновения холестаза

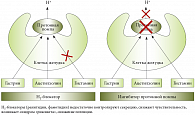
Рис. 5. Схемы эрадикации в соответствии с Маастрихт-4

Рис. 6. Механизм действия Н2-блокаторов
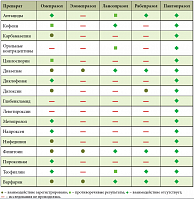
Таблица 2. Лекарственное взаимодействие ингибиторов протонной помпы
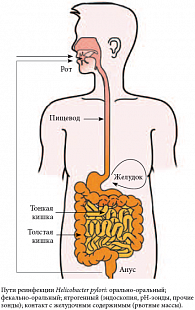
Рис. 8. Пути реинфекции Helicobacter pylori
Понимание этиологии и патогенеза ЯБЖ и ЯБДПК за последнее время стало более глубоким и обширным. Однако распространенность данной патологии достаточно высока во многих регионах мира, в том числе и в России. За время становления представлений о развитии язвенной болезни поменялось множество теорий, в том числе классические, устоявшиеся концепции:
- «Без кислоты нет язвы» (K. Schwartz, 1910);
- «Нет Helicobacter pylori – нет язвы» (D. Graham, 1989);
- «Нет Helicobacter pylori – нет H. pylori-ассоциированной язвенной болезни» (G. Tytgat, 1995).
В рамках современных представлений об этиологии язвенных заболеваний верхнего этажа желудочно-кишечного тракта рассматриваются как возможность многофакторного развития язвенной болезни, так и множество причин, в числе которых нарушение режима и структуры питания, действие кислоты желудочного сока, влияние стрессов (один из предрасполагающих и становящийся все более актуальным фактор в современном обществе), прием ряда лекарственных препаратов по поводу хронических заболеваний, билиарный рефлюкс и многие другие (рис. 1). Однако одним из наиболее часто встречающихся и распространенных факторов является инфицирование H. pylori.
Патогенез заболевания при инфицировании организма H. pylori может быть различным при прочих равных условиях. Определяющими в отношении развития изменений слизистой оболочки желудка и двенадцатиперстной кишки (ДПК) являются индивидуальные особенности секреции соляной кислоты и кислотности желудочного сока [1]. У пациентов с нормальной или высокой секреторной активностью париетальных клеток желудка соляная кислота подавляет активность H. pylori в теле желудка, и бактерии интенсивно колонизируют только антральный отдел. Там они вызывают воспаление, ограниченный антральный гастрит. Хроническое воспаление антрального отдела ведет к нарушению секреции желудка, повышению секреции гастрина и хлоридов, что вызывает закисление просвета ДПК, и появлению хронического дуоденита и язвы ДПК (рис. 2) [1, 2, 3].
Пациенты со сниженной кислотностью имеют менее благоприятный прогноз. Пониженный уровень секреции соляной кислоты способствует беспрепятственной колонизации слизистой оболочки всего желудка H. pylori. Наблюдаются воспалительные изменения тела желудка и пангастрит. Хроническое активное воспаление через воздействие ряда цитокинов в еще большей степени снижает функцию париетальных клеток желудка. В дальнейшем прогрессирование заболевания приводит к развитию атрофии, метаплазии, дисплазии слизистой и раку желудка (рис. 2) [1, 3]. Данная последовательность была открыта в 1975 г. P. Correa в отношении дифференцированного рака желудочного типа у пациентов, инфицированных H. pylori. Длительность патологического процесса может составлять, по данным разных авторов, от 12 до 18 лет. H. pylori классифицируется как канцероген 1 типа в отношении некардиального рака желудка [2, 4].
Во время эндоскопического исследования с проведением биопсии кроме кишечной метаплазии иногда встречаются и нетипичные случаи обнаружения панкреатической ацинарной метаплазии и других видов метаплазии. Все виды метаплазии следует рассматривать как фактор неблагоприятного прогноза течения заболевания. Развитие язвенных поражений тела желудка также может иметь неблагоприятный прогноз, в особенности при локализации язвенного дефекта в области малой кривизны желудка. Наличие H. pylori в подобной ситуации стимулирует развитие воспалительного процесса и его прогрессирование в последовательности каскада
P. Correa или возникновение осложнений. Классическими осложнениями ЯБЖ являются кровотечения, перфорация, пенетрация, малигнизация или развитие рубцовых деформаций желудка.
Именно вследствие всех вышеизложенных особенностей язвенной болезни большое внимание в лечении уделяется хеликобактерной инфекции, особенностям выявления и эрадикации патогенного микроорганизма. Изучению различных аспектов хеликобактерной инфекции посвящено много исследований, научных статей, проведено немало конференций. Международное соглашение по стандартизации и повышению эффективности диагностики и лечения именуется Маастрихт (рабочая группа основана в 1987 г.). Разработаны рекомендации Маастрихт-1 (1996), Маастрихт-2 (2000), Маастрихт-3 (2005). До недавнего времени врачи использовали в своей практике соглашение 3-го пересмотра.
В ноябре 2010 г. состоялось заседание Европейской группы по изучению H. pylori (The European Helicobacter pylori Study Group, EHSG), и были разработаны рекомендации Маастрихт-4 (доводились до сведения медицинского сообщества на международных конференциях, были опубликованы в журнале Gut в 2012 г.). К сожалению, в России рекомендации Маастрихт-4 внедряются крайне медленно, и к практикующим врачам информация поступает достаточно поздно. В результате получаемое пациентами лечение не во всех случаях соответствует последним стандартам. Так, исследование назначаемого лечения в России ULCER, проведенное в 2005 г. по результатам врачебных консультаций около 1400 пациентов в крупных региональных центрах, показало высокую частоту недостаточной диагностики и контроля H. pylori, назначения нерациональных схем лечения (рис. 3).
Ситуация в мире в целом демонстрирует положительный эффект от эрадикационной терапии. Так, по результатам ряда эпидемиологических исследований, частота выявления хеликобактерной инфекции в популяции за последние 10–20 лет снижается. Успешная эрадикационная терапия позволяет достигать длительной и устойчивой ремиссии заболевания. Существуют и сложности, обусловленные, в первую очередь, низкой приверженностью пациентов лечению, высокой резистентностью микроорганизма к кларитромицину, полиморфизмом генов цитохромов печени.
Актуальность проведения информативной диагностики и назначения рациональной схемы терапии очевидна. Международные рекомендации и стандарты, обобщающие результаты работы исследовательских центров, основываются на огромном опыте диагностики и лечения хеликобактерной инфекции. Однако доведение информации до практикующих врачей представляет определенные сложности. Анализ рекомендаций Маастрихт-4 и внедрение их в клиническую практику являются стратегической задачей современной медицины.
Диагностические возможности и рекомендации Маастрихт-4
В классической школе пропедевтики внутренних болезней 80% диагноза определяется жалобами пациента и анамнезом. У пациентов могут присутствовать болевой синдром, более выраженный в эпигастрии и связанный с приемом пищи, и диспептический синдром с преобладанием изжоги, а также отрыжка, чувство тяжести и переполненности в животе, снижение аппетита. Выявление связи симптомов с приемом пищи может дать информацию о вероятной язве желудка (прием пищи не изменяет интенсивность) или язве ДПК (облегчение болей после приема пищи). В редких случаях язвенная болезнь сопровождается тошнотой, рвотой желчью или кровью в случае кровотечения (гематемезис), изменением цвета стула в темные оттенки, вплоть до черного (мелена) [5, 6].
В связи с самолечением пациентов течение заболевания может быть малосимптомным или бессимптомным. Возможно развитие «немых» язв или острого поверхностного гастрита. Поэтому исходя из практики, особенностей течения язвенной болезни и патогенеза язвы, а также учитывая индивидуальную висцеральную чувствительность пациента, клиническая картина представляется малоинформативной [5, 6].
Одним из наиболее информативных является метод эндоскопической диагностики. В ряде случаев при обследовании выявляются случайные находки в виде кандидозного эзофагита, язв пищевода, полипов и атипичных эрозий желудка, различного рода деформаций и стриктур, сгустков желчи в желудке и ряда других изменений (рис. 4). Рекомендации Маастрихт-4 предполагают общую стратегию, получившую название test and treat («обследуй и лечи»). Данный подход необходим у пациентов с неуточненной диспепсией и неприменим у лиц с симптомами «тревожности» или пожилого возраста. Для указанных групп пациентов более приемлемой является стратегия endoscopy and treat («проведи эндоскопию и лечи») [7, 8].
В качестве методов выявления H. pylori на сегодняшний день применяются уреазный дыхательный тест, исследование кала на наличие антигенов или дезоксирибонуклеиновой кислоты (ДНК) H. pylori, а также серологические методы. Однако у пациентов, принимающих ингибиторы протонной помпы (ИПП), необходима отмена терапии за 2 недели до проведения уреазных тестов, анализа кала, гистологического или культурального исследования. Вероятно, в условиях российской действительности это правило редко будет применяться на практике. Для таких случаев, когда отмена терапии на указанный срок невозможна или затруднительна, предусмотрено предпочтительное проведение серологического исследования. На результаты этого метода не оказывают влияния локальные изменения слизистой оболочки желудка, приводящие к получению ложноотрицательных результатов других тестов. В обязательном порядке должен проводиться контроль лечения и повторное определение H. pylori. Сроки проведения контроля – 4 недели после окончания эрадикационной терапии [7, 9, 10].
При выявлении у пациента железодефицитной анемии неясной этиологии, дефицита витамина В12, идиопатической тромбоцитопенической пурпуры необходимо проведение диагностики хеликобактерной инфекции и при положительных результатах тестов – эрадикационной терапии [7, 8, 11]. Периодический эндоскопический контроль должен производиться при выявлении атрофии средней и тяжелой степени каждые 2–3 года, а при выявлении дисплазии – каждые 6 месяцев [7, 9].
При обнаружении хеликобактерной инфекции эрадикация проводится по определенным показаниям (табл. 1). К абсолютным показаниям относятся: выявленная язвенная болезнь и язвенная болезнь в анамнезе, атрофический гастрит, экстранодальная лимфома из клеток маргинальной зоны (MALT-лимфома, mucosal associated lymphoid tissue – лимфоидная ткань слизистых), состояние после резекции желудка. Относительными показаниями являются: прием нестероидных противовоспалительных средств (НПВС), железодефицитная анемия неясной этиологии, дефицит витамина В12, идиопатическая тромбоцитопеническая пурпура. В отличие от рекомендаций Маастрихт-3, в новых рекомендациях бессимптомная инфекция и гастроэзофагеальная рефлюксная болезнь желудка не включены в число показаний к проведению эрадикации [7, 12].
Возможно проведение антихеликобактерной терапии с профилактической целью при наличии диагноза «рак желудка» у родственников первой линии, рака желудка в анамнезе, гастрите высокого риска (тяжелый пангастрит, гастрит с преимущественным поражением тела желудка, тяжелой атрофией), наличии факторов риска рака желудка, длительном подавлении секреции желудка (более 1 года), а также у пациентов, опасающихся развития рака желудка [7, 8, 9].
Терапевтические возможности и рекомендации Маастрихт-4
Согласно новым рекомендациям, в качестве стандартной схемы эрадикации предлагается проведение трехкомпонентной терапии, включающей ИПП + кларитромицин + амоксициллин или метронидазол. Указывается, что возможно использование высоких доз ИПП с кратностью приема 2 раза в день для увеличения эффективности терапии. При этом рекомендованная длительность лечения может составлять 10 дней. Увеличение длительности терапии с 7 до 10–14 дней повышает эффективность эрадикации на 5% [7, 11].
Сложно оценить использование данных рекомендаций на практике. Увеличение дозировки ИПП, возможно, найдет широкое применение в лечении. Напротив, с учетом часто возникающих побочных эффектов от антибактериальной терапии преимущество более длительного курса лечения, повышающего эффективность эрадикации лишь на 5%, представляется весьма спорным. В рекомендациях отмечена возможность назначения в рамках комплексной терапии пробиотиков и пребиотиков в качестве дополнительных препаратов с целью уменьшения побочных эффектов терапии. Данные по применению лактобактерий противоречивы, хорошие результаты показало применение препаратов Saccharomyces boulardii [7, 12].
Рекомендации Маастрихт-4 практически не оставляют врачам пространства для маневра и коррекции лечения. Так, трехкомпонентная терапия не нуждается в коррекции, исключение составляют доза и длительность лечения. Новым положением рекомендаций является последовательная терапия, состоящая из 2 циклов. Каждый цикл может иметь длительность от 4 до 6 дней. На фоне постоянного приема ИПП производится последовательная смена антибиотика: в начале терапии – амоксициллин, в конце терапии – кларитромицин и метронидазол. По результатам новых исследований, в зависимости от чувствительности к кларитромицину возможно применение метронидазола. То есть, если чувствительность к кларитромицину высокая, то нет необходимости определения чувствительности ко второму антибиотику [7, 8, 9].
В случае неэффективности трехкомпонентной терапии показана четырехкомпонентная терапия, включающая препарат висмута, или тройная терапия с левофлоксацином. При отсутствии результатов лечения терапией второй линии третью линию лечения необходимо начинать с определения чувствительности H. pylori к антибиотикам (рис. 5). С целью проведения более эффективной эрадикационной терапии с учетом региона и резистентности наиболее предпочтительно проведение квадротерапии или последовательной терапии, а также включение в схему эрадикации препарата висмута трикалия дицитрат. По результатам ряда исследований, показавших высокую эффективность препаратов, целесообразно включение в комплексную терапию препаратов амоксициллин и джозамицин.
Существует множество различных групп препаратов, снижающих секреторную способность желудка и патогенное действие соляной кислоты. Так, антацидные препараты и альгинаты обладают коротким периодом снижения кислотности. Причем антациды имеют более выраженный и менее продолжительный эффект. Альгинаты действуют менее интенсивно, но более продолжительно, целесообразным представляется их назначение при гастроэзофагеальной рефлюксной болезни в качестве патогенетического средства [13, 14].
Угнетение секреции желудка начиналось с применения группы Н2-блокаторов (рис. 6). Однако в силу ряда причин их использование было ограничено, и в современных схемах эти препараты занимают очень ограниченное место. Это связано, главным образом, с развитием синдрома «рикошета» после завершения терапии Н2-блокаторами, сопровождающегося резким усилением продукции кислоты. Также у значимой части пациентов развивалась резистентность к терапии на фоне появления побочных эффектов [13, 15].
Механизм блокирования секреции заключался в выключении одного из трех основных механизмов активации протонной помпы. В дальнейших исследованиях были обнаружены другие способы угнетения секреции соляной кислоты, в том числе блокада самой протонной помпы. Эта группа препаратов получила название ингибиторов протонной помпы (ИПП) и стала «золотым стандартом» лечения ЯБЖ и ЯБДПК. Разработки последних лет в области фармакотерапии установили эффективность левовращающих изомеров многих действующих веществ. С этого момента начался новый этап в терапии, затронувший антигистаминные, антисекреторные препараты и многие другие. Также детально были изучены особенности строения протонной помпы, и установлено, что она состоит из нескольких субъединиц. Большинство ИПП блокирует только одну субъединицу помпы. Обе субъединицы блокируются препаратом пантопразол (Контролок) (рис. 7) [15, 16].
По результатам множества клинических исследований Контролок продемонстрировал лучшие среди ИПП показатели блокирования протонной помпы. Так, продолжительность угнетения секреции при использовании стандартной дозировки препарата составляет 46 часов. При этом большинство используемых в лечении препаратов имеют путь выведения через систему цитохромов печени. Если учесть, что пациенты нередко одновременно принимают несколько лекарственных препаратов по поводу язвенной болезни, а также терапию для лечения сопутствующих заболеваний, представляется, что такая терапия будет сопровождаться высокой нагрузкой на функции печени, а также высоким риском лекарственного взаимодействия. Среди наиболее часто используемых ИПП пантопразол (Контролок) обладает наименьшим потенциалом взаимодействия с лекарствами, детоксикация которых протекает с участием CYP2C19, и самую низкую аффинность к системе цитохрома Р450. Контролок является препаратом, для которого исследованы возможности метаболизма и перекрестных реакций с другими лекарственными средствами [13, 16, 17].
Целесообразно включение в комплексную терапию язвенной болезни препарата Контролок (пантопразол) как наиболее эффективного препарата по механизму блокирования протонной помпы и имеющего минимальное лекарственное взаимодействие (табл. 2). Результаты недавно проведенных исследований показывают, что хроническое воспаление слизистой желудка не прекращается с элиминацией возбудителя. Длительное время наблюдается персистирование воспалительного нейтрофильного инфильтрата, оказывающего прямое (активные формы кислорода) и опосредованное (цитокины) повреждающее действие на слизистую. Данный инфильтрат служит фактором риска развития эрозий и язв желудка. При естественном течении инфильтрат сохраняется в течение 1 месяца после успешной эрадикации хеликобактерной инфекции [18, 19].
При проведении эффективной эрадикационной терапии и подтверждении результатов не следует забывать, что воспалительный инфильтрат сохраняется длительное время, до 1 месяца. Безусловно, проведение антихеликобактерной терапии способствует нормализации клеточного обновления. Вместе с тем сохраняющийся определенное время инфильтрат связан с повреждением клеток. Таким образом, для пациентов с эксхеликобактерным гастритом необходимо включать в программу последующего наблюдения препараты с цитопротективным эффектом, позволяющие защитить слизистую оболочку желудка от повреждающего действия провоспалительных субстратов [20].
Группа гастропротекторов включает несколько лекарственных средств, к которым относятся висмута трикалия дицитрат, сукральфат, мизопростол, пентоксифиллин. В многочисленных исследованиях показано, что препараты висмута образуют защитный слой на пораженных участках слизистой оболочки, предохраняют ее от действия болезнетворных факторов, стимулируют секрецию слизи, способствуют регенерации эпителия и восстановлению кровообращения. Также установлено, что висмута трикалия дицитрат обладает противомикробным действием в отношении H. pylori. Использование данного препарата в эксхеликобактерный период способствует профилактике рецидивов и реинфекции [21].
По окончании терапии следует информировать пациентов о возможных путях реинфекции и объяснять, в чем отличие реинфекции от рецидива заболевания. Реинфекция является новым повторным эпизодом заболевания, не связанным с ранее возникшим. Основными путями реинфекции являются орально-оральный, фекально-оральный и ятрогенный (рис. 8). В отличие от реинфекции, рецидив заболевания связан с неэффективностью эрадикационной терапии, отсутствием эффективности эрадикации, приемом НПВС и ацетилсалициловой кислоты во время эрадикации.
Заключение
Таким образом, высокая актуальность проведения качественной диагностики и лечения H. pylori очевидна. Международные рекомендации и стандарты служат основой для проведения лечения. Тем не менее доведение информации до практикующих врачей представляет определенные сложности. Анализ рекомендаций Маастрихт-4 и внедрение их в клиническую практику являются стратегической задачей современной медицины.
1. Маев И.В., Самсонов А.А., Андреев Н.Г., Кочетов С.А. Что мы знаем о хроническом гастрите? // Фарматека. 2011. № 10 (223). С. 10–17.
2. Kusters J.G., van Vliet A.H., Kuipers E.J. Pathogenesis of Helicobacter pylori infection // Clin. Microbiol. Rev. Vol. 19. № 3. P. 449–490
3. Axon A.T. Relationship between Helicobacter pylori gastritis, gastric cancer and gastric acid secretion // Adv. Med. Sci. 2007. Vol. 52. P. 55–60.
4. Asaka M., Kimura T., Kato M., Kudo M., Miki K., Ogoshi K., Kato T., Tatsuta M., Graham D.Y. Possible role of Helicobacter pylori infection in early gastric cancer development // Cancer. 1994. Vol. 73. № 11. P. 2691–2694.
5. Вялов С.С. Гастроэнтерология. Практическое руководство. М.: МЕДпресс-информ, 2012. 192 с.
6. Вялов С.С. Алгоритмы диагностики. Практическое руководство. М.: МЕДпресс-информ, 2012. 128 с.
7. Malfertheiner P., Megraud F., O’Morain C.A., Atherton J., Axon A.T., Bazzoli F., Gensini G.F., Gisbert J.P., Graham D.Y., Rokkas T., El-Omar E.M., Kuipers E.J. Management of Helicobacter pylori infection – the Maastricht IV. Florence Consensus Report // Gut. 2012. Vol. 61. № 5. P. 646–664.
8. Chey W.D., Wong B.C. American College of Gastroenterology guideline on the management of Helicobacter pylori infection // Am. J. Gastroenterol. 2007. Vol. 102. № 8. P. 1808–1825.
9. Malfertheiner P., Meguard F., O’Morain C., Bazzoli F., El-Omar E., Graham D., Hunt R., Rokkas T., Vakil N., Kuipers E.J. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report // Gut. 2007. Vol. 56. № 6. P. 772–781.
10. Yuan W., Li Yumin, Yang Kehu, Ma Bin, Guan Quanlin, Wang D., Yang L. Iron deficiency anemia in Helicobacter pylori infection: meta-analysis of randomized controlled trials // Scand. J. Gastroenterol. 2010. Vol. 45. № 6. P. 665–676.
11. Маев И.В., Самсонов А.А., Андреев Д.Н., Кочетов С.А. Эволюция представлений о диагностике и лечении инфекции Helicobacter pylori (по материалам консенсуса Маастрихт-4, Флоренция, 2010) // Вестник практического врача. 2012. № 1. С. 23–30.
12. Рафальский В.В. Реомендации Маастрихт-4: выбор схемы эрадикации в эру роста антибиотикорезистентности H. pylori // Вестник практического врача. 2012. № 1. С. 31–37.
13. Вялов С.С. Комплексная терапия рецидивирующих гастродуоденитов // Рациональная фармакотерапия в гастроэнтерологии. Материалы XII конференции, Москва, 2012. С. 4–5.
14. Вялов С.С. Сравнительная оценка эффективности антацидных препаратов в лечении патологии желудочно-кишечного тракта у лиц молодого возраста // РМЖ. 2010. Т. 18. № 22. С. 1–5.
15. Blume H., Donath F., Warnke A., Schug B. Pharmacokinetic drug interaction profiles of proton pump inhibitors // Drug. Saf. 2006. Vol. 29. № 9. P. 769–784.
16. Li X.Q., Andersson T.B., Ahlstorm M., Weidolf L. Comparison of inhibitory effects on the proton pomp-inhibiting drugs omeprasol, esomeprasol, lansoprasol, pantoprasol and rabeprasol on human cytochrome P450 activities // Drug. Metab. Dispos. 2004. Vol. 32. № 8. P. 821–827.
17. Яковенко Э.П., Яковенко А.В., Агафонова Н.А., Овчинникова Н.И., Иванов А.Н., Алдиярова М.А., Прянишникова А.С., Гусейнова Л.А., Солуянова И.П. Пептические язвы, патогенетические подходы к терапии // Фарматека. 2008. № 13. С. 62–67.
18. Ливзан М.А., Кононов А.В., Мозговой С.И. Постэрадикационный период хронического гастрита, ассоциированного с инфекцией Helicobacter pylori // Comsilium Medicum. 2008. № 8. С. 15–20.
19. Кононов А.В., Ливзан М.А., Мозговой С.И. Гастрит после эрадикации Helicobater pylori – простые следы или серьезные последствия? // Лечащий врач. 2011. № 7.
20. Tussay Z., Herszeni L. Gastric mucosal defense and cytoprotetion // Best Pract. Res. Clin. Gastroenterol. 2010. Vol. 24. № 2. P. 99–108.
21. Bagchi D., McGinn T.R., Ye X., Balmoori J., Bagchi M., Stohs S.J., Kuszynski C.A., Carryl O.R., Mitra S. Mechanism of gastroprotection by bismuth subsalicylate against chemically induced oxidative stress in cultured human gastric mucosal cells // Dig. Dis. Sci. 1999. Vol. 44. № 12. P. 2419–2428.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.