Макролиды на современном этапе: привычная практика или обоснованный выбор? Вопрос экспертам. II Всероссийский форум с международным участием «Междисциплинарный подход к лечению заболеваний головы и шеи». Сателлитный симпозиум компании Astellas
- Аннотация
- Статья
- Ссылки





![Рис. 4. Развитие резистентности пневмококков на фоне применения различных антибиотиков [25]](/upload/resize_cache/iblock/d14/195_350_1/astellas9.jpg)
Современные представления о преимуществах макролидных антибиотиков в ЛОР-практике
Заведующий кафедрой общей и клинической фармакологии Российского университета дружбы народов, д.м.н., профессор Сергей Кенсаринович ЗЫРЯНОВ свой доклад о преимуществах использования макролидов в лечении инфекционных заболеваний ЛОР-органов начал с небольшого экскурса в историю.
Первые макролиды (эритромицин, олеандомицин) появились на отечественном фармацевтическом рынке еще в 1952 г. Впоследствии были синтезированы другие 14-членные макролиды, затем 15-членные (азитромицин) и, наконец, 16-членные макролиды, которые в настоящее время представлены природными (спирамицин, джозамицин) и полусинтетическими (мидекамицин) макролидами.
Избыточное применение антибактериальных препаратов, в том числе макролидов, привело к возникновению феномена бактериальной устойчивости к антибиотикам. Авторы исследования ПеГАС IV выявили тенденцию к повышению устойчивости пневмококка к макролидам: только 72,8% исследованных изолятов сохраняют чувствительность к кларитромицину, 72,6% – к азитромицину, 72,8% – к эритромицину, 81,8% изолятов чувствительны к клиндамицину (маркер резистентности к 16-членным макролидам). Конечно, подобная информация не может оставаться без внимания. Должны быть предприняты меры по ограничению применения макролидов. Тем не менее определенная ниша для использования макролидов остается, что позволяет сохранить их для применения в клинической практике.
Например, по мнению профессора С.К. Зырянова, макролиды нового поколения эффективны в качестве эмпирической терапии бактериальных инфекций ЛОР-органов и остаются в алгоритмах лечения, что подтверждается данными клинических исследований. Важно, что в таких исследованиях этиотропную терапию назначали эмпирически, без идентификации патогенного фактора. Следует учитывать основной спектр респираторных патогенов у детей с инфекциями дыхательных путей бактериальной природы. По данным некоторых исследований, причиной аденоидита и тонзиллита у детей, подвергшихся аденотонзиллэктомии, в 10,9% случаев была Mycoplasma pneumoniae, в 18,2% – Chlamydia pneumoniae1. Это дает основания для применения макролидов, в частности, у данной категории пациентов.
Появляются новые данные в отношении профиля безопасности макролидов. Как правило, речь идет о кардиотоксичности и гепатотоксичности. По мнению автора, следует отметить, что в целом макролиды характеризуются благоприятным профилем безопасности и хорошей переносимостью.
С.К. Зырянов считает, что результаты исследований свидетельствуют о сердечно-сосудистой безопасности макролидов. Так, анализ применения азитромицина в популяции пациентов младше 40 лет не выявил негативного влияния на процессы реполяризации миокарда и даже показал определенное преимущество азитромицина перед бета-лактамным антибиотиком2. Однако в популяции старше 40 лет с факторами риска (женский пол, структурные заболевания сердца, брадикардия, генетическая предрасположенность, электролитные нарушения, лекарственное взаимодействие, печеночная или почечная недостаточность и проч.) на фоне применения азитромицина летальность увеличивалась в 1,6 раза.
Определенные сердечно-сосудистые проблемы могут быть связаны с использованием кларитромицина. Следует подчеркнуть, что в последнее время все больше разговоров, касающихся кардиотоксичности, ведется в отношении кларитромицина.
Обращают на себя внимание результаты исследования «Кларикор», опубликованные в 2015 г. Данные десятилетнего наблюдения показали, что применение кларитромицина увеличивает общую и сердечно-сосудистую смертность3.
Указанные факторы риска необходимо учитывать при выборе макролидных антибиотиков в качестве лечебной технологии. Что касается гепатотоксического потенциала макролидов, по словам докладчика, он невысок – 3,6 случая на 100 000 пациентов4.
Говоря о преимуществах и недостатках макролидов, профессор С.К. Зырянов коснулся особенностей их фармакокинетики и фармакодинамики. Установлено, что кларитромицин, джозамицин, азитромицин способны проникать в фагоцитирующие клетки и транспортироваться в очаг воспаления. Концентрация этих антибиотиков в тканях длительно сохраняется на терапевтическом уровне вследствие медленного высвобождения из клеток. Внутриклеточное проникновение и накопление препаратов в 90–123 раза больше в альвеолярных макрофагах. Кроме того, макролиды, обладая стимулирующими свойствами, повышают фагоцитарную активность.
Профессор С.К. Зырянов обратил внимание, что препаратов, которые были бы лишены нежелательных лекарственных реакций, не существует. С точки зрения докладчика, на сегодняшний день макролиды, несмотря на проблемы, связанные с резистентностью, которая, безусловно, существует, сохраняют свое место в алгоритме лечения заболеваний ЛОР-органов. И это место должно быть за ними сохранено, закреплено и определено в иерархии антимикробных препаратов, используемых в настоящее время у пациентов с ЛОР-заболеваниями.
Макролидные антибиотики: эмпирическая терапия или узкая ниша
По данным Всемирной организации здравоохранения (ВОЗ), ежегодно инфекции ЛОР-органов переносят до 44% населения. При этом у каждого четвертого болезнь рецидивирует или переходит в хроническую форму.
По словам профессора кафедры оториноларингологии лечебного факультета и кафедры микробиологии и вирусологии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, д.м.н. Александра Владимировича ГУРОВА, клиническое выздоровление невозможно без эрадикации патогенов. Докладчик рассмотрел основные микробные возбудители и их чувствительность к антибактериальным препаратам.
Ведущими бактериальными возбудителями инфекций дыхательных путей считаются Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis. Наиболее значимыми возбудителями острых гнойно-воспалительных инфекций ЛОР-органов являются St. pneumoniae и H. influenzae, причем St. pneumoniae чаще определяется при остром бактериальном риносинусите, H. influenzae – при остром среднем отите5. Кардинальным различием в биологических свойствах St. pneumoniae и H. influenzae обусловлен определенный патоморфоз – изменение клинических проявлений гнойной патологии ЛОР-органов6.
Данные международных и собственных клинических исследований демонстрируют абсолютно разную клиническую картину течения пневмококковой и гемофильной инфекции. О наличии того или иного микроорганизма в конкретном случае можно судить по триггерным факторам и клинической симптоматике.
Острое воспаление обычно завершается полным выздоровлением. Тем не менее нерациональная терапия, особенно в условиях резистентности, способна привести к хронизации процесса. В рутинной практике все чаще имеет место затянувшийся рецидивирующий острый средний отит или рецидивирующий синусит.
Что же является причиной хронизации инфекций в оториноларингологии? Одной из ведущих причин хронизации и частого рецидивирования гнойно-воспалительной патологии является рост устойчивости клинически значимых патогенов к традиционно используемым антибиотикам. Резистентность St. pneumoniae к макролидам выше, чем к бета-лактамам, а к ко-тримоксазолу и тетрациклину превышает 50%7. Низкая природная активность макролидов в отношении H. influenzae предполагает риск неуспеха терапии. Устойчивость St. pyogenes к макролидам клинически значима и в России составляет около 25%7.
Согласно концепции резистентности, макролиды, прежде всего азитромицин, обладающие длительным периодом полувыведения, создают продолжительные «селективные окна» и повышают вероятность развития резистентности8.
В качестве примера можно привести данные динамики резистентности пневмококка в столице. В Москве устойчивость St. pneumoniae к азитромицину за период 2009–2016 гг. увеличилась с 8,4 до 21,3%. Об этом свидетельствуют данные исследования, проведенного в научно- исследовательском клиническом институте оториноларингологии им. Л.И. Свержевского.
Этой тревожной ситуации посвящены исследования, проведенные в НИИ антимикробной химиотерапии. В частности, речь идет о многоцентровом исследовании оценки активности антимикробных препаратов в отношении возбудителей внебольничных инфекций верхних дыхательных путей и инфекций мочевыводящих путей, проведенном в пяти странах. Согласно результатам исследования, опубликованным в 2016 г., рост устойчивости к противомикробным препаратам стал проблемой при лечении амбулаторных больных. Например, штаммы пневмококка, полученные из медицинских центров России, характеризуются более чем 40%-ным уровнем устойчивости к азитромицину и кларитромицину, что ограничивает их применение для эмпирической терапии инфекций дыхательных путей. Важно, что в данном исследовании участвовали сотрудники НИИ антимикробной химиотерапии, координирующие крупнейшие исследования антимикробных препаратов в РФ (рис. 1)9.
Какой же существует выход из сложившейся ситуации? Прежде всего следует обратиться к международному опыту. Международные эксперты исключили 15-членный макролид азитромицин из рекомендаций по лечению инфекций дыхательных путей. В клинических рекомендациях IDSA (Infectious Diseases Society of America – Американское общество по борьбе с инфекционными заболеваниями) 2012 г. сказано, что макролиды, такие как кларитромицин и азитромицин, нецелесообразно использовать в эмпирической терапии острого риносинусита из-за высокой резистентности St. pneumoniae. Данная позиция согласуется с позицией ВОЗ. Эксперты ВОЗ рекомендуют азитромицин исключительно при урогенитальной инфекции10.
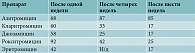
По мнению большинства специалистов, перечень макролидов, рекомендованных для лечения инфекций дыхательных путей, следует ограничить двумя – 16-членным джозамицином и 14-членным кларитромицином с указанием на предпочтение джозамицина из-за более низкой к нему устойчивости пневмококков и относительно медленного развития резистентности возбудителей дыхательных путей в процессе лечения (табл. 1)11.
Что касается российского опыта, на текущий момент препаратом стартовой терапии в практике отоларинголога признан амоксициллин/клавуланат. Данная позиция закреплена в Евразийских клинических рекомендациях 2016 г. Научным и клиническим обоснованием подобного выбора служат результаты ряда отечественных и зарубежных исследований.
Особый интерес представляют сравнительные исследования амоксициллина/клавуланата и азитромицина. В исследованиях амоксициллин/клавуланат продемонстрировал более высокую клиническую и бактериологическую эффективность по сравнению с азитромицином в терапии острого среднего отита у детей (рис. 2)12.
Согласно данным Кокрановского метаанализа 20 исследований, посвященных сравнительной оценке эффективности терапии коротким курсом макролидов (азитромицин) и стандартным курсом пенициллина у детей с острым тонзиллофарингитом, риск позднего рецидива оказался выше при лечении макролидами. Достоверных различий по частоте клинической неэффективности терапии не выявлено. Метаанализ 14 рандомизированных клинических исследований сравнительной эффективности коротких курсов азитромицина и стандартной терапии пенициллинами и цефалоспоринами у детей с тонзиллофарингитом, вызванным бета-гемолитическим стрептококком серологической группы А (БГСА), показал, что вероятность бактериологической неэффективности при использовании азитромицина в три раза выше, чем на фоне применения стандартной терапии пенициллинами и цефалоспоринами13.
Профессор А.В. Гуров отметил, что устойчивость возбудителей к макролидам обратима в случае внедрения перечисленных мер. Сохранить эти уникальные препараты для дальнейшего применения, в том числе для терапии верхних дыхательных путей, позволят только бережное отношение к ним и применение в качестве препаратов третьей линии.
Можно ли остановить рост резистентности к макролидам?
Критерии, определяющие включение антибиотика в клинические рекомендации при инфекциях верхних дыхательных путей, основаны на результатах клинических исследований, а также на микробиологических и фармакокинетических данных. По словам профессора кафедры госпитальной терапии № 2 Первого Московского государственного медицинского университета им. И.М. Сеченова, д.м.н. Сергея Владимировича ЯКОВЛЕВА, методологические подходы к проведению клинических исследований и оценке их результатов не соответствуют реальной клинической практике. Прежде всего это касается репрезентативности выборки пациентов, включенных в клинические исследования (не включаются пациенты с тяжелой коморбидностью и риском инфекции, вызванной антибиотикорезистентными возбудителями), а также оценки результатов лечения только на основании достигнутого клинического эффекта. Последнее не может рассматриваться в качестве адекватной оценки эффективности антибиотика при инфекциях верхних дыхательных путей, для которых характерен высокий уровень спонтанного выздоровления. При таких инфекциях бактериологический эффект лечения (эрадикация возбудителя) служит наиболее достоверным критерием эффективности антибиотика, но не всегда оценивается в клинических исследованиях. Установлено, что при достижении эрадикации наблюдается не только более быстрое выздоровление пациента, но также снижение риска осложнений (например, в случае А-стрептококковых инфекций глотки) и риска колонизации верхних дыхательных путей антибиотикорезистентными микроорганизмами.
Вероятность достижения эрадикации возбудителя при проведении антибактериальной терапии зависит от природной активности антибиотика в отношении микроорганизма, которую оценивают на основании значений минимальных подавляющих концентраций, а также от уровня антибиотикорезистентности наиболее актуальных возбудителей в популяции. Так, в многочисленных исследованиях показано, что эрадикация H. influenzae у больных с острым средним отитом и бронхитом существенно выше (в 1,5–2 раза) при лечении высокоактивными антибиотиками (амоксициллин, фторхинолоны) по сравнению с менее активными макролидами при сопоставимой клинической эффективности.
При оценке результатов исследований антибиотикорезистентности респираторных патогенов следует учитывать важный момент (на котором не всегда акцентируют внимание), существенно влияющий на интерпретацию полученных данных. Имеются в виду различия в применяемых критериях оценки чувствительности и резистентности микроорганизмов к антибиотикам.
Существуют две системы микробиологических лабораторных стандартов – американская CLSI (Clinical Laboratory Standards Institute – Институт клинических и лабораторных стандартов) и европейская EUCAST (European Committee on Antimicrobial Susceptibility Testing – Европейский комитет по тестированию антимикробной чувствительности). С клинических позиций система EUCAST более адекватная, поскольку критерии чувствительности микробов к антибиотику разрабатываются на основании фармакодинамического моделирования и соотносятся с результатами применения антибиотика в клинических условиях. В России с 2016 г. микробиологическим лабораториям рекомендовано использовать систему EUCAST.
Реальный уровень устойчивости St. pneumoniae и H. influenzae к антибиотикам в России зависит от используемой системы (CLSI или EUCAST). Например, частота устойчивых штаммов St. pneumoniae к пенициллину в России по CLSI (> 2 мг/л) составляет 3,7%, а при оценке по EUCAST (> 0,06 мг/л) – 19,8%14. Высокий уровень устойчивости пневмококка к пенициллину не может быть экстраполирован на амоксициллин: к нему устойчивость существенно ниже – не более 5% в разных исследованиях по CLSI. EUCAST не приводит критерии чувствительности пневмококка к амоксициллину, предлагая использовать критерии ампициллина. Кроме того, устойчивость пневмококка к цефалоспоринам третьего поколения выше при оценке по EUCAST (6,6%) по сравнению с CLSI (2,8%).
По мнению профессора С.В. Яковлева, критерии EUCAST более объективно отражают современную ситуацию с распространением антибиотикорезистентности респираторных патогенов. Это наглядно можно продемонстрировать на примере макролидных антибиотиков.
В странах Евросоюза устойчивость St. pneumoniae к макролидам в последние десять лет неуклонно растет и в большинстве стран превышает 20% (порог устойчивости в популяции, принятый для глобальных рекомендаций по прекращению использования конкретных антибиотиков в данном регионе), что означает сомнительную эффективность этих антибиотиков при пневмококковых инфекциях. В России устойчивость St. pneumoniae к 14- и 15-членным макролидам (кларитромицину и азитромицину) в среднем увеличилась до 15,5%, к 16-членным макролидам (джозамицину) она меньше – 9%. Важно знать не только усредненные данные по стране, которые отражают лишь тенденцию и не могут служить ориентиром при выборе тактики лечения, но и региональные данные. Так, исследования, проведенные в Москве и Санкт-Петербурге, показали гораздо более высокую устойчивость пневмококка к кларитромицину и азитромицину – 26 и 33% соответственно15, 16.
Много лет в России активно пропагандировалась позиция о низком уровне устойчивости к макролидам второго по значимости возбудителя респираторных инфекций – H. influenzae. При этом всегда приводились критерии чувствительности CLSI. Однако, как уже отмечалось, эти критерии плохо коррелируют с бактериологическими результатами лечения. Результаты оценки чувствительности гемофильной палочки к макролидам в соответствии с EUCAST свидетельствуют об обратном: 100%-ная устойчивость к азитромицину, 97%-ная – к кларитромицину9. Низкая активность макролидов в отношении H. influenzae проявляется высокой частотой бактериологического неуспеха в виде персистирования возбудителей.
Европейские и американские эксперты считают, что макролиды не обеспечивают эрадикацию гемофильной палочки из дыхательных путей. На основании этого в настоящее время эксперты EUCAST рассматривают гемофильную палочку как природно нечувствительную к макролидным антибиотикам и тем самым ставят точку в споре об уровне устойчивости. Эффективность макролидов при остром синусите и бронхите, вызванном H. influenzae, незначительно превышает таковую плацебо или соответствует ей. Макролиды не могут быть рекомендованы для применения в первой линии терапии.
Ряд зарубежных авторов отмечают, что:
- устойчивость возбудителей инфекций дыхательных путей к макролидам возрастает по мере увеличения их использования;
- устойчивость к ним развивается быстрее, чем к бета-лактамам;
- развитие устойчивости может сопровождаться клиническим неуспехом;
- устойчивость к макролидам потенциально обратима17–20.
Сказанное подтверждает необходимость внедрения ограничительных мер.
Американская академия оториноларингологов (American Academy of Otolaryngology – Head and Neck Surgery) при разработке рекомендаций по лечению острого синусита использует фармакодинамическую модель прогнозирования эффекта антибиотиков в отношении эрадикации основных патогенов (St. pneumoniae, H. influenzae). Поскольку вероятность достижения эффекта при остром синусите на фоне применения макролидов оценивается на уровне спонтанного выздоровления и составляет 77–81%, эти препараты не включены в рекомендации по лечению острого синусита в 2015 г. (табл. 2).
Аналогичной позиции придерживаются педиатры. Американская академия педиатров и Канадское педиатрическое общество не рекомендуют применять макролиды у детей при остром среднем отите, фарингите и остром риносинусите, а Американское общество инфекционных болезней рекомендует макролиды при А-стрептококковом тонзиллите исключительно при невозможности назначения бета-лактамов (аллергия)21, 22.
Еще в 2003 г. российские эксперты утверждали, что рекомендации по выбору оптимального антибиотика должны не только основываться на результатах клинических исследований, но также учитывать региональные тенденции антибиотикорезистентности и способность антибиотиков вызывать селекцию резистентных штаммов. Широкое применение в нашей стране азитромицина вызывает большую озабоченность, поскольку его тканевые концентрации недостаточны для эрадикации St. pneumoniae и H. influenzae. Вследствие широкого применения макролидов при тонзиллитах возрастает устойчивость к этим препаратам не только стрептококков, но и других респираторных патогенов, прежде всего пневмококков23.
Рост устойчивости возбудителей инфекций дыхательных путей к макролидам напрямую связан с увеличением частоты их применения. Развитие устойчивости сопровождается снижением клинической эффективности макролидных антибиотиков. Безусловно, не все макролиды одинаково влияют на формирование устойчивости возбудителей. В большей степени это свойственно препаратам пролонгированного действия. В одном из исследований при использовании азитромицина и кларитромицина наблюдалось увеличение частоты колонизации пациентов резистентными стрептококками (более выраженное на фоне приема азитромицина) по сравнению с плацебо, причем данная колонизация сохранялась до шести месяцев после прекращения терапии24.
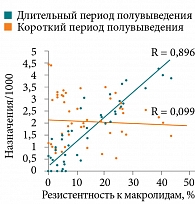
Согласно данным приведенного исследования, макролиды, прежде всего азитромицин, обладающие длительным периодом полувыведения, с большей долей вероятности могут вызывать селекцию резистентных штаммов St. pneumoniae (рис. 3)8.
Сегодня уже можно говорить об экологической небезопасности азитромицина. Его чрезмерное применение при инфекциях верхних дыхательных путей приводит к росту устойчивости St. pneumoniae и St. pyogenes не только к другим макролидам, но и (что особенно неприятно) к пенициллинам. Более того, азитромицин способствует формированию устойчивости Helicobacter pylori к кларитромицину, устойчивости микоплазм ко всем макролидным препаратам. Согласно данным канадского исследования O.G. Vanderkooi и соавт.25, опубликованным в 2005 г., кларитромицин и азитромицин увеличивают частоту носительства макролид-резистентных пневмококков. Однако азитромицин еще и провоцирует устойчивость пневмококка к пенициллинам и цефалоспоринам, что является крайне неблагоприятным экологическим эффектом (рис. 4).
Следует помнить, что высокий уровень устойчивости в регионе пневмококка к макролидам потенциально обратим. Это может быть достигнуто в результате существенного ограничения назначения макролидных антибиотиков при респираторных инфекциях, желательно с контролированием регуляторных органов. Такой результат, например, был достигнут в Финляндии в 1990-е гг.17
Поскольку антибиотикорезистентность возбудителей при инфекциях является мультидисциплинарной проблемой, профессор С.В. Яковлев акцентировал внимание участников симпозиума на вышедших в свет Евразийских клинических рекомендациях по стратегии и тактике применения антибиотиков в амбулаторной практике. Они отличаются от других рекомендаций тем, что носят междисциплинарный характер и базируются не только на положениях доказательной медицины, но и на принципах экологической безопасности антибактериальных препаратов.
Профессор С.В. Яковлев отметил, что макролиды необходимы как класс антибиотиков. Завершая выступление, докладчик ответил на самый главный вопрос: как сохранить эффективные макролиды в арсенале врача? Прежде всего уменьшить объем потребления макролидов путем информирования провизоров об их потенциальной опасности и необходимости контроля за отпуском из аптечной сети. Важно соблюдать клинические рекомендации по лечению респираторных инфекций и назначать макролиды исключительно в качестве третьей линии терапии, при аллергии на бета-лактамы.
Необходимо исключить азитромицин из клинических рекомендаций по лечению инфекций верхних и нижних дыхательных путей и позиционировать этот антибиотик только для лечения урогенитального хламидиоза.
При респираторных инфекциях из макролидных антибиотиков целесообразно назначать 16-членный препарат джозамицин, к которому наблюдается меньшая устойчивость пневмококков и пиогенного стрептококка по сравнению с азитромицином и кларитромицином.
Профессор С.В. Яковлев призвал представлять адекватную информацию о макролидах, а именно актуальные данные об уровне резистентности St. pneumoniae к макролидам в РФ, объяснять вред длительного профилактического применения азитромицина и развенчивать мифы о значении микробных биопленок при респираторных инфекциях. Докладчик выразил уверенность в том, что резистентность к макролидам обратима и применение перечисленных мер позволит сохранить данный класс антибиотиков для применения в клинической практике.
Заключение экспертов
Подводя итог, ведущие отечественные эксперты в области антибиотикотерапии в оториноларингологии, заместитель директора Федерального научно-клинического центра оториноларингологии ФМБА России, д.м.н., профессор Ольга Витальевна КАРНЕЕВА, заместитель директора по научной и координационной работе Санкт-Петербургского научно-исследовательского института уха, горла, носа и речи, д.м.н., профессор Сергей Валентинович РЯЗАНЦЕВ и профессор кафедры оториноларингологии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, ученый секретарь Федерального научно-клинического центра оториноларингологии ФМБА России, д.м.н. Татьяна Ильинична ГАРАЩЕНКО отметили актуальность затронутой проблемы не только для оториноларингологов, но и для педиатров, терапевтов, врачей общей практики.
Эксперты обозначили роль макролидных антибиотиков в лечении наиболее распространенных ЛОР-инфекций.
С учетом роста резистентности пневмококка к макролидам последние рассматриваются как препараты третьей линии терапии при риносинуситах и острых средних отитах, стрептококковом тонзиллофарингите, непереносимости бета-лактамов. Кроме того, макролиды применяются при высоком риске инфекции атипичной этиологии и внутриклеточной локализации возбудителя.
