Активность кишечных карбогидраз у больных целиакией в зависимости от приверженности аглютеновой диете
- Аннотация
- Статья
- Ссылки
- English
Цель работы: оценка активности кишечных карбогидраз у больных целиакией в зависимости от приверженности аглютеновой диете (АГД).
Материал и методы. Проведено обследование 109 больных целиакией, критерием диагностики которых являлась совокупность клинических симптомов, серологических тестов и гистологических данных. Медиана возраста обследованных больных составила 41,5 года (Q1–Q3: 30–55 лет, Shapiro p-value < 0,01). Мужчин было 16 (14,7%), медиана возраста 30 лет; женщин – 93 (85,3%), медиана возраста 44 года.
В зависимости от приверженности АГД пациенты с целиакией были разделены на три группы: первая группа – 39 больных с впервые выявленной целиакией, вторая группа – 28 больных, осознанно или неосознанно нарушавших АГД, третья группа – 42 пациента, соблюдавших АГД от 6 месяцев до 15 лет. Контрольную группу составили 30 практически здоровых человек, сопоставимых по возрасту и полу. Средний возраст их составил 33,9 года (Q1–Q3: 24–35). Всем больным выполняли эзофагогастродуоденоскопию с морфологическим и биохимическим исследованием СОТК с исследованием активности кишечных карбогидраз по методу А. Далквиста в модификации Н.И. Белостоцкого. Активность дисахаридаз СОТК тонкой кишки выражали в нанограммах глюкозы на миллиграмм ткани в минуту (нг глюкозы/мг ткани × мин).
Результаты. У больных с впервые выявленной целиакией достоверно чаще выявляется снижение активности глюкоамилазы (84,6%), мальтазы (87,2%) и сахаразы (82,05%) (p < 0,01) по сравнению с третьей группой (глюкоамилаза – 33,3%; мальтаза – 45,2%; сахараза – 45,2%). Дефицит всех карбогидраз (глюкоамилазы, мальтазы, сахаразы и лактазы) выявлен у 61,5% больных. При сравнении показателей активности карбогидраз в группах обследованных нами больных оказалось, что средний уровень активности глюкоамилазы, сахаразы и мальтазы достоверно чаще возрастал по мере соблюдения АГД, однако их средние показатели оставались ниже контрольного уровня, что в меньшей степени касалось мальтазы. Так, в третьей группе уровень мальтазы был 860 (644,5; 1413,5), а в группе контроля – 887,0 (854,5; 1146), что указывает на высокую способность мальтазы к восстановлению при строгом следовании АГД. Уровень активности лактазы в исследуемых группах пациентов с различной приверженностью АГД достоверно не отличался и был существенно ниже такового в контрольной группе, что свидетельствует о наличии у больных лактазной недостаточности, трудно корректируемой АГД.
Заключение. На основании результатов работы можно сделать вывод, что больным целиакией, соблюдающим строгую АГД, для оценки степени восстановления функциональных возможностей СОТК показано исследование активности карбогидраз тонкой кишки.
Цель работы: оценка активности кишечных карбогидраз у больных целиакией в зависимости от приверженности аглютеновой диете (АГД).
Материал и методы. Проведено обследование 109 больных целиакией, критерием диагностики которых являлась совокупность клинических симптомов, серологических тестов и гистологических данных. Медиана возраста обследованных больных составила 41,5 года (Q1–Q3: 30–55 лет, Shapiro p-value < 0,01). Мужчин было 16 (14,7%), медиана возраста 30 лет; женщин – 93 (85,3%), медиана возраста 44 года.
В зависимости от приверженности АГД пациенты с целиакией были разделены на три группы: первая группа – 39 больных с впервые выявленной целиакией, вторая группа – 28 больных, осознанно или неосознанно нарушавших АГД, третья группа – 42 пациента, соблюдавших АГД от 6 месяцев до 15 лет. Контрольную группу составили 30 практически здоровых человек, сопоставимых по возрасту и полу. Средний возраст их составил 33,9 года (Q1–Q3: 24–35). Всем больным выполняли эзофагогастродуоденоскопию с морфологическим и биохимическим исследованием СОТК с исследованием активности кишечных карбогидраз по методу А. Далквиста в модификации Н.И. Белостоцкого. Активность дисахаридаз СОТК тонкой кишки выражали в нанограммах глюкозы на миллиграмм ткани в минуту (нг глюкозы/мг ткани × мин).
Результаты. У больных с впервые выявленной целиакией достоверно чаще выявляется снижение активности глюкоамилазы (84,6%), мальтазы (87,2%) и сахаразы (82,05%) (p < 0,01) по сравнению с третьей группой (глюкоамилаза – 33,3%; мальтаза – 45,2%; сахараза – 45,2%). Дефицит всех карбогидраз (глюкоамилазы, мальтазы, сахаразы и лактазы) выявлен у 61,5% больных. При сравнении показателей активности карбогидраз в группах обследованных нами больных оказалось, что средний уровень активности глюкоамилазы, сахаразы и мальтазы достоверно чаще возрастал по мере соблюдения АГД, однако их средние показатели оставались ниже контрольного уровня, что в меньшей степени касалось мальтазы. Так, в третьей группе уровень мальтазы был 860 (644,5; 1413,5), а в группе контроля – 887,0 (854,5; 1146), что указывает на высокую способность мальтазы к восстановлению при строгом следовании АГД. Уровень активности лактазы в исследуемых группах пациентов с различной приверженностью АГД достоверно не отличался и был существенно ниже такового в контрольной группе, что свидетельствует о наличии у больных лактазной недостаточности, трудно корректируемой АГД.
Заключение. На основании результатов работы можно сделать вывод, что больным целиакией, соблюдающим строгую АГД, для оценки степени восстановления функциональных возможностей СОТК показано исследование активности карбогидраз тонкой кишки.

Введение
Целиакия относится к классическим аутоиммунным заболеваниям, инициирующим повреждение энтероцитов и атрофию ворсинок слизистой оболочки тонкой кишки (СОТК) у генетически детерминированных людей в ответ на употребление продуктов, содержащих глютен. Возникающие при этом повреждения ультраструктуры мембран эпителиоцитов вызывают поломку пищеварительно-транспортного конвейера, обеспечивающего высокую эффективность ассимиляции пищевых веществ в тонкой кишке. Ведущую роль в этом процессе играет заключительный этап переваривания короткоцепочечных нутриентов, который реализуется на мембране щеточной каймы энтероцитов. Многофункциональные пептидазные и дисахаридазные комплексы находятся на апикальной мембране эпителиальных клеток и прикрепляются к ней наподобие якорей белками-полипептидами. Поэтому при атрофии СОТК всегда нарушается важнейший этап пищеварительно-транспортного конвейера – мембранное пищеварение [1, 2].
Ранее проведенные исследования, в том числе и наши, показали, что у больных нелеченой целиакией наблюдается значительное снижение активности дисахаридаз [2, 4].
Примерно через четыре недели после начала соблюдения аглютеновой диеты (АГД) происходит заметное увеличение активности дисахаридаз, но она снова снижается, если больные целиакией возвращаются к глютенсодержащей диете [5, 6]. Подтверждением данного факта являются исследования, при которых интрадуоденальная инстилляция глютена в течение 3,5 часов у пациентов с целиакией вызывает характерные гистологические изменения и связанное с ними выраженное снижение активности дисахаридаз [7]. Имеются данные о корреляции между активностью кишечных карбогидраз и степенью атрофии ворсинок СОТК [8]. На этом основании можно предполагать, что активность дисахаридаз может служить показателем функционального восстановления СОТК при целиакии.
Цель работы – оценка активности кишечных карбогидраз у больных целиакией в зависимости от приверженности АГД.
Материал и методы
Проведено обследование 109 больных целиакией, находившихся на стационарном лечении в отделении невоспалительной патологии кишечника ГБУЗ МКНЦ им. А.С. Логинова ДЗМ. Диагноз целиакии базировался на совокупности клинических симптомов, серологических тестов и гистологических данных. Медиана возраста обследованных больных составила 41,5 года (Q1–Q3: 30–55 лет, Shapiro p-value < 0,01). Мужчин было 16 (14,7%), медиана возраста 30 лет; женщин – 93 (85,3%), медиана возраста 44 года.
В зависимости от приверженности АГД пациенты были разделены на три группы.
Первую группу (39 человек) составили больные с впервые выявленной целиакией. Болезнь проявлялась у них характерными клиническими и лабораторными симптомами и выраженной атрофией ворсинок СОТК, свойственной нелеченой целиакии.
Вторая группа включала 28 больных целиакией, которые осознанно или неосознанно, то есть не зная состава продуктов, нарушали АГД или придерживались ее менее 6 месяцев. У больных сохранялись клинико-лабораторные проявления болезни, повышенные титры к антителам и глиадину, тканевой трансглютаминазе (АТтТГ) и разной степени выраженности патогистологические изменения СОТК.
В третью группу вошли 42 пациента, соблюдавшие АГД от 6 месяцев до 15 лет. При динамическом наблюдении уровень АТтТГ, IgA и IgG у них сохранялся в пределах референсных значений и отсутствовала атрофия ворсинок СОТК по данным гистологических исследований.
Контрольную группу составили 30 практически здоровых человек, сопоставимых по возрасту и полу. Средний возраст их составил 33,9 года (Q1–Q3: 24–35).
При анализе анамнеза особое внимание уделялось требованиям приверженности АГД и длительности ее соблюдения.
Всем больным выполняли эзофагогастродуоденоскопию с морфологическим и биохимическим исследованием СОТК с целью верификации диагноза и исследование активности кишечных карбогидраз по методу А. Далквиста в модификации Н.И. Белостоцкого [9]. Активность дисахаридаз СОТК выражали в нанограммах глюкозы на миллиграмм ткани в минуту (нг глюкозы/мг ткани × мин).
Статистический анализ проводили в программе Statistica 13.3 (StatSoft Inc., США). Систематизация исходной информации осуществлялась в электронных таблицах Microsoft Office Excel 2016. При статистической обработке пользовались методами параметрического и непараметрического анализа. Совокупности количественных показателей, отличающихся от нормального распределения, описывали при помощи значений медианы (Me) и межквартильного интервала (25-й, 75-й перцентили), качественные признаки обозначали в виде абсолютного значения и процента. Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовали U-критерий Манна – Уитни. При сравнении нескольких выборок количественных данных, имеющих распределение, отличное от нормального, использовали критерий Краскела – Уоллиса. Сравнение номинальных данных проводили при помощи критерия χ2 Пирсона. Различия между группами считали статистически значимыми при вероятности справедливости нулевой гипотезы об отсутствии различий между группами р < 0,05.
Результаты и обсуждение
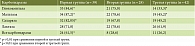
При изучении активности кишечных ферментов (глюкоамилазы, мальтазы, сахаразы и лактазы) в СОТК в трех группах больных установлено, что в первой и второй группах преобладали пациенты со сниженными показателями кишечных карбогидраз. Частота сниженных показателей при этом составляла от 67,8 до 87,2%. В третьей группе также наблюдалось большое количество пациентов с низкой активностью кишечных ферментов, однако частота обнаружения данного дефицита не превышала 45,2% для всех исследуемых ферментов, за исключением лактазы. Сравнительный анализ частоты обнаружения сниженных показателей активности карбогидраз у пациентов трех групп представлен в табл. 1.
Как видно из представленных данных, в первой группе обнаружена самая большая доля пациентов со сниженным уровнем карбогидраз, варьирующая от 71,8 до 87,2%. Во второй группе также установлено значительное количество больных с низким уровнем активности карбогидраз – от 67,8 до 78,6%. При сопоставлении частоты выявления недостаточности глюкоамилазы, мальтазы и сахаразы между группами обнаружено, что достоверных различий между первой и второй группами не получено. Это может свидетельствовать о том, что у большинства больных, нарушающих АГД, поддерживаются иммуновоспалительные процессы в СОТК, схожие с таковыми при впервые выявленном заболевании и препятствующие ее функциональному восстановлению.
При сравнении первой и третьей групп обнаружено, что в первой группе достоверно чаще выявляется снижение глюкоамилазы (84,6%), мальтазы (87,2%) и сахаразы (82,05%) (p < 0,01) по сравнению с третьей группой соответственно: глюкоамилаза – 33,3%; мальтаза – 45,2%; сахараза – 45,2%. Больные с дефицитом кишечных ферментов также преобладали в первой группе в сравнении с третьей (p < 0,01). Полученные данные подтверждают нашу гипотезу о том, что при исключении глютена происходит не только поэтапная нормализация структуры СОТК, но и постепенное восстановление ее функциональных возможностей [9]. В то же время даже небольшое количество глютена может приводить к изменению структуры СОТК и, следовательно, к снижению активности карбогидраз. Об этом свидетельствует значительное число больных во второй группе со сниженными показателями глюкоамилазы (75,0%) и мальтазы (78,6%) – их доля была достоверно больше, чем в третьей группе (33,3 и 45,2% соответственно).
При анализе полученных результатов также обращало на себя внимание отсутствие статистически значимой разницы в частоте выявления cниженных показателей лактазы у больных всех трех групп.
Нами были также проанализированы количественные показатели активности кишечных ферментов в зависимости от приверженности пациентов АГД. Результаты представлены в табл. 2. Они указывают на значительную вариабельность значений в каждой группе, при этом средние показатели активности карбогидраз в каждой из трех групп были ниже, чем в контрольной.
Из представленных в табл. 2 данных также видно, что средние значения активности глюкоамилазы, мальтазы, сахаразы и лактазы достоверно ниже у больных с впервые выявленной целиакией (первая группа). Также низкие средние значения обнаружены и в группе больных, нестрого соблюдающих АГД (вторая группа). Причем при сравнении первой и второй групп статистически значимых различий не получено. Однако статистически значимые различия (p < 0,01) обнаружены при их сравнении с группой контроля. Полученные данные свидетельствуют о том, что у больных с впервые выявленной целиакией и у больных, частично нарушающих АГД, даже незначительное поступление глютена препятствует восстановлению активности дисахаридаз и, как следствие, функциональным возможностям энтероцита.
Обращает на себя внимание, что уровень лактазы существенно не отличался в трех группах и был достоверно ниже нормальных значений контрольной группы. Этот факт свидетельствует о возможности развития у больных целиакией гиполактазии, резистентной к лечению АГД. Подобные явления наблюдали Н.И. Полева и соавт. при еюноперфузии растворов лактозы: у больных целиакией скорость ее гидролиза была достоверно ниже, чем у здоровых людей [11]. Полученные нами данные также совпадают с результатами A.S. Peña и соавт., которые продемонстрировали, что активность лактазы у больных целиакией, соблюдающих АГД, длительное время остается сниженной [12]. Сохранение низкой активности лактазы, несмотря на улучшение гистологической картины СОТК у взрослых пациентов с целиакией, отмечали и другие авторы [13, 14].
При сравнении показателей активности карбогидраз в группах обследованных нами больных оказалось, что средний уровень глюкоамилазы, сахаразы и мальтазы достоверно чаще возрастал по мере соблюдения АГД, однако их средние показатели оставались ниже контрольного уровня, что в меньшей степени касалось мальтазы. Так, в третьей группе уровень мальтазы был 860 (644,5; 1413,5), а в группе контроля – 887,0 (854,5; 1146), что указывает на высокую способность мальтазы к восстановлению.
Наши данные о высокой активности мальтазы согласуются с описанием ее характеристики. Данный фермент синтезируется из двух комплексов – мальтазно-глюкоамилазного и сахаразно-изомальтазного. Они синтезируются и локализуются на мембране микроворсинок. В шероховатом эндоплазматическом ретикулуме апикальной поверхности мембраны энтероцитов мальтазно-глюкоамилазный комплекс расщепляется до мальтазы и глюкоамилазы, а сахаразно-изомальтазный – до сахаразы и мальтазы [15]. Кроме того, имеются данные, что мальтазно-глюкоамилазный и сахаразно-изомальтазный комплексы синтезируются за счет двух разных генов, что отражает высокую биохимическую необходимость для организма функционирования данных ферментов, обеспечивающих энергетические потребности. Это подтверждается тем, что до сих пор нет ни одного описания генетически обусловленной недостаточности мальтазы [16].
Таким образом, поскольку активность мальтазы в группе больных, соблюдающих АГД, приближается к данным контрольной группы, можно утверждать, что восстановление активности мальтазы происходит наиболее быстро. Этот вывод дает основание использовать данный показатель в качестве маркера восстановления СОТК у больных, соблюдающих АГД.
Обращает также на себя внимание отсутствие клинических симптомов у больных с низкой активностью кишечной глюкоамилазы, что, на наш взгляд, можно объяснить частичной компенсацией ее недостаточной активности панкреатической амилазой, находящейся в тонкой кишке.
Из таблицы 2 видно, что у больных второй группы показатели активности карбогидраз достоверно не отличаются от показателей больных первой группы. Это обусловлено развитием гиперрегенераторной атрофии СОТК, вызванной употреблением глютена у больных целиакией. При этом отсутствует зависимость от дозы потребляемого глютена, что связано с иммуноопосредованным повреждением СОТК по типу аутоиммунной реакции замедленного типа с вовлечением клеточного звена иммунитета и иммунных комплексов [17, 18]. В ряде исследований отмечен патогенетический эффект введения малых доз глютена [19]. Таким образом, вторая группа сходна с первой группой по показателям функциональной активности СОТК на примере выявления карбогидразной недостаточности, что обусловлено токсическим воздействием глютена на СОТК.
Учитывая результаты исследования, измерение активности карбогидраз можно считать дополнительным потенциальным инструментом для мониторирования течения целиакии на фоне АГД, так как ее повышение хорошо коррелирует с восстановлением слизистой оболочки по данным биопсии тонкого кишечника [13].
Заключение
У больных с впервые выявленной целиакией достоверно чаще выявляется снижение активности глюкоамилазы (84,6%), мальтазы (87,2%) и сахаразы (82,05%) (p < 0,01) по сравнению с третьей группой (глюкоамилаза – 33,3%; мальтаза – 45,2%; сахараза – 45,2%). Дефицит всех карбогидраз (глюкоамилазы, мальтазы, сахаразы и лактазы) выявлен у 61,5% больных.
В группе больных, строго соблюдающих АГД, дефицит всех карбогидраз выявлен у 26,2%, однако средние показатели их активности были ниже контрольных значений, за исключением мальтазы. Согласно полученным данным, активность мальтазы сопоставима с аналогичными показателями в группе контроля, что показывает ее более быстрое восстановление при строгом следовании АГД.
Уровень активности лактазы в исследуемых группах пациентов с различной приверженностью АГД достоверно не отличался и был существенно ниже такового в контрольной группе, что свидетельствует о наличии у больных лактазной недостаточности, трудно корректируемой АГД.
На основании результатов работы можно сделать вывод, что больным целиакией, соблюдающим строгую АГД, для оценки степени восстановления функциональных возможностей СОТК показано исследование активности карбогидраз тонкой кишки.
Авторы заявляют об отсутствии конфликта интересов.
S.V. Bykova, PhD, E.A. Sabelnikova, PhD, O.V. Akhmadullina, PhD, A.A. Novikov, PhD, N.I. Belostotsky, PhD, E.V. Baulo, S.R. Dbar, A.I. Parfenov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Svetlana V. Bykova, s.bykova@mknc.ru
Celiac disease is a classic autoimmune disease that triggers enterocyte damage and villous atrophy of the small intestine mucosa in genetically determined individuals in response to gluten-containing foods. Damage to the ultrastructure of epithelial cell membranes causes breakdown of the digestive transport conveyor, which disrupts the most important stage of the digestive transport conveyor – membrane digestion, which plays an important role in the final assimilation of nutrients. There is evidence of a correlation between the activity of intestinal carbohydrases and the degree of atrophy of the mucosa villi, which suggests that the activity of disaccharidases can serve as an indicator of the functional recovery of TTS in celiac disease.
Objective: to assess the activity of intestinal carbohydrases in patients with celiac disease, depending on adherence to GFD.
Materials and methods. We examined 109 patients with celiac disease, the diagnostic criterion for which was a combination of clinical symptoms, serological tests and histological data. The median age of the examined patients was 41.5 years (Q1–Q3: 30–55 years, Shapiro p-value < 0.01). There were 16 men (14.7%), median age 30; women – 93 (85.3%), median age 44 years. Depending on adherence to GFD, patients with celiac disease were divided into 3 groups: Group I – 39 patients with newly diagnosed celiac disease, Group II – 28 patients who consciously or unconsciously violated GFD, Group III – 42 patients who observed GFD from 6 months up to 15 years. The control group consisted of 30 practically healthy people comparable in age and sex. Their average age was 33.9 years (Q1–Q3: 24–35). All patients underwent esophagogastroduodenoscopy with a morphological and biochemical study of the mucosal tissue with a study of the activity of intestinal carbohydrases according to the method of A. Dalkvist modified by N.I. Belostotsky. The activity of disaccharidases of the small intestine mucosa was expressed in nanograms of glucose per milligram of tissue per minute (ng glucose/mg tissue × min).
Results. In patients with newly diagnosed celiac disease, a decrease in the activity of glucoamylase glucoamylase (84.6%), maltase (87.2%) and sucrase (82.05%) (p < 0.01) is significantly more often detected compared to group III (glucoamylase – 33.3%; maltase – 45.2%; sucrase – 45.2%). Deficiency of all carbohydrases (glucoamylase, maltase, sucrase and lactase) was detected in 61.5% of patients.
When comparing the indicators of carbohydrase activity in the groups of patients examined by us, it turned out that the average level of activity of glucoamylase, sucrase and maltase increased significantly more often as AGD was observed, however, their average values remained below the control level, which was less related to maltase. Thus, in group III, the level of maltase was 860 (644.5; 1413.5), and in the control group – 887.0 (854.5; 1146), which indicates a high ability of maltase to recover with strict adherence to GFD. The level of lactose activity in the studied groups of patients with different adherence to GFD did not differ significantly and was significantly lower than that in the control group, which indicates the presence of lactase deficiency in patients, which is difficult
to correct by GFD.
Conclusion. Based on the results of the work, it can be concluded that patients with celiac disease observing strict AHD are shown to study the activity of small intestine carbohydrases to assess the degree of recovery of the functional capabilities of the mucosa.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.