Проблемы диагностики и лечения сочетания целиакии и микроскопического колита
- Аннотация
- Статья
- Ссылки
- English
В данной статье представлен клинический случай коморбидности целиакии и МК. Сочетанная патология целиакии и МК у больной П. сопровождалась запором, что встречается сравнительно редко. Соблюдение строгой аглютеновой диеты на протяжении более шести месяцев не привело к ремиссии заболевания. После диагностики МК была назначена терапия будесонидом в дозе 9 мг в сутки на срок восемь недель. Через восемь недель на фоне соблюдения аглютеновой диеты и приема будесонида состояние больной полностью нормализовалось.
Таким образом, при длительной (более 6–12 месяцев) персистенции симптомов целиакии на фоне применения аглютеновой диеты требуется исключение рефрактерных форм целиакии, а также сочетанной аутоиммунной патологии – МК.
В данной статье представлен клинический случай коморбидности целиакии и МК. Сочетанная патология целиакии и МК у больной П. сопровождалась запором, что встречается сравнительно редко. Соблюдение строгой аглютеновой диеты на протяжении более шести месяцев не привело к ремиссии заболевания. После диагностики МК была назначена терапия будесонидом в дозе 9 мг в сутки на срок восемь недель. Через восемь недель на фоне соблюдения аглютеновой диеты и приема будесонида состояние больной полностью нормализовалось.
Таким образом, при длительной (более 6–12 месяцев) персистенции симптомов целиакии на фоне применения аглютеновой диеты требуется исключение рефрактерных форм целиакии, а также сочетанной аутоиммунной патологии – МК.
Введение
Целиакия не ограничивается одним типом, характеризующимся диареей, но также имеет атипичные, латентные и рефрактерные формы. Распространенность классической формы целиакии составляет 1% населения земного шара, в то время как 3% населения страдают целиакией, включая атипичные и скрытые формы [1]. При этом отсутствие клинических симптомов или наличие нетипичных проявлений заболевания порой не позволяет поставить диагноз своевременно, в результате чего целиакия диагностируется в относительно позднем возрасте. Как многие заболевания с аутоиммунным патогенезом, целиакия примерно в 2–3 раза чаще встречается у женщин. Существует также ряд конкретных групп населения с повышенным риском развития целиакии [2]. Последние исследования свидетельствуют о том, что у пациентов с целиакией обнаруживается 70-кратный риск развития микроскопического колита (МК), который регистрируется у 4,3% пациентов с целиакией, по сравнению с населением в целом [3]. Согласно популяционным данным, приведенным в последних европейских клинических рекомендациях UEG/EMCG (2021 г.), обобщенная распространенность МК достигает 119,4 (95-ный доверительный интервал (ДИ) 72,9–165,9) случая на 100 тыс. человек [4]. При этом у 25% больных регистрируется коллагенозный (КК) и у 75% – лимфоцитарный колит (ЛК). В приведенных исследованиях КК встречался только у женщин. Данная группа пациентов была в среднем на 15 лет старше (p = 0,0001) и характеризовалась выраженной атрофией ворсинок слизистой тонкой кишки (p = 0,002). МК диагностировался после манифестации целиакии у 64% больных, одновременно с целиакией – у 25% и до целиакии – у 11% пациентов (p = 0,0001). У обследованной группы пациентов преобладал панколит (64%), у 16% был колит с поражением правой половины ободочной кишки, у 20% выявлялось левостороннее поражение. Стероидная или иммуносупрессивная терапия (циклоспорин, азатиоприн) требовалась 66% пациентов с целиакией в сочетании с МК и назначалась в качестве поддерживающей терапии 50% этих пациентов. Результаты последующих биопсий показали, что колит сохранялся у 57% пациентов с целиакией и МК, несмотря на разрешение симптомов диареи. При этом атрофия ворсин двенадцатиперстной кишки определялась у 20% лиц [5]. В другом исследовании сообщается, что целиакия встречается у 15% пациентов с ЛК. Для сравнения: в США распространенность целиакии составляет 4 на 1000 человек. Высокая распространенность целиакии у пациентов с МК требует исключения целиакии у пациентов с рефрактерной диареей [6, 7], а лечение коморбидной патологии (целиакия и МК) – назначения сочетанной терапии [8].
В представленном клиническом наблюдении обсуждается проблема диагностики, дифференциальной диагностики и лечения сочетанной патологии – целиакии и МК (в форме ЛК).
Клиническое наблюдение
Пациентка П., 34 года, поступила в гастроэнтерологическое отделение МКНЦ им. А.С. Логинова ДЗМ в мае 2021 г. с жалобами на периодические боли в мезогастрии без четкой связи с приемом пищи, шелушение и сухость кожных покровов, быструю утомляемость, тревожность, прогрессивное снижение веса, запоры до двух-трех дней.
Из анамнеза известно, что в 2014 г. спустя небольшое количество времени после вторых родов стала отмечать появление и прогрессирование общей слабости. Тогда в анализах крови выявлено снижение Нb до 76 г/л, сывороточного железа – до 1 мкмоль/л. Амбулаторно проведены ультразвуковое исследование (УЗИ) брюшной полости и эзофагогастродуоденоскопия (ЭГДС) без биопсии – патологии не выявлено. При консультации гематолога была диагностирована железодефицитная анемия неясной этиологии. Пациентка принимала препараты железа перорально с временным положительным эффектом.
В 2016 г. повторно обратилась за медицинской помощью в связи с прогрессивным снижением массы тела, общей слабостью. В анализах крови обращала на себя внимание железодефицитная анемия (уровень Нb – 92 г/л) и дефицит витамина D – 22 ммоль/л (норма 30–50 ммоль/л), дефицит фолиевой кислоты – 2,7 нг/мл (норма 3,0–20,5 нг/мл), в связи с чем вновь были назначены препараты железа и препараты витамина D; терапия – без эффекта.
В сентябре 2017 г. впервые выполнено определение антител к эндомизию, которые обнаружены в титре 1:320 (норма < 1:2,5). Морфологической верификации диагноза целиакии, а также убедительной беседы о необходимости соблюдения аглютеновой диеты не проводилось. Так же как и годом ранее, осуществляли коррекцию железодефицитной анемии, дефицита фолиевой кислоты и витамина D.
В ноябре 2020 г. пациентка вновь обратилась к врачу с теми же жалобами. Объективно: состояние без существенной динамики, сохраняются общая слабость, лабораторные признаки железодефицитной анемии. Антитела к глиадину (IgA) – 11,21 Ед/мл (норма 0–10,0 Ед/л), антитела к глиадину (IgG) – 72,93 Ед/л (норма 0–10,0 Ед/л), антитела к тканевой трансглутаминазе (IgA) – 97,57 Ед/л (норма 0–10,0 Ед/л), антитела к тканевой трансглутаминазе (IgG) – 12,54 Ед/л (норма 0–10,0 Ед/л).
В анализах крови: Нb – 80 г/л, сывороточное железо – 1,4 мкмоль/л, витамин В12 – 378 ммоль/л.
По результатам ЭГДС диагностирован смешанный гастродуоденит. При гистологическом исследовании биопсийного материала нисходящего отдела двенадцатиперстной кишки (два фрагмента) выявлена гиперплазированная слизистая двенадцатиперстной кишки с хроническим умеренно выраженным воспалением.
В связи с повышением уровня антител к глиадину, тканевой трансглутаминазе с пациенткой проведена беседа о необходимости соблюдения строгой аглютеновой диеты.
В феврале 2021 г. проведено плановое лечение в терапевтическом стационаре г. Улан-Удэ. В анализах крови обнаружена низкая концентрация ферритина – 17,4 мкг/л и Нb – 110 г/л (на фоне лечения препаратами железа).
В мае 2021 г. в связи с усилением болей в животе и прогрессированием общей слабости госпитализирована в МКНЦ им. А.С. Логинова ДЗМ для дообследования и коррекции терапии.
Из анамнеза известно, что пациентка страдает аутоиммунным тиреоидитом с узлообразованием в состоянии эутиреоза. Аллергоанамнез не отягощен. У тети по матери – непереносимость глютена. Индекс массы тела – 16,3 кг/м2. По органам и системам – без особенностей.
При последней госпитализации в мае 2021 г. в анализах крови: железо – 3,9 мкмоль/л, ферритин – 8,2 мкг/л. Клинический анализ крови: Нb – 11,3 г/дл, эритроциты – 4,88 × 106/мкл, гематокрит – 35%, в остальном – в пределах референсных значений.
Антитела к тканевой трансглутаминазе (IgA) – 179,2 Ед/л (норма 0–10,0 Ед/л), антитела к тканевой трансглутаминазе (IgG) – 68,3 Ед/л (норма 0–10,0 Ед/л), антитела к деамидированным пептидам глиадина (IgA) – 15,1 Ед/л (норма 0–10,0 Ед/л), антитела к деамидированным пептидам глиадина (IgG) – 19,6 Ед/л (норма 0–10,0 Ед/л). Результат анализа кала на скрытую кровь отрицательный. При УЗИ органов брюшной полости патологии не выявлено. ЭГДС: эндоскопическая картина поверхностного антрального гастрита без признаков активного воспаления. Эрозивный рефлюкс-эзофагит, степень А (по LA-классификации). Выполнена биопсия дистальной части двенадцатиперстной кишки для теста на лактазную недостаточность, а также биопсия луковицы, средней и дистальной части двенадцатиперстной кишки для диагностики целиакии, исключения амилоидоза и болезни Уиппла (пять фрагментов). При гистологическом исследовании материала слизистой оболочки двенадцатиперстной кишки обнаружены скопление межэпителиальных лимфоцитов более 40 на 100 эпителиоцитов, умеренная инфильтрация
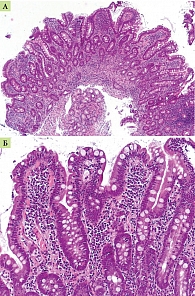
стромы ворсин лимфоцитами и плазмоцитами с примесью эозинофилов; глубина крипт увеличена; соотношение ворсина/крипта не превышает 1/1. Заключение: гистологическая картина хронического субатрофического дуоденита с увеличением числа межэпителиальных лимфоцитов, характерная для глютеновой энтеропатии, на фоне безглютеновой диеты (рис. 1 А, Б). Экспресс-тест на лактазную недостаточность показал наличие гиполактазии тяжелой степени.
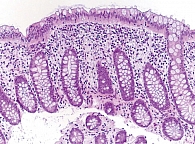
При колоноскопии обнаружены множественные очаги лимфоидной гиперплазии слизистой дистальной части подвздошной кишки, слепой, восходящей и поперечной ободочной кишки. Выполнена биопсия слизистой оболочки правых отделов толстой кишки для исследования путем полимеразно-цепной реакции (ПЦР) титров цитомегаловируса, вируса Эпштейна – Барр, туберкулеза. Выполнена лестничная биопсия № 1–7 по два фрагмента из всех отделов толстой кишки для гистологического исследования. При биопсии ткань эластичная. При гистологическом исследовании слизистой оболочки толстой кишки обнаружены дистрофия и участки десквамации клеток поверхностного эпителия. Между клетками эпителия встречаются лимфоциты в количестве 25–30 на 100 эпителиоцитов. Архитектоника кишечных крипт не нарушена. В эпителиальной выстилке крипт много бокаловидных клеток. Между клетками эпителия крипт часто встречаются лимфоциты. Заключение: МК в форме лимфоцитарного колита (рис. 2). Результаты ПЦР-исследования биоптатов слизистой оболочки толстой кишки на цитомегаловирус, вирус Эпштейна – Барр, туберкулез кишечника отрицательные. Анализ крови на кишечные инфекции (иерсинии, шигеллы, сальмонеллы) также показал отрицательные результаты.
По результатам компьютерной томографии (КТ) органов брюшной полости, КТ- энтерографии определено наличие лимфаденопатии брыжейки тонкой кишки. Долихосигма.
Таким образом, по результатам инструментальных, лабораторных и гистологических исследований установлен диагноз: «Основной. 1. Целиакия, латентная форма, впервые выявленная. 2. МК в форме лимфоцитарного колита, впервые выявленный. Осложнение: синдром нарушенного всасывания второй степени тяжести. Хроническая железодефицитная анемия легкой степени. Гиполактазия тяжелой степени.
Сопутствующее заболевание: эрозивный рефлюкс-эзофагит. Аутоиммунный тиреоидит с узлообразованием, эутиреоз».
Пациентке назначено лечение: строгое и пожизненное соблюдение аглютеновой диеты, будесонид 9 мг в сутки в течение восьми недель с последующим снижением дозы на 3 мг в неделю до полной отмены препарата, препараты железа 100 мг внутримышечно, прием фермента лактозы по одной капсуле три раза в сутки при употреблении молочных продуктов, омепразол по 20 мг два раза в сутки четыре недели, далее по 20 мг в сутки четыре недели.
Через восемь недель после назначения лечения отмечены улучшение общего самочувствия, нормализация стула до одного-двух раз в сутки, без патологических примесей, повышение массы тела на 6 кг, при этом индекс массы тела составил 18,6 кг/м2.
Также отмечалась положительная динамика по лабораторным данным: повышение Hb с 83 до 122 г/л, уровня сывороточного железа – c 3,9 до 15 ммоль/л, ферритина – с 7,2 до 63 ммоль/л, витамина D – с 22 до 30 ммоль/л.
Обсуждение
Данный клинический случай демонстрирует, что диарея не является строго специфичным симптомом как для целиакии, так и для МК. МК может протекать бессимптомно, с запором или с клинической симптоматикой синдрома раздраженного кишечника [9]. Так, при лимфоцитарном колите запор регистрируется у 18% лиц, при коллагенозном – у 39% [10]. При целиакии не менее чем у 4–15% пациентов верифицируется запор. В исследованиях [10, 11] показано, что МК и целиакия могут сопровождаться резистентным к слабительным средствам запором. В другом клиническом исследовании показано, что обнаружение МК при рефрактерной к аглютеновой диете целиакии составляет 4,5%, а при рефрактерном к лечению МК частота встречаемости целиакии достигает 6,7%. Целиакия в популяции больных с рефрактерным МК встречается достоверно чаще, чем в человеческой популяции (отношение шансов 8,12; ДИ 4,92–13,41, р < 0,001) [12]. Коморбидная патология отличается трудностями в диагностике и лечении [13]. Так, атрофия ворсин тонкой кишки может наблюдаться у пациентов с аутоиммунной энтеропатией, коллагенозным спру, общим вариабельным иммунодефицитом при эозинофильном гастроэнтерите, лямблиозе, энтеропатии, ассоциированной с ВИЧ, лимфомой кишечника, неглютеновой чувствительностью к белкам пшеницы, радиационным энтеритом, туберкулезом, болезнью Уиппла, синдромом Золлингера – Эллисона [14]. Подозрение на целиакию требует обязательного взятия биопсийного материала из двенадцатиперстной кишки, даже если эндоскопическая картина остается нормальной. Для подтверждения диагноза необходимо брать несколько биоптатов. Оптимальным считается взятие четырех биоптатов из дистальной части двенадцатиперстной кишки и двух – из луковицы двенадцатиперстной кишки. При этом биопсию необходимо проводить даже при отрицательных серологических результатах на целиакию. Подтверждение диагноза целиакии основывается на клинических данных, положительных серологических и морфологических критериях.
При целиакии у пациентов с положительным эффектом от безглютеновой диеты достаточно часто назначают дополнительное лечение. Так, например, безглютеновая диета содержит мало клетчатки, что сопровождается запорами. Существуют данные, свидетельствующие о наборе массы тела, повышении гликемического индекса, развитии жировой болезни печени у пациентов, находящихся на безглютеновой диете. Помимо безглютеновой диеты, пациентам с целиакией в связи с риском запора следует рекомендовать диету с высоким содержанием клетчатки, дополненную цельнозерновым рисом, кукурузой, картофелем и большим количеством овощей [15], проводить коррекцию недостаточности витаминов и минералов. В большинстве случаев аглютеновая диета сопровождается наступлением ремиссии целиакии. Тем не менее при коморбидной патологии (целиакия и МК) достаточно часто диагностируются формы, медленно отвечающие на аглютеновую диету. При этом симптомы целиакии персистируют 6–12 месяцев даже при соблюдении строгой аглютеновой диеты. В целом таких пациентов насчитывается 7–30% [15, 16]. В отношении медленно отвечающих на безглютеновую диету пациентов с целиакией возможна выжидательная тактика до года. При персистенции симптомов целиакии более года требуется проведение диагностических тестов на наличие рефрактерной формы целиакии. Это является принципиально важным для выбора тактики лечения.
При МК, в отличие от целиакии, требуются другие методы диагностики и лечения. Для адекватной диагностики МК необходимо проведение колоноскопии и биопсии из разных отделов толстой кишки. Согласно клиническим рекомендациям UEG-EMCG от 2021 г., комбинация результатов биопсии восходящей и нисходящей ободочной кишки позволяет поставить диагноз МК в 100% случаев [17]. Важный и основной гистологический критерий КК – утолщение субэпителиальной коллагеновой выстилки (более 10 мкм) в сочетании с увеличением воспалительного инфильтрата в собственной пластинке слизистой оболочки, а для ЛК – повышенное количество интраэпителиальных лимфоцитов (> 20 интраэпителиальных лимфоцитов на 100 эпителиоцитов).
B. Virine и соавт. в ретроспективном исследовании проанализировали чувствительность биопсии из разных отделов толстой кишки – для установления диагноза МК необходимо взятие так называемой ступенчатой (лестничной) биопсии по два фрагмента из каждого отдела толстой кишки [17].
Без назначения топических стероидов терапия МК не будет эффективной, поэтому своевременная диагностика МК у пациентов с целиакией является принципиально важной. Кроме того, назначение будесонида может быть эффективным средством лечения пациентов с целиакией, медленно реагирующих на безглютеновую диету. Согласно некоторым клиническим исследованиям, у пациентов с рефрактерной формой целиакии будесонид назначается на три месяца с последующим переходом на поддерживающую терапию азатиоприном в течение двух-трех лет [15].
Заключение
Вероятность возникновения МК у пациента с целиакией увеличивается в десятки раз, что нередко ассоциируется с трудно поддающейся лечению целиакией, несмотря на соблюдение строгой аглютеновой диеты. Основная цель терапии МК – индукция клинической ремиссии и улучшение качества жизни пациента. Согласно клиническим рекомендациям UEG-EMCG от 2021 г., топический глюкокортикостероид будесонид является препаратом первой линии терапии МК и единственным средством, способствующим индукции и поддержанию ремиссии заболевания. При ЛК на фоне рецидива возможно назначение поддерживающей терапии будесонидом на срок не менее шести месяцев, хотя данное положение отличается очень низким уровнем доказательности за счет редкости возможных рецидивов заболевания. В отношении КК применение будесонида в качестве поддерживающей терапии имеет средний уровень доказательности. Так, шестимесячная терапия будесонидом позволяет поддерживать ремиссию у 75% пациентов с КК по сравнению с 25% больных, получающих плацебо [17].
Таким образом, длительная персистенция симптомов целиакии (более 6–12 месяцев) на фоне соблюдения аглютеновой диеты требует исключения рефрактерных форм целиакии, а также сочетанной аутоиммунной патологии – МК.
N.A. Fadeeva, PhD, A.M. Osadchuk, PhD, Prof., E.O. Kukoleva, G.B. Artykova, S.G. Khomeriki, PhD, Prof., I.D. Loranskaya, PhD, Prof., A.I. Parfenov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Research Institute of Health Organization and Medical Management
Russian Medical Academy of Continuous Professional Education
Contact person: Nina A. Fadeeva, n.fadeeva@mknc.ru
1% of the world's population suffers from a typical form of celiac disease (CD). Difficult in diagnostic and, especially, therapeutic terms, are atypical, refractory to gluten-free forms of CD, as well as cases of comorbid pathology: CD and microscopic colitis (MC). The likelihood of MC in a patient with CD increases tenfold, which is often associated with difficult-to-treat СD even with a strict gluten-free diet.
This article presents a clinical case of comorbidity between СВ and microscopic colitis (MC). The comorbid pathology of СD and MC was accompanied by constipation, which is relatively rare. Compliance with a strict gluten-free diet for more than 6 months did not lead to remission of the disease. After the diagnosis of LC, budesonide therapy was prescribed at a dose of 9 mg per day for a period of 8 weeks. After 8 weeks, while following a gluten-free diet and taking budesonide, the patient's condition completely returned to normal.
Thus, long-term persistence of СD symptoms (more than 6–12 months) against the background of the use of a gluten-free diet requires the exclusion of refractory forms of celiac disease, and also combined autoimmune pathology – microscopic colitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.