Особенности пищевых интолерантностей у больных с синдромом раздраженного кишечника
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследовано 126 больных СРК (83 женщины и 43 мужчины, медиана возраста – 32,0 года (Q1–Q3: 27–38 лет)). Диагноз СРК установлен на основании Римских критериев IV. Всем пациентам проведено анкетирование с целью выявления пищевых интолерантностей, по результатам которого пациенты разделены на три группы: первая – пациенты с изолированной непереносимостью продуктов с высоким содержанием FODMAP; вторая – пациенты с изолированной непереносимостью молока и молочных продуктов; третья – пациенты с сочетанной непереносимостью. Для определения активности кишечных карбогидраз: лактазы, сахаразы, мальтазы и глюкоамилазы – всем пациентам выполнена эзофагогастродуоденоскопия с забором биоптатов из двенадцатиперстной кишки. Активность карбогидраз определяли по методу Далквиста в модификации Н.И. Белостоцкого. Контрольную группу составили 30 условно здоровых человек (10 мужчин и 20 женщин, медиана возраста – 33,9 года (Q1–Q3: 24–35)), сопоставимых по возрасту и полу с больными СРК. Активность кишечных ферментов в данной группе была в пределах референсных значений. Статистическую обработку данных проводили с применением компьютерной программы Statistica 8.0.
Результаты. По результатам проведенного анкетирования обнаружено, что из 126 пациентов с СРК 52 (41,3%) больных считали, что у них имеется пищевая непереносимость тех или иных продуктов. Изолированную непереносимость продуктов с высоким содержанием FODMAP отмечали 13 (10,3%) пациентов, 16 (12,7%) пациентов считали, что у них имеется изолированная непереносимость молока и молочных продуктов, и 23 (18,3%) пациента указывали на сочетанную непереносимость.
У пациентов с СРК и изолированной непереносимостью продуктов с высоким содержанием FODMAP медиана активности глюкоамилазы составила 120,0 (68,5–209,2) нг/мг глюкозы на 1 мг ткани в минуту (нг/мг × мин), мальтазы – 630,5 (480,7–951,0) нг/мг × мин, сахаразы – 50,0 (32,8–68,8) нг/мг × мин, лактазы – 10,5 (5,5–40,5) нг/мг × мин. При сопоставлении активности карбогидраз с контрольной группой выявлено статистически значимое различие (p < 0,05) по каждому исследованному ферменту.
В группе пациентов с СРК и изолированной непереносимостью молока и молочных продуктов медиана активности всех исследованных кишечных ферментов также была ниже таковой в контрольной группе: активность глюкоамилазы составила 107,0 (64,0–174,0) нг/мг × мин, мальтазы – 622,0 (481,5–887,0) нг/мг × мин, сахаразы – 48,0(35,5–60,0) нг/мг × мин, лактазы – 8,0 (3,0–22,5) нг/мг × мин.
Среди пациентов с СРК и наличием сочетанной непереносимости продуктов (с высоким содержанием FODMAP и молочных продуктов) медиана активности всех ферментов достоверно отличалась от группы контроля (p < 0,05). Активность глюкоамилазы составила 107,5 (57,5–194,2) нг/мг × мин, мальтазы – 627,0 (480,7–911,7) нг/мг × мин, сахаразы – 47,5 (34,8–61,5) нг/мг × мин, лактазы – 9,0 (4,0–28,8) нг/мг × мин.
Заключение. Пищевую непереносимость отмечали у себя 52 (41,3%) пациента с СРК. Среди пациентов, отмечающих у себя наличие всех исследованных пищевых интолерантностей (изолированную или сочетанную непереносимость молока и молочных продуктов, а также продуктов с высоким содержанием FODMAP), установлено достоверное снижение активности кишечных ферментов (глюкоамилазы, лактазы, сахаразы и мальтазы) по сравнению с контролем (p < 0,05), что может указывать на наличие у них дисахаридазной недостаточности.
Материал и методы. Обследовано 126 больных СРК (83 женщины и 43 мужчины, медиана возраста – 32,0 года (Q1–Q3: 27–38 лет)). Диагноз СРК установлен на основании Римских критериев IV. Всем пациентам проведено анкетирование с целью выявления пищевых интолерантностей, по результатам которого пациенты разделены на три группы: первая – пациенты с изолированной непереносимостью продуктов с высоким содержанием FODMAP; вторая – пациенты с изолированной непереносимостью молока и молочных продуктов; третья – пациенты с сочетанной непереносимостью. Для определения активности кишечных карбогидраз: лактазы, сахаразы, мальтазы и глюкоамилазы – всем пациентам выполнена эзофагогастродуоденоскопия с забором биоптатов из двенадцатиперстной кишки. Активность карбогидраз определяли по методу Далквиста в модификации Н.И. Белостоцкого. Контрольную группу составили 30 условно здоровых человек (10 мужчин и 20 женщин, медиана возраста – 33,9 года (Q1–Q3: 24–35)), сопоставимых по возрасту и полу с больными СРК. Активность кишечных ферментов в данной группе была в пределах референсных значений. Статистическую обработку данных проводили с применением компьютерной программы Statistica 8.0.
Результаты. По результатам проведенного анкетирования обнаружено, что из 126 пациентов с СРК 52 (41,3%) больных считали, что у них имеется пищевая непереносимость тех или иных продуктов. Изолированную непереносимость продуктов с высоким содержанием FODMAP отмечали 13 (10,3%) пациентов, 16 (12,7%) пациентов считали, что у них имеется изолированная непереносимость молока и молочных продуктов, и 23 (18,3%) пациента указывали на сочетанную непереносимость.
У пациентов с СРК и изолированной непереносимостью продуктов с высоким содержанием FODMAP медиана активности глюкоамилазы составила 120,0 (68,5–209,2) нг/мг глюкозы на 1 мг ткани в минуту (нг/мг × мин), мальтазы – 630,5 (480,7–951,0) нг/мг × мин, сахаразы – 50,0 (32,8–68,8) нг/мг × мин, лактазы – 10,5 (5,5–40,5) нг/мг × мин. При сопоставлении активности карбогидраз с контрольной группой выявлено статистически значимое различие (p < 0,05) по каждому исследованному ферменту.
В группе пациентов с СРК и изолированной непереносимостью молока и молочных продуктов медиана активности всех исследованных кишечных ферментов также была ниже таковой в контрольной группе: активность глюкоамилазы составила 107,0 (64,0–174,0) нг/мг × мин, мальтазы – 622,0 (481,5–887,0) нг/мг × мин, сахаразы – 48,0(35,5–60,0) нг/мг × мин, лактазы – 8,0 (3,0–22,5) нг/мг × мин.
Среди пациентов с СРК и наличием сочетанной непереносимости продуктов (с высоким содержанием FODMAP и молочных продуктов) медиана активности всех ферментов достоверно отличалась от группы контроля (p < 0,05). Активность глюкоамилазы составила 107,5 (57,5–194,2) нг/мг × мин, мальтазы – 627,0 (480,7–911,7) нг/мг × мин, сахаразы – 47,5 (34,8–61,5) нг/мг × мин, лактазы – 9,0 (4,0–28,8) нг/мг × мин.
Заключение. Пищевую непереносимость отмечали у себя 52 (41,3%) пациента с СРК. Среди пациентов, отмечающих у себя наличие всех исследованных пищевых интолерантностей (изолированную или сочетанную непереносимость молока и молочных продуктов, а также продуктов с высоким содержанием FODMAP), установлено достоверное снижение активности кишечных ферментов (глюкоамилазы, лактазы, сахаразы и мальтазы) по сравнению с контролем (p < 0,05), что может указывать на наличие у них дисахаридазной недостаточности.









Введение
Синдром раздраженного кишечника (СРК) – это функциональное расстройство желудочно-кишечного тракта, характеризующееся повторяющимися симптомами, такими как боль в животе, изменение консистенции и частоты стула, вздутие и дискомфорт. При СРК механизмы возникновения клинической картины не полностью ясны, но значимую роль играют диетические привычки и чувствительность к определенным продуктам питания, которые могут усиливать имеющиеся симптомы.
Желудочно-кишечные симптомы, предположительно вызванные пищевой непереносимостью, часто встречаются среди населения в целом [1]. Среди пациентов с функциональными расстройствами желудочно-кишечного тракта доля таких больных может достигать 80% [2]. Наиболее изученным при СРК видом непереносимости является лактазная недостаточность, связанная с дефицитом фермента лактазы. При недостатке лактазы у больных могут возникать такие симптомы, как вздутие, метеоризм, диарея и боль после употребления молочных продуктов. Подобные симптомы у больных СРК могут наблюдаться и после употребления продуктов, содержащих ферментируемые олигосахариды, дисахариды, моносахариды и полиолы (Fermentable Oligo-Di-Monosaccharides and Polyols – FODMAP).
В клинической практике диагностические инструменты для выявления пищевых компонентов, вызывающих желудочно-кишечные симптомы, неспецифичны. Однако, как показали двойные слепые плацебо-контролируемые исследования [3, 4], существует значительная разница между самооценкой и объективно доказанной пищевой непереносимостью.
Цель исследования – оценка активности кишечных карбогидраз у пациентов с синдромом раздраженного кишечника, имеющих симптомы непереносимости пищевых продуктов.
Материал и методы
Проведено обследование 126 больных СРК в возрасте от 18 до 50 лет. Медиана возраста обследованных больных составила 32,0 года (Q1–Q3: 27–38 лет), из них мужчин было 43 (34,1%), медиана возраста – 29 лет (Q1–Q3: 25–35 лет) лет, женщин – 83 (65,9%), медиана возраста – 32 года (Q1–Q3: 28–39 лет).
Диагноз СРК устанавливали на основании Римских критериев IV [5].
Проводили опрос пациентов с СРК, направленный на выявление взаимосвязи симптомов с употреблением определенных пищевых продуктов (молока и молочных продуктов, а также продуктов, содержащих FODMAP). Жалобы пациентов при употреблении данных продуктов заносились в специально разработанную анкету (рисунок). В качестве анкеты использовали валидизированный опросник для выяснения пищевых непереносимостей, созданный группой корейских ученых, с поправкой на пищевые особенности россиян [6].
Из продуктов, содержащих FODMAP, отдельно оценивали наиболее часто употребляемые в пищу продукты с высоким содержанием FODMAP, непереносимость которых позволила определить их в отдельную группу с непереносимостью продуктов с высоким содержанием FODMAP. Также отдельно выделены молоко и молочные продукты, непереносимость которых определяли у больных, отнесенных ко второй группе. В третью группу пациентов входили больные, отмечающие у себя как непереносимость молочных продуктов, так и непереносимость продуктов с высоким содержанием FODMAP.
В таблице 1 конкретизированы продукты питания каждой из групп.
Всем больным была выполнена эзофагогастродуоденоскопия с биопсией из залуковичного отдела двенадцатиперстной кишки с целью определения активности кишечных карбогидраз: лактазы, сахаразы, мальтазы и глюкоамилазы по методу Далквиста в модификации Н.И. Белостоцкого [7].
Контрольную группу составили 30 практически здоровых человек (10 мужчин и 20 женщин, средний возраст – 33,9 года (Q1–Q3: 24–35 лет)), активность ферментов у пациентов контрольной группы находилась в пределах ранее определенных референсных значений (для глюкоамилазы – 158–1486 нг глюкозы на 1 мг ткани в минуту (нг/мг × мин), мальтазы – 844–4028 нг/мг × мин, сахаразы – 73–876 нг/мг × мин, для лактазы – 16–360 нг/мг × мин) [7].
Статистическую обработку данных проводили с применением компьютерной программы Statistica 8.0 (StatSoft Inc, США). Систематизация исходной информации осуществлялась в электронных таблицах Microsoft Office Excel 2016 (Microsoft, США). При статистической обработке пользовались методами параметрического и непараметрического анализа. Совокупности количественных показателей, отличающихся от нормального распределения, описывали при помощи значений медианы (Med) и межквартильного интервала (25-й; 75-й перцентили), качественные признаки обозначали в виде абсолютного значения и процента. Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовали U-критерий Манна – Уитни. При сравнении нескольких выборок количественных данных, имеющих распределение, отличное от нормального, использовали критерий Краскела – Уоллиса. Сравнение номинальных данных проводили при помощи критерия χ2 Пирсона. С целью изучения связи между явлениями, представленными количественными данными, использовали непараметрический метод – расчет коэффициента корреляции Кенделла. Различия между группами считали статистически значимыми при вероятности справедливости нулевой гипотезы об отсутствии различий между группами (р < 0,05).
Результаты
По результатам анкетирования среди общей группы больных СРК (n = 126) пищевая непереносимость определена у 52 (41,3%) пациентов (табл. 2).
Изолированную непереносимость молока отмечали у себя 16 (12,7%) пациентов с СРК, 13 (10,3%) пациентов – только непереносимость продуктов с высоким содержанием FODMAP. Сочетанную непереносимость (молока и продуктов с высоким содержанием FODMAP) отметили при опросе 23 (18,3%) пациента.
Большая часть (58,7%) пациентов с СРК не имели каких-либо пищевых интолерантностей.
Согласно полученным в ходе анкетирования данным пациенты разделены на три группы: первая – пациенты, отметившие у себя изолированную непереносимость продуктов с высоким содержанием FODMAP (13 больных: трое мужчин и 10 женщин, средний возраст –
33,0 года (Q1–Q3: 29–37 лет)); вторая группа – пациенты, которые считали, что у них имеется изолированная непереносимость молочных продуктов (16 больных: пятеро мужчин и 11 женщин, средний возраст – 32,0 года (Q1–Q3: 27–37 лет)); третья группа – пациенты, отметившие у себя сочетанную непереносимость молочных продуктов и продуктов с высоким содержанием FODMAP (23 больных: пятеро мужчин и 18 женщин, средний возраст – 33,0 года (Q1–Q3: 27–38 лет)).
При анализе клинических симптомов (табл. 3) у всех пациентов с пищевой непереносимостью в 100% случаев отмечалась боль в животе, вторым по частоте симптомом во всех группах было вздутие живота.
При сравнении клинических симптомов между группами статистически значимых различий по частоте встречаемости выявлено не было (р < 0,05).
Для уточнения возможной взаимосвязи между клиническими симптомами и пищевыми интолерантностями у пациентов с СРК определена активность кишечных карбогидраз.
В группе пациентов с СРК, отмечающих у себя признаки изолированной непереносимости продуктов с высоким содержанием FODMAP (первая группа), установлено статистически значимое снижение всех исследованных ферментов по сравнению с группой контроля (табл. 4).
С учетом выявленного снижения карбогидраз у пациентов первой группы проведен корреляционный анализ связи между уровнем активности ферментов и клиническими симптомами (табл. 5).
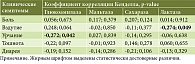
Установлено, что снижение активности глюкоамилазы может быть связано (p < 0,01) с появлением таких симптомов, как вздутие и урчание в животе, у пациентов с СРК и признаками изолированной непереносимости продуктов с высоким содержанием FODMAP.
При анализе активности кишечных карбогидраз у пациентов с СРК с непереносимостью молока и молочных продуктов (вторая группа) также обнаружено снижение медианы активности ферментов относительно группы контроля (табл. 6).
При выполнении корреляционного анализа по обнаружению связи между клиническими симптомами, возникающими в результате употребления молочных продуктов, и активностью кишечных карбогидраз у пациентов с СРК второй группы выявлена связь слабой силы между активностью глюкоамилазы и урчанием в животе (p < 0,05), а также уровнем лактазы и вздутием живота (p < 0,05), по другим симптомам связи выявлено не было (табл. 7).
При анализе активности кишечных карбогидраз у пациентов с СРК, зафиксировавших у себя признаки сочетанной непереносимости (молочных продуктов и продуктов с высоким содержанием FODMAP), аналогично предыдущим двум группам, выявлено достоверно значимое различие активности каждой из карбогидраз при сравнении с контрольной группой (табл. 8).
Корреляционный анализ связи между клиническими симптомами и активностью кишечных карбогидраз у пациентов с СРК третьей группы показал, что вздутие и урчание в животе могут быть связаны с пониженной активностью глюкоамилазы (табл. 9).
Связи боли в животе, тошноты и диареи с активностью карбогидраз во всех трех группах выявлено не было.
Обсуждение
Значительное количество пациентов с СРК связывают свои симптомы с употреблением в пищу определенных продуктов. Чаще всего ими являются молоко и молочные продукты, продукты с высоким содержанием FODMAP, глютенсодержащие продукты и сладости. Исключение данных продуктов из пищи оказывает позитивное влияние на клинические симптомы, но значительно ограничивает рацион больных [8]. Нами установлено, что 52 (41,3%) пациента с СРК отмечали у себя признаки пищевой непереносимости, при этом наиболее часто больные жаловались на сочетанную непереносимость молочных продуктов и продуктов с высоким содержанием FODMAP (18,3%). Диета с низким содержанием продуктов, в состав которой входят FODMAP, рекомендуется в качестве терапии первой линии у пациентов с СРК, поскольку имеются данные о ее положительном влиянии на клинические симптомы примерно у 70% больных [9]. Пациенты с СРК, соблюдающие диету с низким содержанием FODMAP в течение шести недель, отмечали уменьшение интенсивности боли в животе, вздутия, нормализацию стула и улучшение качества жизни [10, 11].
На сегодняшний день почти все исследования, изучающие связь между СРК и пищевыми продуктами, основаны на анкетировании пациентов [6]. По данным ранее проведенных работ, наиболее частыми симптомами, связываемыми больными с пищевой непереносимостью, являются газообразование, вздутие живота, диарея и боль в животе [12], что сопоставимо с полученными нами данными. Пищевая непереносимость, независимо от вида продукта, у 100% пациентов с СРК проявлялась болью в животе, вторым по частоте симптомом во всех трех группах было вздутие живота (84,6; 93,6 и 82,6% соответственно). Наиболее часто вздутие встречалось у пациентов с непереносимостью молока и молочной продукции (93,6%), в этой же группе чаще, чем в других, наблюдалась диарея (75,0%).
Как известно, продукты с высоким содержанием FODMAP и лактозы могут являться основными пищевыми триггерами обострения симптомов СРК [13], прежде всего вследствие способности данных продуктов увеличивать осмотическое давление и выработку газов в просвете толстой кишки при стимуляции бактериального брожения и усилении перистальтики кишечника в условиях дефицита кишечных ферментов.
Для выявления возможной взаимосвязи клинических симптомов и пищевых интолерантностей в нашей работе изучена активность основных кишечных карбогидраз (лактазы, сахаразы, глюкоамилазы и мальтазы) – ферментов, участвующих в переваривании FODMAP и молочных продуктов. Установлено, что у пациентов, отмечающих у себя как изолированную, так и сочетанную непереносимость молочных продуктов и продуктов с высоким содержанием FODMAP, наблюдается достоверное снижение активности всех изученных карбогидраз по сравнению с группой контроля (p < 0,05). Однако при проведении корреляционного анализа связи активности карбогидраз с клиническими симптомами выявлена достоверная взаимосвязь лишь между вздутием и урчанием в животе и уровнем активности отдельных ферментов (у больных с изолированной непереносимостью продуктов с высоким содержанием FODMAP и пациентов с сочетанной непереносимостью выявлена связь активности глюкоамилазы со вздутием и урчанием в животе (p < 0,05), а у пациентов с изолированной непереносимостью молочных продуктов обнаружена связь между уровнем активности глюкоамилазы и урчанием в животе (p < 0,05), а также между уровнем лактазы и вздутием живота (p < 0,05)).
С учетом многофакторности и сложности патогенеза синдрома раздраженного кишечника, вероятнее всего, клинические проявления пищевой непереносимости в данном случае обусловлены не только изменением активности кишечных карбогидраз, но и нарушением моторной функции кишечника, изменениями баланса микрофлоры, воспалением низкой степени активности, а также другими механизмами.
Тем не менее выявленное нами снижение активности кишечных ферментов у больных СРК, имеющих симптомы пищевых интолерантностей, позволяют предположить наличие у них дисахаридазной недостаточности, усугубляющей симптомы основного заболевания [14].
Заключение
Установлено, что пищевую непереносимость отмечали у себя 52 (41,3%) пациента с СРК, наиболее часто встречалась сочетанная непереносимость молочных продуктов и продуктов с высоким содержанием FODMAP (18,3%).
Среди пациентов, отмечающих у себя наличие всех исследованных пищевых интолерантностей (изолированную или сочетанную непереносимость молочных продуктов и продуктов с высоким содержанием FODMAP), установлено достоверное снижение активности кишечных ферментов (глюкоамилазы, лактазы, сахаразы и мальтазы) по сравнению с контролем (p < 0,05), что может указывать на наличие у них дисахаридазной недостаточности.
![]()
Авторы заявляют об отсутствии конфликта интересов.
S.R. Dbar, S.V. Bykova, PhD, E.A. Sabelnikova, PhD, O.V. Akhmadulina, N.I. Belostotsky, PhD, A.I. Parfenov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
National Medical and Surgical Center named after N.I. Pirogov, Moscow
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Saria R. Dbar, saradbar@yandex.ru
The aim was to evaluate the activity of intestinal carbohydrases in patients with irritable bowel syndrome (IBS) with symptoms of food intolerance.
Material and methods. 126 patients with IBS (83 women and 43 men, median age – 32.0 years (Q1–Q3: 27–38 years)) were examined. The diagnosis of IBS was established on the basis of Roman Criteria IV. A questionnaire was conducted for all patients to identify food intolerances, according to the results of which the patients were divided into three groups: the first – patients with isolated intolerance to foods with a high content of FODMAP; the second – patients with isolated intolerance to milk and dairy products; the third – patients with combined intolerance. To determine the activity of intestinal carbohydrates: lactase, sucrose, maltase and glucoamylase, all patients underwent esophagogastroduodenoscopy with biopsy samples from the duodenum. The activity of carbohydrases was determined by the Dahlquist method in the modification of N.I. Belostotsky. The control group consisted of 30 conditionally healthy people (10 men and 20 women, median age – 33.9 years (Q1–Q3: 24–35)), comparable in age and gender with patients with IBS. The activity of intestinal enzymes in this group was within the reference values. Statistical data processing was carried out using the computer program Statistica 8.0.
Results. According to the results of the survey, it was found that out of 126 patients with IBS, 52 (41.3%) patients believed that they had food intolerance to certain foods. Isolated intolerance to foods with a high content of FODMAP was noted by 13 (10.3%) patients, 16 (12.7%) patients believed that they had isolated intolerance to milk and dairy products, and 23 (18.3%) patients indicated combined intolerance. In patients with IBS and isolated intolerance to foods high in FODMAP, the median activity of glucoamylase was 120.0 (68.5–209.2) ng/mg of glucose per 1 mg of tissue per minute (ng/mg × min), maltase – 630.5 (480.7–951.0) ng/mg × min, sucrose – 50.0 (32.8–68.8) ng/mg × min, lactase – 10.5 (5.5–40.5) ng/mg × min. Comparing the activity of carbohydrases with the control group revealed the statistically significant difference (p < 0.05) for each enzyme studied.In the group of patients with IBS and isolated intolerance to milk and dairy products, the median activity of all the intestinal enzymes studied was also lower than that in the control group: the activity of glucoamylase was 107.0 (64.0–174.0) ng/mg × min, maltase – 622.0 (481.5–887.0) ng/mg × min, sucrose – 48.0 (35.5-60.0) ng/mg × min, lactase – 8.0 (3.0–22.5) ng/mg × min.
Among patients with IBS and the presence of combined intolerance to foods (with a high content of FODMAP and dairy products), the median activity of all enzymes significantly differed from the control group (p < 0.05). The activity of glucoamylase was 107.5 (57.5–194.2) ng/mg × min, maltase – 627.0 (480.7–911.7) ng/mg × min, sucrose - 47.5(34.8–61.5) ng/mg × min, lactase - 9.0 (4.0–28.8) ng/mg × min.
Conclusion. Food intolerance was noted in 52 (41.3%) patients with IBS. Among the patients who noted the presence of all the studied food intolerances (isolated or combined intolerance to milk and dairy products, as well as products with a high content of FODMAP), a significant decrease in the activity of intestinal enzymes (glucoamylase, lactase, sucrose and maltase) was found compared with the control (p < 0.05), which may indicate the presence of they have disaccharidase deficiency.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.