Актовегин в комплексном подходе к лечению и профилактике поздних осложнений сахарного диабета. II медицинский конгресс «Актуальные вопросы врачебной практики». Сателлитный симпозиум компании Takeda
- Аннотация
- Статья
- Ссылки




Синдром диабетической стопы как междисциплинарная проблема
Нейропатия лежит в основе многих поздних осложнений сахарного диабета (СД) и является одним из факторов развития синдрома диабетической стопы (СДС). Согласно международному соглашению по диабетической стопе (2000) СДС – это инфекция, язва и/или деструкция глубоких тканей стопы в сочетании с неврологическими нарушениями и/или снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести.
По данным российского регистра СД, у больных СД типа 1 СДС регистрируется в 5,6% случаев, СД типа 2 – в 2,4%. Однако, как отметила заведующая сектором эндокринологии Федерального бюро медико-социальной экспертизы, директор центра «Диабетическая стопа», профессор кафедры эндокринологии и диабетологии Российской медицинской академии последипломного образования, д.м.н. Ирина Владимировна ГУРЬЕВА, практика показывает, что распространенность этого осложнения значительно выше. Среди пациентов с СДС преобладают больные СД типа 2, у которых в 80% случаев отмечается нейроишемическая форма заболевания и в 16% случаев – нейропатическая.
Патогенез диабетической стопы сложный и имеет мультифакториальный характер. Один из главных факторов – диабетическая нейропатия. «Исследования показывают, что если пациент имеет нейропатию, то он просто стоит на одних и тех же точках (зонах), поскольку нарушена чувствительность. И эти зоны подвергаются ишемии в связи со сдавлением. В этих зонах может возникать пиковое давление, деформация и далее развиться язвенный дефект в силу повторяющегося травмирования», – уточнила докладчик.
Доказано, что атрофия тонких нервных волокон – самое раннее проявление диабетической нейропатии. Ситуация усугубляется с развитием нарушений в толстых нервных волокнах, что реализуется через снижение рефлексов, слабость мышц стоп, атрофию поперечно-полосатой мускулатуры, деформацию. Возникает скелетно-мышечная дезинтеграция.
Больные с диабетической полинейропатией (ДПН) в 15 раз чаще падают, чем больные без ДПН. Таким образом увеличивается риск переломов. Это подтверждают и результаты собственного исследования по выявлению рисков нарушения равновесия у пациентов с СД. Так, при тяжелой сенсомоторной нейропатии риск падений в 20 раз выше, чем без таковой1.
Еще одна проблема – нейропатическая артропатия, или нейроостеоартропатия (стопа Шарко). Нейроостеоартропатия – относительно безболезненно прогрессирующий дегенеративный процесс с поражением одного или нескольких суставов вследствие неврологического дефицита или неинфекционная деструкция суставов, ассоциированная с нейропатией. Безусловно, диагностировать СДС нужно как можно раньше.
Ведение пациентов с СДС предполагает мультидисциплинарный подход. В лечении должны участвовать не только эндокринологи, но и подиатры, хирурги, ортопеды.
Профессор И.В. Гурьева предложила алгоритм лечения диабетических язв стопы в зависимости от глубины поражения кожи (см. таблицу).
На первых двух стадиях помощь больным оказывают эндокринологи и подиатры, на поздних – подиатры и хирурги.
Уже на начальном этапе для предотвращения развития язвы больному рекомендуется носить разгрузочную обувь с индивидуальными многослойными стельками. Пациентам необходимо также использовать смягчающие и антисептические кремы для стоп.
Важное место в стандартах лечения занимает очищение язвы. Золотым стандартом считается использование скальпеля. В международном консенсусе по диабетической стопе (2011) указано, что, несмотря на большое количество продуктов для местного лечения раны (перевязочные материалы, мази и пр.), клиническая эффективность подавляющего большинства из них не подтверждена.
Необходимо проведение следующих процедур:
-
регулярное промывание струей воды или физиологического раствора;
-
применение повязки, поглощающей избыток экссудата, но не допускающей высыхания раны;
-
некрэктомия и удаление гиперкератоза с помощью скальпеля.
Очищение раны выполняет две функции. Первая, и основная, – удаление остатков тканей и инородных частиц, без чего невозможно заживление. Вторая – создание условий для эффективной дезинфекции. При этом антисептики следует использовать в относительно малых количествах, поскольку они могут вызвать побочные эффекты.
К основным методам лечения язвенных дефектов стоп помимо первичной обработки раны также относятся компенсация углеводного обмена, разгрузка пораженной конечности, использование современных атравматичных перевязочных средств, соответствующих стадии раневого процесса, при необходимости – системная антибиотикотерапия. Антибактериальная терапия требуется лишь пациентам с клиническими признаками инфекции и должна быть узконаправленной.
Постепенно внедряются и новые подходы к местному лечению, такие как гидрохирургия, лечение ростовыми факторами и пр.
Риск возникновения язвенных дефектов стоп резко возрастает при заболевании периферических артерий (ЗПА). ЗПА считается независимым фактором риска ампутаций. Именно поэтому для исключения ЗПА необходимо проводить скрининговые тесты.
Вероятность ЗПА высока при наличии таких факторов, как перемежающаяся хромота или боли покоя, отсутствие пульсации на обеих артериях стопы при пальпации, отсутствие сигнала или монофазный допплеровский сигнал от одной или обеих артерий стопы, снижение индексов на лодыжке и пальцах (лодыжечно-плечевой индекс систолического давления < 0,9, пальцево-плечевой индекс < 0,7).
Раннее выявление группы риска, мультидисциплинарный подход к лечению и обучение пациентов профилактическим мерам способны предотвратить ампутацию нижних конечностей. «Фактически каждый второй пациент находится в группе риска, особенно пациент с диабетом типа 2, и нам этих пациентов необходимо выявить», – пояснила профессор И.В. Гурьева.
Диагноз ДПН устанавливается при наличии типичной позитивной нейропатической симптоматики (боль, жжение, онемение, парестезии), неврологического дефицита (нарушение чувствительности всех модальностей, снижение или отсутствие сухожильных рефлексов на ногах) и подтверждается электрофизиологическими параметрами функции нерва.
Согласно международным рекомендациям возможная ДПН устанавливается при наличии признаков или симптомов, вероятная – и признаков, и симптомов, подтвержденная – при наличии признаков или симптомов и изменении электрофизиологических параметров, субклиническая ДПН – только при изменении электрофизиологических параметров2.
Инновацией в профилактике заболевания считается мониторирование температуры кожи стоп, что может предотвратить образование язвы.
Контроль СД снижает риск развития ДПН, однако, по мнению докладчика, наряду с нормализацией углеводного обмена необходимо проводить терапию для улучшения состояния периферических нервов – как в группе риска, так и у больных СДС.
Среди зарегистрированных препаратов для патогенетического лечения нейропатии особое место занимает Актовегин.
Актовегин представляет собой высокоочищенный гемодиализат, полученный методом ультрафильтрации из крови телят. В состав препарата входят органические низкомолекулярные соединения. Технология получения Актовегина исключает наличие белковых компонентов, обладающих антигенными и пирогенными свойствами. Актовегин оказывает метаболическое, нейропротективное, антиоксидантное действие и обладает доказанным влиянием на микроциркуляцию крови.
Один из главных эффектов Актовегина связан с увеличением утилизации глюкозы клетками различных органов и тканей, что крайне важно при СД, когда формируется энергетическая недостаточность. Актовегин содержит инозитол-фосфоолигосахариды, обладающие эффектом трансмиссеров и активирующие транспорт глюкозы. Так, на фоне приема препарата в пять раз увеличивается транспорт глюкозы (так же, как и инсулин). Это приводит к улучшению клеточного дыхания.
Учитывая влияние Актовегина на утилизацию глюкозы, в исследовании in vitro он вводился крысам для оценки воздействия на нейроны3. Был продемонстрирован выраженный нейропротективный эффект. Актовегин способствовал стимуляции митоза и синаптических связей, уменьшению апоптоза нейронов за счет снижения активности каспазы-3 и улучшению процессов мышления за счет снижения оксидативного стресса.
Возможностям активации вазомоторной и метаболической функций микрососудистого эндотелия с помощью препарата Актовегин было посвящено исследование А.А. Федорович и соавт.4 Оценка микроциркулярных процессов в коже осуществлялась с помощью компьютерной капилляроскопии и лазерной допплеровской флоуметрии с проведением функциональных проб. Изучение параметров микроциркуляторного потока проводилось до и после введения Актовегина в/в в дозах 1000 мг (n = 19) и 2000 мг (n = 9). Длительность процедуры – 120–150 минут. Было показано, что Актовегин увеличивает скорость капиллярного кровотока, улучшает клеточный и тканевый метаболизм, предотвращает обкрадывание капилляров и поступление крови в основное обменное звено.
В настоящее время доказано, что длительное лечение Актовегином оказывает защитное воздействие на периферические нервы. Так, в двойном слепом мультицентровом плацебоконтролируемом рандомизированном клиническом исследовании по оценке эффективности и безопасности Актовегина у больных СД типа 2 и ДПН отмечено значимое улучшение ключевых параметров в группе Актовегина по сравнению с группой плацебо5. Пациентам группы Актовегина (n = 276) препарат сначала вводился в/в – 20 инфузий в дозе 2000 мг/сут, затем в течение 140 дней – перорально в дозе 1600 мг/сут. 280 больных по той же схеме получали плацебо.
В конце исследования симптомы ДПН, оцениваемые по шкале TSS (Total Symptom Score – шкала общей оценки симптомов), в группе Актовегина достоверно (р < 0,0001) уменьшились по сравнению с группой плацебо, а также снизились параметры колющей, жгучей боли, парестезий и т.д. При использовании Актовегина уменьшение порога вибрационной чувствительности было достоверным по сравнению с исходным уровнем (р = 0,017). При этом данный показатель в группе Актовегина был выше, чем в группе плацебо, – -3,6 ± 4,7 против -2,9 ± 4,7 В. Выраженность сенсорной функции по шкале NIS-LL (Neuropathy Impairment Score Low Limb – шкала нейропатической симптоматики в ногах) также достоверно уменьшилась у больных, получавших Актовегин (р = 0,0045). На фоне Актовегина по сравнению с плацебо значительно улучшились показатели SF-36 (неспецифический опросник для оценки качества функционирования, эмоционального состояния и психического здоровья) – 5,5 ± 10,6 против 3,8 ± 10,1 балла.
Результаты исследования позволили сделать вывод: последовательное внутривенное и пероральное лечение Актовегином в течение 160 дней улучшило нейропатические симптомы, порог вибрационной чувствительности, а также сенсорные функции. При этом отмечено положительное влияние терапии на качество жизни пациентов.
Профиль безопасности Актовегина был сопоставим с профилем безопасности плацебо.
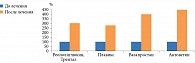
Актовегин не только эффективно снижает выраженность симптомов ДПН, но и способствует улучшению равновесия. Так, 20 пациентов с нарушением равновесия были разделены на две группы. Обе группы получали сахароснижающую терапию. Пациентам первой группы в дополнение были назначены Актовегин в дозе 2,0 г в сутки в/в (14 инфузий), в дальнейшем перорально в дозе 1200 мг/сут в течение 83 дней и комплекс физических упражнений для тренировки мелких мышц стопы6.
У пациентов первой группы было достигнуто улучшение равновесия по SOT-3 (Sensory Organization Test 3 – тест сенсорной организации в условиях с подвижным визуальным окружением), общему счету симптомов полинейропатии и периферическим расстройствам (рис. 1).
Прием Актовегина в течение трех месяцев сопровождался:
-
улучшением равновесия (тест моторного контроля, р < 0,05);
-
улучшением качества жизни (для суммарного показателя, р < 0,05);
-
снижением общего счета симптомов полинейропатии (р < 0,05).
Целесообразность и эффективность применения Актовегина у больных с нейроишемическим болевым синдромом при периферической ангиопатии были продемонстрированы в исследовании, проведенном И.В. Гурьевой и соавт.7 В открытом сравнительном пилотном рандомизированном восьминедельном исследовании оценивалась эффективность препаратов Актовегин и сулодексид для лечения нейроишемических болей при перемежающейся хромоте у больных СД типов 1 и 2. Пациенты в группе Актовегина получали препарат в/в в дозе 2000 мг/сут в течение двух недель с последующим переходом на пероральный прием в дозе 1200 мг в день в течение шести недель. В группе сулодексида препарат назначался внутривенно в дозе 1200 ЛЕ/сут с последующим переходом на 1000 ЛЕ/сут в течение шести недель.
Прием препаратов в обеих группах способствовал увеличению времени ходьбы до боли. Однако в отношении указанного показателя эффективность Актовегина оказалась выше.
Результаты исследования продемонстрировали, что абсолютный прирост максимального времени ходьбы до появления болевых ощущений в группе Актовегина был почти в два раза выше. Так, время ходьбы до боли составило 160,1 против 84,9 секунды в группе сулодексида; относительный прирост показателя тоже был выше – 95,1 и 38,2% соответственно.
Резюмируя вышесказанное, профессор И.В. Гурьева отметила, что Актовегин улучшает качество жизни больных СД, причем не только благодаря противоболевому, но и противоишемическому действию. Препарат может применяться в комплексном лечении таких больных, поскольку модифицирует риск развития диабетической стопы.
Особенности реконструктивных операций на артериях нижних конечностей у пациентов с СД и критической ишемией
По словам профессора кафедры факультетской хирургии № 1 Российского национального исследовательского медицинского университета им. Н.И. Пирогова, д.м.н. Максима Робертовича КУЗНЕЦОВА, СД и атеросклероз – два многофакторных заболевания, которые, вероятнее всего, взаимообусловливают друг друга. К особенностям атеросклероза на фоне СД можно отнести частое поражение периферических артерий, высокую вероятность инфицирования раны и сосудистого имплантата или наличие инфицированного очага, который усугубляет клиническую ситуацию, значительно повышая риск инфицирования сосудистых протезов.
Одним из методов инструментальной диагностики хронической ишемии конечностей является измерение лодыжечно-плечевого индекса с помощью ультразвукового исследования. При СД вследствие медиакальциноза часто наблюдаются высокие значения лодыжечно-плечевого индекса, что может привести к диагностическим ошибкам и недооценке тяжести поражения артерий.
Тактика ведения больного СД с микро- и макроангиопатией или атеросклеротическим поражением артерий нижних конечностей предусматривает в первую очередь коррекцию углеводного обмена и устранение факторов риска атеросклероза. После чего проводят санацию инфицированных очагов и реконструктивные сосудистые операции.
Только наличие влажной гангрены пальцев или стопы является показанием к гильотинной ампутации с последующим ангиохирургическим вмешательством. При критической ишемии в сочетании с СД и наличии болевого синдрома и некротических изменений кожи, мягких тканей, костей чаще всего выполняется ампутация, реже – артериальная реконструкция.
К сожалению, проведенные сосудистые вмешательства не всегда оказываются эффективными и могут стать причиной образования тромбов в шунтах и протезах. По мнению докладчика, основные причины тромбозов в раннем послеоперационном периоде помимо погрешностей хирургической техники и нарушений гемостаза заключаются в снижении притока крови к сосудистому имплантату и нарушении ее оттока от зоны, где помещен имплантат.
Уточнить показания к операциям на артериях нижних конечностей позволяет исследование функционального состояния сосудов микроциркуляторного русла. Правильная оценка их пропускной способности позволяет выделить группу пациентов с высоким риском тромбоза шунта, которым требуется специальная медикаментозная подготовка, своевременно изменить тактику лечения больных и сделать прогноз относительно эффективности оперативного вмешательства.
Одним из принципиально новых неинвазивных методов, позволяющих эффективно оценить пропускную способность микроциркуляторного русла, является ультразвуковая функциональная дебитометрия, разработанная М.Р. Кузнецовым и соавт. «Мы определяем скорость притока крови по подколенной артерии и скорость оттока крови по подколенной вене после физической нагрузки. В норме у здоровых людей после выполнения физической нагрузки усиливается приток крови по артерии и адекватно идет отток по вене. У ряда пациентов, особенно с СД, этот механизм сильно нарушен: возникает гипертензия на уровне сосудов микроциркуляторного русла, что чревато тромбозом», – пояснил докладчик.
На сегодняшний день ультразвуковая функциональная дебитометрия – один из наиболее перспективных способов оценки возможности проведения реконструктивных сосудистых операций у пациентов с хронической артериальной недостаточностью нижних конечностей.
Профессор М.Р. Кузнецов представил результаты собственного исследования эффективности предоперационной медикаментозной подготовки сосудистого русла у пациентов с атеросклеротическим поражением артерий нижних конечностей. Всем участникам до начала терапии и по ее окончании проводилась ультразвуковая функциональная дебитометрия. В качестве предоперационной медикаментозной подготовки они получали препараты Трентал с Реополиглюкином, Плавикс, Вазапростан, Актовегин.
Результаты исследования продемонстрировали, что Актовегин лучше других препаратов восстанавливает пропускную способность микроциркуляторного русла (рис. 2).
Так, скорость кровотока по подколенной вене после физической нагрузки, отражающая функциональные (пропускные) возможности микроциркуляторного русла, увеличилась в 4,5 раза.
Был сделан вывод: предоперационная медикаментозная подготовка, в том числе препаратом Актовегин, позволяет улучшить функциональное состояние сосудов и предотвратить риск развития ранних тромботических осложнений как вследствие снижения периферического сосудистого сопротивления, так и вследствие профилактики реперфузионного синдрома после восстановления кровотока.
Профессор М.Р. Кузнецов привел несколько примеров применения ультразвуковой функциональной дебитометрии в предоперационном периоде и предоперационной медикаментозной подготовки с использованием препарата Актовегин в клинической практике у больных СД с окклюзией поверхностной бедренной и передней большеберцовой артерии, сегментарной окклюзией бедренной артерии, высокой окклюзией инфернального отдела аорты, нейроишемической формой СДС. Благодаря этим мероприятиям период после сосудистых хирургических вмешательств у пациентов прошел без осложнений.
Необходимо отметить, что чаще всего развитие тромботических осложнений приходится на средний (до 1,5 года) и поздний (более 1,5 года) послеоперационные периоды.
СД является фактором, повышающим риск гиперплазии неоинтимы и прогрессирования атеросклероза. Как следствие, увеличивается риск высокой ампутации.
По мнению докладчика, артериальные реконструкции у больных СД и ишемией четвертой степени без санации некротических очагов могут привести к осложнениям в виде нагноения раны, инфицирования протеза. На этом фоне большие дозы антибактериальных препаратов, назначаемых парентерально, не способны в достаточной концентрации достичь очагов некроза. «Там присутствует очень злая, часто анаэробная флора, с которой необходимо бороться. Таким пациентам проводим сначала комплексное лечение в виде консервативной терапии препаратом Актовегин и хирургической санации гнойной раны, после чего выполняется артериальная реконструкция», – отметил М.Р. Кузнецов.
В подтверждение эффективности подобной тактики лечения профессор М.Р. Кузнецов привел данные еще одного исследования. В нем приняли участие 32 пациента, страдавших облитерирующим атеросклерозом на фоне СД типа 2 и имеющих некротические изменения в нижних конечностях. Согласно лабораторным исследованиям на наличие микроорганизмов в раневом отделяемом установлено, что большинство составляют облигатные анаэробы (93,8%). На грамположительные бактерии приходится 46,9%, энтеробактерии – 21,9% и неферментирующие грамотрицательные бактерии – 15,6%.
Тактика ведения больных предполагала предоперационную консервативную терапию Актовегином, хирургическую обработку гнойных ран, нанесение 1%-ного Метрогил геля и Йодопирона на гнойно-некротические участки, артериальную реконструкцию. Оценка результатов операций показала высокую эффективность лечения: подавляющему большинству пациентов (96,9%) удалось сохранить всю конечность или опорную функцию стопы и лишь одному больному была проведена ампутация на уровне голени. Не было зарегистрировано ни одного случая нагноения послеоперационной раны или инфицирования протеза.
Завершая выступление, профессор М.Р. Кузнецов сформулировал следующие выводы:
-
при четвертой степени хронической ишемии нижних конечностей на фоне СД без влажной гангрены и интоксикации необходимо попытаться спасти конечность от высокой ампутации;
-
оптимальным является выполнение сосудистой реконструкции с предварительной предоперационной подготовкой;
-
применение данного подхода может способствовать сохранению конечности или снизить уровень ампутации (в зависимости от локализации и тяжести поражения).
Заключение
Мультифакториальная и многокомпонентная природа Актовегина определяет его эффективность при широком спектре патологических состояний, включая ДПН, СДС, критическую ишемию нижних конечностей у больных СД. В основе его действия лежит ряд механизмов, приводящих к усилению внутриклеточного метаболизма. Это способствует повышению потребления кислорода, а также усилению поступления в клетки глюкозы. Актовегин оказывает метаболическое, нейропротективное, антиоксидантное действие. Доказано, что он также влияет на микроциркуляцию крови. Предоперационная медикаментозная подготовка препаратом Актовегин позволяет улучшить функции сосудов и предотвратить риск развития ранних тромботических осложнений как вследствие снижения периферического сосудистого сопротивления, так и вследствие профилактики реперфузионного синдрома после восстановления кровотока.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.