Актуальные вопросы диагностики и лечения карпального туннельного синдрома
- Аннотация
- Статья
- Ссылки
- English
В обзоре рассмотрено современное представление о заболевании и подчеркнуты потенциальные темы для дальнейших научных исследований.
В обзоре рассмотрено современное представление о заболевании и подчеркнуты потенциальные темы для дальнейших научных исследований.

Карпальный туннельный синдром (КТС) – симптомокомплекс, возникающий в результате прогрессирующей нейропатии срединного нерва при компрессии на уровне запястья с последующим сенсорным, моторным и вегетативным расстройством кисти.
В связи с высокой распространенностью патология считается хорошо изученной. Однако, по данным экспертного консенсуса [1], публикаций с хорошим уровнем доказательности и убедительности доказательств по вопросам диагностики КТС пока недостаточно. Скорее всего, это связано с тем, что КТС – гетерогенное заболевание, которое может возникнуть и как первичное состояние, и как вторичное вследствие текущего патологического процесса.
Первичный КТС может быть связан с гипертрофией синовиальной оболочки сухожилий сгибателей в результате дегенерации соединительной ткани с признаками склероза сосудов, отеком и фрагментацией коллагена [2, 3].
Причины вторичного КТС многообразны и могут быть ассоциированы или не ассоциированы с травмой. Само заболевание может носить острый или хронический характер, последнее наблюдается значительно чаще. Из известных этиологических факторов нередко отмечаются отечный синдром, суставной синдром, инфекционные и онкологические заболевания, эндокринные болезни (сахарный диабет, дисфункция щитовидной железы) [4], анатомические особенности и т.д.
При любой нейропатии, включая КТС, важно выделить диагностические задачи, что необходимо для выбора оптимального и своевременного лечения. В перечень таких задач входят определение локализации процесса, оценка степени повреждения и дифференциальная диагностика.
На сегодняшний день уже разработаны рекомендации по электродиагностике (электронейромиография, ЭНМГ) [5], выполнению ультразвукового исследования (УЗИ) срединного нерва [6], экспертный консенсус по ЭНМГ и УЗИ при КТС [1], а также рекомендации по лечению КТС [7]. Кроме того, существуют различные клинические шкалы для определения выраженности нейропатии, из которых только одна валидирована в России [8].
КТС – клинический диагноз, требующий инструментального подтверждения с помощью ЭНМГ. В качестве дополнительного метода диагностики может быть применено УЗИ [9]. Важно отметить, что при диагностике нейропатий, включая КТС, УЗИ как самостоятельный метод не используется, его сочетание с ЭНМГ всегда информативнее [1].
Когда УЗИ может быть необходимо и должно быть рекомендовано?
В экспертном консенсусе 2022 г. выделено несколько ситуаций [1]:
- клиническая картина КТС с нормальной ЭНМГ или ЭНМГ с изменениями, которые не позволяют определить степень поражения нерва;
- неэффективное оперативное лечение КТС;
- полинейропатия;
- вторичный КТС, подозрение на структурные изменения.
Градация степени тяжести проводится с помощью клинических шкал и ЭНМГ, и, несмотря на попытки создания сонографической классификации, данных в мировой литературе пока недостаточно. Дальнейшего изучения требует и информативность УЗ-характеристик, таких как эхогенность нерва, дифференцировка его на волокна, интраневральная васкуляризация, вариантное строение, толщина карпальной связки, а также необходимость эластографии.
Эксперты рекомендуют сканировать нерв на всем протяжении с уровня предплечья до запястья, оценивать площадь поперечного сечения в точке максимального уплощения нерва, а также в отдельных случаях проводить продольное сканирование и определять индекс площади «запястье – предплечье».
Большинство авторов указывают на то, что оптимальным вариантом лечения КТС является хирургическое, в том числе на ранних стадиях. Успех оперативного вмешательства снижается пропорционально степени тяжести КТС [10]. Относительно открытого или закрытого метода декомпрессии нерва единого мнения среди специалистов пока не существует, однако подчеркивается их сопоставимая эффективность [7].
Нередко пациенты хотят начать с консервативной терапии, что возможно при легком и умеренном КТС. Согласно данным систематического обзора, отдельные методы действительно могут облегчать симптомы КТС, а именно [11]:
- ортезирование;
- прием пероральных препаратов;
- инъекции глюкокортикоидов (ГК) в карпальный канал;
- электротерапия;
- мануальная терапия;
- физические упражнения;
- различные комбинации вышеописанных процедур.
Среди консервативных методов терапии наиболее доказанной эффективностью обладают блокады в запястный канал (уровень А, система GRADE), ортезирование (уровень А, система GRADE), а также пероральный прием ГК (уровень В, система GRADE) [7].
При выборе того или иного метода лечения прежде всего следует ориентироваться на пожелания пациента, однако необходимо соотносить их с объективными данными и информировать о последних достижениях в медицине.
Чаще всего выбор делается между ортезированием и лечебными блокадами.
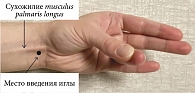
Локальная инъекционная терапия (ЛИТ) глюкокортикоидами в карпальный канал имеет уровень доказательности А (система GRADE), однако ее клинический эффект краткосрочный – не менее одного месяца [12]. Инъекция вводится медиальнее (ближе к мизинцу) сухожилия musculus palmaris на уровне проксимальной складки запястья под углом 30° по направлению к безымянному пальцу. Для обнаружения сухожилия длинной ладонной мышцы пациенту необходимо предложить несколько согнуть кисть в лучезапястном суставе и соединить первый и четвертый пальцы (рис. 1) [13].
Перед введением препарата необходимо, во-первых, удостовериться, что игла не смещается при движении пальцев, то есть не находится в сухожилии, во-вторых, удостовериться, что пациент не испытывает парестезий и/или боли, то есть игла не находится в нерве, и, в-третьих, выполнить аспирационную пробу. Если при введении лекарства ощущается значимое сопротивление при давлении на поршень или пациент сообщает о возникновении болевых ощущений, необходимо изменить положение иглы [14].
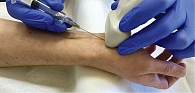
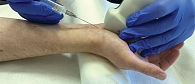
Доказано, что использование УЗ-навигации при проведении ЛИТ повышает ее эффективность и снижает вероятность развития осложнений [15, 16]. В настоящее время описаны различные техники проведения блокады при КТС с использованием УЗ-навигации. При доступе с ульнарной или радиальной стороны предплечья УЗ-датчик устанавливается перпендикулярно нерву на уровне лучезапястной складки, что позволяет непрерывно отслеживать продвижение иглы (методика in-plane) [17]. При введении иглы по ходу срединного нерва датчик можно расположить перпендикулярно (методика out-plane) (рис. 2) или параллельно нерву (рис. 3) [18–20].
В настоящий момент времени не существует однозначных рекомендаций по частоте и числу инъекций, так же как нет доказательств преимущества какого-либо конкретного ГК [12, 21]. Система UpToDate при КТС предлагает введение инъекций ГК не чаще одного раза в шесть месяцев, а при возобновлении симптомов после двух инъекций – назначение альтернативного консервативного лечения, если оно ранее не проводилось, или хирургического [22].
Объема данных о преимуществе того или иного вида или режима ношения ортеза пока недостаточно. Однако уже доказано, что ортезирование предотвращает избыточное сгибание/разгибание кисти в лучезапястном суставе, приводящее к увеличению давления в канале, и таким образом облегчает состояние [22]. Как правило, ортезирование лучезапястного сустава рекомендуется на время ночного сна, но ортез можно использовать и в дневные часы при нагрузке на кисть (рис. 4).
Оба метода достаточно эффективны в купировании симптомов КТС, однако последние публикации свидетельствуют о том, что ортезирование менее предпочтительно, чем инъекции ГК. Так, согласно результатам исследования INSTINCTS, эффективность однократной инъекции ГК через шесть недель после введения превосходила эффективность ортезирования лучезапястного сустава в ночные часы [23], что делает ее методом выбора для быстрого купирования симптомов КТС легкой и средней степени тяжести.
В ФГБНУ «Научный центр неврологии» с 2018 по 2021 г. проводилось сравнительное исследование эффективности ЛИТ и ортезирования лучезапястного сустава при идиопатическом КТС средней степени тяжести. В исследование были включены 105 пациентов с идиопатическим КТС средней степени тяжести, определяемой по критериям AANEM 2011 г. [5]. Пациентов рандомизировали на две группы в зависимости от проводимого лечения. Основная группа (n = 54) получила одну или две инъекции ГК (бетаметазон 5 мг + 2 мг/1,0 мл) с лидокаином 2% 1,0 мл под УЗ-контролем в карпальный канал. Контрольной группе (n = 51) было назначено ортезирование лучезапястного сустава в ночные часы сроком на один месяц. Через месяц эффективность инъекционной терапии, оцениваемая по SSS, FSS, LANSS, ВАШ, оказалась достоверно выше (p < 0,0001). Клинические данные были подтверждены нейрофизиологическими – только в основной группе было зафиксировано положительное влияние терапии на проводящую функцию двигательной и чувствительной порции срединного нерва (p < 0,0001). Средняя продолжительность клинического эффекта ЛИТ оказалась выше, чем у ортезирования, и составила четыре месяца.
Пероральный прием ГК указан в международных рекомендациях по лечению КТС [7]. Однако к этому варианту терапии эксперты относятся сдержанно из-за меньшей эффективности, чем блокады, и его поддержки исследованиями недостаточного уровня доказательности и убедительности доказательств (уровень В, система GRADE). Согласно системе UpToDate, при отказе пациента от проведения инъекции назначается преднизолон перорально по следующей схеме: 20 мг/сут в течение 10–14 дней [22].
На сегодняшний день эксперты не рекомендуют терапию КТС нестероидными противовоспалительными препаратами, диуретиками, витаминами группы В и габапентином, так как они не продемонстрировали значимого клинического эффекта по сравнению с плацебо [7, 22].
Поиск консервативной терапии КТС с применением таблетированных препаратов продолжается, так как персонифицированный подход предполагает обеспечение комфорта для пациента, а это в первую очередь простота приема медикаментов и сокращение времени лечебных мероприятий. Кроме этого, многим пациентам необходимо знать, что им назначена поддерживающая нейрометаболическая терапия. В отдельных случаях такой подход увеличивает приверженность лечению и доверие специалисту.
Нередко пациентам с неврологическими расстройствами назначают ингибиторы холинэстеразы, в частности ипидакрина гидрохлорид (Нейромидин). Препарат характеризуется хорошим соотношением риска и пользы при лечении пациентов с периферическими парезами, что отличает его от классических препаратов той же группы [24].
Ипидакрина гидрохлорид включен в текущие стандарты оказания медицинской помощи в РФ при многих заболеваниях периферической нервной системы, например при диабетической полинейропатии, хронической воспалительной демиелинизирующей полинейро(радикуло)патии, поражении лицевого нерва, мононейропатиях конечностей [25].
Нейромидин показал обнадеживающие результаты в ряде рандомизированных клинических исследований по лечению различных нейропатий, включая компрессионную нейропатию лучевого нерва, что создает предпосылки для проведения дальнейших работ по оценке его эффективности у пациентов с КТС [26–29].
Таким образом, несмотря на актуальность и большое количество публикаций по проблеме КТС, остаются нерешенные вопросы в отношении дополнительных инструментальных методов диагностики, в частности УЗИ, других вариантов эффективного консервативного лечения в дополнение к ортезированию и лечебным блокадам.
N.V. Belova, PhD, N.A. Suponeva, MD, PhD, Prof., Corresponding member of the RASci., D.A. Grozova, D.G. Yusupova, PhD, E.V. Gnedovskaya, PhD
Research Center of Neurology, Moscow
Contact person: Natalia V. Belova, belovanv22@yandex.ru
Carpal tunnel syndrome is a symptom complex resulting from progressive neuropathy of the median nerve with compression at the level of the wrist. Currently, the study of this problem continues due to its versatility and a number of opportunities to simplify diagnosis and treatment.
This review describes the current understanding of the disease and highlights potential topics for further research.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.