количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Актуальные вопросы фармакотерапии статинами: фокус на Мертенил®
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №4
- Аннотация
- Статья
- Ссылки
В статье приводятся данные ряда метаанализов рандомизированных контролируемых исследований, в которых изучались роль статинов в первичной и вторичной профилактике атеросклероза, эффективность и безопасность генерических препаратов.
В статье приводятся данные ряда метаанализов рандомизированных контролируемых исследований, в которых изучались роль статинов в первичной и вторичной профилактике атеросклероза, эффективность и безопасность генерических препаратов.
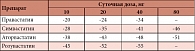
Таблица 1. Эффективность (%) статинов в различных дозировках в снижении уровня ХС ЛПНП по сравнению с соответствующими базовыми показателям

Таблица 2. Стоимость лечения статинами и эффективность затрат (на основе исследования STELLAR)
В настоящее время отмечается некоторая стабилизация проблемы сердечно-сосудистой заболеваемости, однако во всем мире все еще остаются высокими показатели смертности от заболеваний сердца и сосудов. Одна из главных причин – недостаточный и несвоевременный уровень диагностики и коррекции факторов риска (ФР), которых, по данным ВОЗ, насчитывается более 300.
Важно отметить: по данным ряда исследований, наиболее сильно подвержены воздействию различных ФР мужчины трудоспособного возраста (18–29 лет) [1, 2, 5]. При этом большую часть составляют поведенческие, то есть модифицируемые ФР. В этой связи авторы обосновывают необходимость раннего выявления ФР и разработки персонифицированных подходов к проведению первичной и вторичной профилактики сердечно-сосудистых заболеваний.
Самыми распространенными патофизиологическими процессами в сердечно-сосудистой системе являются атеросклероз, тромбоз и гипертония. Наиболее частыми осложнениями этих процессов считают мозговой инсульт и ишемическую болезнь сердца (ИБС), которые формируют структуру летальности [1].
Этиология сердечно-сосудистых заболеваний (ССЗ), за исключением достаточно редко встречающихся моногенных заболеваний, чрезвычайно сложна. Повышенные уровни атерогенных липидов и холестерина липопротеидов низкой плотности (ХС ЛПНП), триглицеридов (ТГ) и низкий уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) в плазме крови относятся к важнейшим ФР развития атеросклероза и его осложнений.
В последние годы пристальное внимание уделяется такой перспективной группе лекарственных препаратов, как статины. Эксперты ВОЗ отмечают, что применение статинов у больных с высоким риском ССЗ оказало значимое влияние на исходы сердечно-сосудистых заболеваний и достижение стратегической цели – снижение риска сердечно-сосудистых осложнений [7].
Статины относят к классу препаратов, оказывающих достоверное гипохолестеринемическое действие, которое основано на способности конкурентно ингибировать активность ГМГ-КоА-редуктазы. Превращение ГМГ-КоА-редуктазы в мевалоновую кислоту – ключевой этап синтеза эндогенного холестерина (ХС). В настоящее время в арсенале препаратов для практического применения на отечественном фармацевтическом рынке представлены все современные статины: ловастатин, симвастатин, флувастатин, правастатин, аторвастатин, розувастатин.
Статины разделяют на естественные (симвастатин, ловастатин, правастатин) и синтетические (аторвастатин, цервистатин, флувастатин). Розувастатин – синтетический ингибитор ГМГ-КоА-редуктазы (производное гептановой кислоты, связанное с пиримидиновой и сульфониламидной группой).
Метаанализ клинических исследований подтвердил высокий уровень доказательности препаратов этого класса в лечении пациентов с атеросклерозом и заболеваниями, способствующими развитию ИБС, – артериальной гипертонии (АГ) и сахарного диабета 2 типа (СД 2 типа). Имеется большая доказательная база по эффективности статинов в первичной и вторичной профилактике ССЗ [2, 4].
По данным исследования EUROASPIRE (European Action on Secondary Prevention through Intervention to Reduce Events), назначение статинов в Европе выросло за последнее десятилетие с 32,2 до 88,8%, однако достижение целевых уровней ХС ЛПНП остается на уровне 40% [9, 12]. Если частота назначения статинов в США достигает 95% от потребности, в Европе – 55%, то в России – только 12% [8]. Таким образом, несмотря на солидную доказательную базу, терапевтический потенциал статинов сегодня используется не полностью.
Международное исследование VALIANT (valsartan in acute myocardial infarction trial), в котором приняли участие более 30 стран, показало, что в России статины назначают почти в 100 раз реже, чем за рубежом [3].
Доказана роль статинов в первичной профилактике ССЗ. Так, крупнейшее эпидемиологическое исследование MRFIT (The Multiple Risk Factor Intervention Trial), в которое были включены 361 662 мужчины в возрасте 35–57 лет, выявило основные ФР развития ИБС, пороговый уровень общего холестерина (ОХС), равный 5,2 ммоль/л, абсолютный риск развития ИБС при самых высоких значениях ОХС (в 20 раз выше, чем при наиболее низких среднепопуляционных уровнях, равных 4,7 ммоль/л). Показано, что снижение уровня ХС на каждые 10% снижает смертность от ИБС на 15%, а общую смертность – на 11% [2].
Несмотря на сравнительно широкое применение статинов в развитых странах далеко не всегда удается достичь целевых уровней липидов (прежде всего атерогенных фракций) в плазме крови. При этом частота осложнений коронарного атеросклероза зависит именно от этого ФР, снижение которого представляется существенным резервом повышения эффективности первичной и вторичной фармакотерапевтической профилактики ССЗ.
Для лучшего понимания места и роли статинов у лиц без установленного атеросклеротического заболевания E. Mills и соавт. в 2008 г. выполнили метаанализ рандомизированных клинических исследований (РКИ), в которых были прослежены общая смертность, сердечно-сосудистая смертность, фатальный и нефатальный инфаркт миокарда (ИМ) и другие коронарные события. Общая смертность, по объединенным данным 19 РКИ (n = 63 899), в группе статина оказалась на 7% ниже, чем в контроле (группа плацебо, стандартной терапии или без лечения).
Влияние статинов на сердечно-сосудистую смертность оценено в 17 РКИ (n = 59 469). Риск данной конечной точки оказался на 11% ниже в группе статина, что подтверждает вывод об эффективности и безопасности терапии статинами в целях первичной профилактики смерти от всех причин и основных сердечно-сосудистых событий, связанных с атеросклерозом.
По данным исследований, проведенных в последние годы, медикаментозная гиполипидемическая терапия статинами приводит к снижению на 25–40% коронарной смертности, на 26–36% уменьшает риск развития ишемических событий (4S, HPS, AFCAPS/TexCAPS, WOSCOPS, CARE, LIPID, MIRACL, AVERT) [4, 5]. При этом снижение коронарных осложнений у женщин (46%) было более выраженным, чем у мужчин (20%) [13].
В первичной профилактике ИБС было получено достоверное снижение сердечно-сосудистой смертности на 28 и 34% (ловастатин – AFCAPS/TexCAPS; правастатин – WOSCOPS) [3, 5]. Во вторичной профилактике ИБС, когда у больных исходный риск осложнений атеросклероза исходно выше, снижение сердечно-сосудистой смертности в исследованиях CARE, LIPID (правастатин) составило 20 и 24% соответственно [5, 12] и 42% в исследовании 4S [4, 9].
В завершившемся исследовании GREACE (GREek Atorvastatin and Coronary-heart-diseasse Evaluation) [6] впервые показана возможность снижения сердечно-сосудистой смертности на 47% при лечении аторвастатином в средней дозе 24 мг/сут в рутинной клинической практике, хотя исследование не было плацебоконтролируемым. Получены достоверные результаты по эффективности и переносимости суточных доз аторвастатина в диапазоне 20–80 мг у больных с семейной гиперхолестеринемией [9, 11].
Метаанализ, обобщивший итоги длительного лечения более 90 тыс. пациентов, был опубликован в октябре 2005 г. в журнале Lancet [1]. По результатам 14 лучших многоцентровых плацебоконтролируемых исследований сделан вывод, что статины достоверно снижают риск общей (на 12%) и коронарной (на 19%) смерти, достоверно уменьшают риск острого инфаркта миокарда (ИМ) (на 26%) и реваскуляризаций (на 24%), одновременно достоверно ограничивают риск цереброваскулярных осложнений (инсультов – на 17%, причем ишемических – на 19%), не увеличивают риска смерти от несердечных причин и рака.
Кроме того, описано много дополнительных «нелипидных» эффектов статинов, имеющих самостоятельное значение. В первую очередь это благоприятное влияние на функцию эндотелия и медиаторы воспаления, антитромботическое и антипролиферативное действие [7].
Сегодня наибольшее внимание привлекает противовоспалительное действие статинов. Уровень С-реактивного белка (СРБ) в данном случае служит важным индикатором активности воспалительного процесса как в стенке сосуда, так и в сформировавшейся атеросклеротической бляшке. Нестабильности атеромы обязательно сопутствует воспаление с активным выделением цитокинов, медиаторов воспаления, интерлейкинов, что в совокупности с изменением липидного ядра, нарушением целостности фиброзной оболочки бляшки, склонностью к тромбообразованию приводит к атеротромбозу и развитию жизнеугрожающих событий. Во многих клинических исследованиях показано, что снижение уровня СРБ под воздействием лечения статинами уменьшает риск сердечно-сосудистой заболеваемости и смертности. Появились сообщения о клинической эффективности статинов при демиелинизирующих заболеваниях нервной системы, ревматоидном артрите, сахарном диабете, который рассматривается в качестве самостоятельного показания к постоянному приему статинов.
Наибольший интерес представляют статины последнего поколения, к которым относится розувастатин. Розувастатин – относительно новый, полностью синтетический ингибитор, который способен ингибировать более чем на 90% активность ГМГ-КоА-редуктазы, циркулирующей в крови [3]. Основной мишенью розувастатина является печень, где осуществляется синтез холестерина и катаболизм ЛПНП. Молекулы розувастатина более гидрофильны, чем молекулы большинства других статинов, высокоселективны к мембранам гепатоцитов и оказывают более выраженное ингибирующее влияние на синтез ХС ЛПНП и холестерин липопротеидов очень низкой плотности (ХС ЛПОНП), чем другие статины.
Препарат быстро всасывается из кишечника, пища снижает скорость всасывания препарата. Биодоступность розувастатина при пероральном приеме составляет примерно 20%, что выше, чем у ловастатина и симвастатина, и примерно соответствует таковой у права-, флува- и аторвастатина. Максимальная концентрация розувастатина в плазме достигается через 3–5 ч после приема, период его полувыведения составляет 18–20 ч, связь с белками плазмы – 88%, причем у других статинов этот показатель превышает 95%, за исключением правастатина (~50%). Максимальный терапевтический эффект розувастатина развивается в среднем к 4-й неделе, после чего остается постоянным.
Розувастатин снижает уровень общего ХС, ХС ЛПНП, ТГ, повышает уровень ХС ЛПВП, а также снижает уровень аполипопротеина В (Апо-В), ХС неЛПВП, ХС ЛПОНП, ТГ ЛПОНП и увеличивает уровень аполипротеина А-I (АпоА-I).
В отличие от остальных статинов розувастатин минимально взаимодействует с ферментами системы цитохрома Р450, в связи с чем вероятность его взаимодействия со многими лекарственными препаратами небольшая. До 90% принятого препарата выделяется в неизмененном виде с калом, около 10% – с мочой. Метаболизируется лишь 10% розувастатина, его главный метаболит N-десметилрозувастатин примерно в 2 раза менее активен, чем основное вещество.
Одной из главных особенностей розувастатина следует считать его высокую гиполипидемическую эффективность уже в начальной суточной дозе (10 мг/сут), которая возрастает с повышением дозы до максимальной. Установлено, что в дозе 10 мг/сут розувастатин снижает уровень ХС ЛПНП на 47–52% от исходного, а при назначении максимальной разрешенной дозы (40 мг/сут) – на 63% [3].
Данные показатели приобретают особое значение с учетом результатов нескольких отечественных клинических исследований по оценке среднестатистического режима дозирования статинов в рутинной практике (в том числе данные клинического исследования ПОРА). Выявленная среднесуточная доза статинов колебалась от 12 до 17 мг, при этом целевые уровни были достигнуты в среднем менее чем в 30% случаев [3, 7]. У 80% пациентов с гиперхолестеринемией IIa и IIb типа (средний исходный уровень ХС ЛПНП около 4,8 ммоль/л) на фоне приема розувастатина в дозе 10 мг уровень ХС ЛПНП достигает значений менее 3,0 ммоль/л.
Для изучения клинических эффектов приема разных доз розувастатина была проведена крупномасштабная исследовательская программа GALAXY. В эту программу вошли 17 крупных испытаний с участием нескольких десятков тысяч пациентов (исследования STELLAR, MERCURY-1, MERCURY-2, COMETS, PULSAR, POLARIS, ORION, ASTEROID и METEOR, CORONA и AURORA). В названных исследованиях всесторонне изучались влияние розувастатина на течение атеросклероза, возможности первичной и вторичной профилактики ССЗ и их осложнений.
В рандомизированное плацебоконтролируемое исследование JUPITER (Justification for the Use of statins in Primary prevention: an Intervention Trial Evaluating Rosuvastatin) всего было включено 17 800 пациентов с близким к норме уровнем ХС ЛПНП, однако входящих в группу риска развития ССЗ в связи с возрастом и повышенным уровнем СРБ. Показано, что розувастатин на 44% снижает риск развития ССЗ у всех групп пациентов в сравнении с плацебо. Выявлено сокращение риска по всем компонентам первичной конечной точки, которая включала сердечный приступ, инсульт, смерть и артериальную реваскуляризацию. В исследовании JUPITER не зарегистрировано увеличения частоты геморрагических инсультов на фоне приема розувастатина, а риск ишемических инсультов достоверно снизился. Так, если под действием статинов удается снизить уровень ЛПНП до величины < 1,8, а СРБ до < 2 мг/л, такие больные выживают существенно лучше, чем те, у кого целевые уровни не достигнуты. При этом настоящее утверждение справедливо как для больных с ИБС, в том числе при остром коронарном синдроме (исследование PROVE-IT), так и для первичной профилактики (исследование JUPITER). У относительно здоровых людей с повышенным уровнем СРБ назначение активного статина приводит не только к снижению риска ИМ или инсульта, но и к уменьшению частоты тромбоэмболических осложнений и смертности от онкологических заболеваний.
Результаты исследования CORONA (COntrolled ROsuvastatin multiNAtional trial in heart failure) показали, что применение розувастатина в противоположность плацебо приводило к уменьшению числа госпитализаций в связи с осложнениями ССЗ, а также к эффективному снижению концентрации ХС ЛПНП и высокочувствительного СРБ в крови. Изучение эффективности и дозозависимых эффектов статинов позволяет ранжировать препараты этого класса. Так, при использовании одних и тех же доз эффективность снижения ХС ЛПНП при применении розувастатина выше в 1,5–2 раза таковой при приеме аторвастатина, в 4 раза – при приеме симвастатина, в 8 раз – при приеме правастатина и ловастатина. Поскольку уровень ХС ЛПНП при терапии рассматривается в качестве «суррогатной» точки для будущего снижения риска сердечно-сосудистых осложнений, от лечения розувастатином можно ожидать большего клинического эффекта (табл. 1).
Безусловно, при выборе препаратов важно учитывать их переносимость и безопасность. Имеющиеся данные свидетельствуют о хорошей переносимости всех зарегистрированных статинов (в том числе розувастатина) в рекомендованных терапевтических дозах. Случаев фатального рабдомиолиза при лечении розувастатином не отмечено [4, 6]. По современным данным, на 1 млн назначений всех статинов приходится 0,15 летального случая, обусловленного рабдомиолизом. Миотоксическое действие статинов зависит от концентрации препарата в крови и связано с состояниями, повышающими ее.
Что касается протеинурии и гематурии, они наблюдались лишь у небольшого числа пациентов и были транзиторными. При длительном применении розувастатина (в течение 3,8 года) более чем у 10 тыс. пациентов функция почек не ухудшалась, а в ряде случаев имела тенденцию к улучшению [1, 8]. Необходимо также отметить, что при назначении розувастатина у большинства пациентов нет необходимости в титровании дозы, что способствует повышению приверженности лечению. Повышение уровня печеночных ферментов – наиболее частый побочный эффект статинов – наблюдается в 0,5–2% случаев и зависит от дозы препарата. Других признаков гепатотоксичности на фоне лечения статинами не зарегистрировано.
У больных гепатитом С и В с повышенным уровнем трансаминаз назначение статинов не ухудшает течение заболевания. Лечение гиперлипидемии у больных с жировым гепатозом может даже уменьшить уровень трансаминаз в крови.
Частота побочных эффектов розувастатина сравнима с таковой у других статинов. Сообщается, что наиболее частыми побочными эффектами (частота – 5%), согласно данным контролируемых исследований, были фарингит (12,2%), боль (6,7%), головная боль (6,6%), синдром, подобный простуде (5,3%), и миалгия (5,1%). Все случаи миопатии развивались у пациентов, которые получали розувастатин в дозе 80 мг/сут, а повышение уровня креатинфосфокиназы регрессировало после отмены препарата.
Безопасность и переносимость розувастатина оценивали по данным лечения 16 876 пациентов, которые в рамках мультинациональной программы получали препарат в дозе 5–40 мг/сут. Побочные эффекты встречались у 52,1% пациентов на фоне розувастатина и у 51,8% – на фоне плацебо. Во всех сравнительных контролируемых исследованиях профиль безопасности розувастатина в дозе 5–40 мг был аналогичным таковому у других статинов (аторвастатин 10–80 мг, симвастатин 10–80 мг, правастатин 10–40 мг).
Ряд лекарств существенно увеличивают риск осложнений. Это фибраты (особенно гемфиброзил), никотиновая кислота, циклоспорин, противогрибковые препараты (азолы), антибиотики (макролиды), верапамил, амиодарон.
В условиях экономической доступности длительное применение статинов представляется рентабельным методом первичной и вторичной профилактики ССЗ, если учесть частоту госпитализаций в связи с ССЗ, стоимость дорогостоящих процедур, экономические потери от снижения трудоспособности и ее утраты [3, 14].
В настоящее время активно рекомендуется назначать статины в максимальных дозах, однако при этом лечение становится настолько дорогим, что даже в развитых странах такой подход не используется повсеместно.
Основой для анализа послужили результаты сравнительного исследования STELLAR (Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin), в которое было включено 2268 пациентов с первичной гиперхолестеринемией и уровнем ХС ЛПНП в пределах 160–250 мг/дл [10]. Целевые уровни ХС ЛПНП соответствовали рекомендациям экспертов Национальной образовательной программы по холестерину (NCEP АТР III) [11]. После 6-недельной терапии розувастатином в дозе 10–80 мг уровень ХС ЛПНП достоверно снизился (р ≤ 0,001), при этом розувастатин по эффективности превосходил на 26% правастатин (10–40 мг), на 18% – симвастатин (10–80 мг), на 8,2% – аторвастатин (10–80 мг). Установлено также, что препарат способен достоверно повышать уровень ХС ЛПВП плазмы и по этому эффекту превосходит аторвастатин [5]. Применение розувастатина привело не только к увеличению клинической эффективности, но и к снижению стоимости лечения, то есть препарат был доминирующей альтернативой. Стоимость поддерживающей дозы у розувастатина была минимальной (табл. 2).
В клиническом исследовании ПОРА у пациентов, страдающих ИБС/СД 2 типа (n = 531), в качестве причины отказа от приема статинов в 32% случаев отмечена высокая стоимость, а в 33% – боязнь побочных эффектов.
С учетом современных требований к генерическим препаратам по подтверждению их фармацевтической и терапевтической эквивалентности оригинальному препарату, а также положительного фармакоэкономического профиля, широко обсуждаются возможности применения в клинической практике воспроизведенных препаратов – лекарственных средств (ЛС), поступивших в обращение по истечении срока действия патентных прав на оригинальные ЛС [6, 7, 13].
Общепринято, что генерики, повторяющие оригинальные или инновационные ЛС, существенно (в связи с отсутствием затрат на научные исследования, экономией на производстве, маркетинговых технологиях) дешевле и доступнее для здравоохранения [3, 5]. При этом активно дискутируется вопрос о точности воспроизведения генериком фармакологических и терапевтических свойств, а также профиля безопасности референтного оригинального ЛС.
Исследование биоэквивалентности (БЭ) в настоящее время – ключевой метод клинических исследований, определяющий возможность регистрации воспроизведенного ЛС в США, Канаде, Японии, странах Евросоюза [9, 11]. Во всем мире регистрация генериков проводится на основании данных о БЭ. Необходимым условием регистрации является сопоставимость оригинального и воспроизведенного ЛС по эффективности и безопасности [12, 13]. Известно, что оценка био- или фаpмакокинетической эквивалентности ЛС – основной вид медико-биологического контроля качества генерических препаратов [10]. Два лекарственных препарата являются биоэквивалентными, если они обеспечивают одинаковую биодоступность ЛС.
В России появился первый генерик розувастатина – Мертенил (ЗАО «Гедеон Рихтер-РУС»). Мертенил® (розувастатин) – статин нового поколения. Это гиполипидемический препарат с хорошим профилем безопасности для лечения и профилактики атеросклероза. Проведено сравнительное изучение БЭ и фармакокинетики Мертенила® и оригинального препарата (Крестор, «АстраЗенека»). Исследование показало, что они эквивалентны по фармакокинетическим показателям и имеют одинаковую биодоступность.
Препарат Мертенил® зарегистрирован в РФ для применения у пациентов с первичной гиперхолестеринемией (тип IIа) или смешанной гиперхолестеринемией (тип IIb) в качестве дополнения к диете, когда диета и другие немедикаментозные методы лечения недостаточны, а также у пациентов с семейной гомозиготной гиперхолестеринемией. Мертенил® является единственным в России розувастатином с полным спектром дозировок (5, 10, 20 и 40 мг), что облегчает оптимальный подбор терапии для разных категорий пациентов с атеросклерозом и нарушениями липидного обмена. Препарат рекомендован к применению в суточных дозах 5–40 мг. Стартовая доза – 5–10 мг/сут.
Доступность по цене имеет большое значение для долгосрочного применения препарата широкими слоями населения. Назначение Мертенила® в эквивалентной дозе позволяет снизить стоимость проводимой фармакотерапии более чем на 40% по сравнению с применением оригинального препарата.
Таким образом, в лечении гиперлипидемий в последние годы достигнут большой прогресс. Совершен ряд фундаментальных открытий, позволивших разработать принципиально новые фармакологические подходы к лечению гиперлипидемий и атеросклероза. Существенно расширяются показания к длительному приему статинов. Появились новые перспективные препараты. К ним относится и розувастатин, который в ходе крупных испытаний уже в начальных (стартовых) дозах продемонстрировал значимое снижение атерогенных параметров липидного спектра плазмы крови и хорошую переносимость. Появление препарата Мертенил®, генерического препарата с доказанной эффективностью и безопасностью, наличием положительного фармакоэкономического профиля, позволит увеличить число пациентов, принимающих статины, и проводить эффективную первичную и вторичную профилактику сердечно-сосудистых заболеваний.
Важно отметить: по данным ряда исследований, наиболее сильно подвержены воздействию различных ФР мужчины трудоспособного возраста (18–29 лет) [1, 2, 5]. При этом большую часть составляют поведенческие, то есть модифицируемые ФР. В этой связи авторы обосновывают необходимость раннего выявления ФР и разработки персонифицированных подходов к проведению первичной и вторичной профилактики сердечно-сосудистых заболеваний.
Самыми распространенными патофизиологическими процессами в сердечно-сосудистой системе являются атеросклероз, тромбоз и гипертония. Наиболее частыми осложнениями этих процессов считают мозговой инсульт и ишемическую болезнь сердца (ИБС), которые формируют структуру летальности [1].
Этиология сердечно-сосудистых заболеваний (ССЗ), за исключением достаточно редко встречающихся моногенных заболеваний, чрезвычайно сложна. Повышенные уровни атерогенных липидов и холестерина липопротеидов низкой плотности (ХС ЛПНП), триглицеридов (ТГ) и низкий уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) в плазме крови относятся к важнейшим ФР развития атеросклероза и его осложнений.
В последние годы пристальное внимание уделяется такой перспективной группе лекарственных препаратов, как статины. Эксперты ВОЗ отмечают, что применение статинов у больных с высоким риском ССЗ оказало значимое влияние на исходы сердечно-сосудистых заболеваний и достижение стратегической цели – снижение риска сердечно-сосудистых осложнений [7].
Статины относят к классу препаратов, оказывающих достоверное гипохолестеринемическое действие, которое основано на способности конкурентно ингибировать активность ГМГ-КоА-редуктазы. Превращение ГМГ-КоА-редуктазы в мевалоновую кислоту – ключевой этап синтеза эндогенного холестерина (ХС). В настоящее время в арсенале препаратов для практического применения на отечественном фармацевтическом рынке представлены все современные статины: ловастатин, симвастатин, флувастатин, правастатин, аторвастатин, розувастатин.
Статины разделяют на естественные (симвастатин, ловастатин, правастатин) и синтетические (аторвастатин, цервистатин, флувастатин). Розувастатин – синтетический ингибитор ГМГ-КоА-редуктазы (производное гептановой кислоты, связанное с пиримидиновой и сульфониламидной группой).
Метаанализ клинических исследований подтвердил высокий уровень доказательности препаратов этого класса в лечении пациентов с атеросклерозом и заболеваниями, способствующими развитию ИБС, – артериальной гипертонии (АГ) и сахарного диабета 2 типа (СД 2 типа). Имеется большая доказательная база по эффективности статинов в первичной и вторичной профилактике ССЗ [2, 4].
По данным исследования EUROASPIRE (European Action on Secondary Prevention through Intervention to Reduce Events), назначение статинов в Европе выросло за последнее десятилетие с 32,2 до 88,8%, однако достижение целевых уровней ХС ЛПНП остается на уровне 40% [9, 12]. Если частота назначения статинов в США достигает 95% от потребности, в Европе – 55%, то в России – только 12% [8]. Таким образом, несмотря на солидную доказательную базу, терапевтический потенциал статинов сегодня используется не полностью.
Международное исследование VALIANT (valsartan in acute myocardial infarction trial), в котором приняли участие более 30 стран, показало, что в России статины назначают почти в 100 раз реже, чем за рубежом [3].
Доказана роль статинов в первичной профилактике ССЗ. Так, крупнейшее эпидемиологическое исследование MRFIT (The Multiple Risk Factor Intervention Trial), в которое были включены 361 662 мужчины в возрасте 35–57 лет, выявило основные ФР развития ИБС, пороговый уровень общего холестерина (ОХС), равный 5,2 ммоль/л, абсолютный риск развития ИБС при самых высоких значениях ОХС (в 20 раз выше, чем при наиболее низких среднепопуляционных уровнях, равных 4,7 ммоль/л). Показано, что снижение уровня ХС на каждые 10% снижает смертность от ИБС на 15%, а общую смертность – на 11% [2].
Несмотря на сравнительно широкое применение статинов в развитых странах далеко не всегда удается достичь целевых уровней липидов (прежде всего атерогенных фракций) в плазме крови. При этом частота осложнений коронарного атеросклероза зависит именно от этого ФР, снижение которого представляется существенным резервом повышения эффективности первичной и вторичной фармакотерапевтической профилактики ССЗ.
Для лучшего понимания места и роли статинов у лиц без установленного атеросклеротического заболевания E. Mills и соавт. в 2008 г. выполнили метаанализ рандомизированных клинических исследований (РКИ), в которых были прослежены общая смертность, сердечно-сосудистая смертность, фатальный и нефатальный инфаркт миокарда (ИМ) и другие коронарные события. Общая смертность, по объединенным данным 19 РКИ (n = 63 899), в группе статина оказалась на 7% ниже, чем в контроле (группа плацебо, стандартной терапии или без лечения).
Влияние статинов на сердечно-сосудистую смертность оценено в 17 РКИ (n = 59 469). Риск данной конечной точки оказался на 11% ниже в группе статина, что подтверждает вывод об эффективности и безопасности терапии статинами в целях первичной профилактики смерти от всех причин и основных сердечно-сосудистых событий, связанных с атеросклерозом.
По данным исследований, проведенных в последние годы, медикаментозная гиполипидемическая терапия статинами приводит к снижению на 25–40% коронарной смертности, на 26–36% уменьшает риск развития ишемических событий (4S, HPS, AFCAPS/TexCAPS, WOSCOPS, CARE, LIPID, MIRACL, AVERT) [4, 5]. При этом снижение коронарных осложнений у женщин (46%) было более выраженным, чем у мужчин (20%) [13].
В первичной профилактике ИБС было получено достоверное снижение сердечно-сосудистой смертности на 28 и 34% (ловастатин – AFCAPS/TexCAPS; правастатин – WOSCOPS) [3, 5]. Во вторичной профилактике ИБС, когда у больных исходный риск осложнений атеросклероза исходно выше, снижение сердечно-сосудистой смертности в исследованиях CARE, LIPID (правастатин) составило 20 и 24% соответственно [5, 12] и 42% в исследовании 4S [4, 9].
В завершившемся исследовании GREACE (GREek Atorvastatin and Coronary-heart-diseasse Evaluation) [6] впервые показана возможность снижения сердечно-сосудистой смертности на 47% при лечении аторвастатином в средней дозе 24 мг/сут в рутинной клинической практике, хотя исследование не было плацебоконтролируемым. Получены достоверные результаты по эффективности и переносимости суточных доз аторвастатина в диапазоне 20–80 мг у больных с семейной гиперхолестеринемией [9, 11].
Метаанализ, обобщивший итоги длительного лечения более 90 тыс. пациентов, был опубликован в октябре 2005 г. в журнале Lancet [1]. По результатам 14 лучших многоцентровых плацебоконтролируемых исследований сделан вывод, что статины достоверно снижают риск общей (на 12%) и коронарной (на 19%) смерти, достоверно уменьшают риск острого инфаркта миокарда (ИМ) (на 26%) и реваскуляризаций (на 24%), одновременно достоверно ограничивают риск цереброваскулярных осложнений (инсультов – на 17%, причем ишемических – на 19%), не увеличивают риска смерти от несердечных причин и рака.
Кроме того, описано много дополнительных «нелипидных» эффектов статинов, имеющих самостоятельное значение. В первую очередь это благоприятное влияние на функцию эндотелия и медиаторы воспаления, антитромботическое и антипролиферативное действие [7].
Сегодня наибольшее внимание привлекает противовоспалительное действие статинов. Уровень С-реактивного белка (СРБ) в данном случае служит важным индикатором активности воспалительного процесса как в стенке сосуда, так и в сформировавшейся атеросклеротической бляшке. Нестабильности атеромы обязательно сопутствует воспаление с активным выделением цитокинов, медиаторов воспаления, интерлейкинов, что в совокупности с изменением липидного ядра, нарушением целостности фиброзной оболочки бляшки, склонностью к тромбообразованию приводит к атеротромбозу и развитию жизнеугрожающих событий. Во многих клинических исследованиях показано, что снижение уровня СРБ под воздействием лечения статинами уменьшает риск сердечно-сосудистой заболеваемости и смертности. Появились сообщения о клинической эффективности статинов при демиелинизирующих заболеваниях нервной системы, ревматоидном артрите, сахарном диабете, который рассматривается в качестве самостоятельного показания к постоянному приему статинов.
Наибольший интерес представляют статины последнего поколения, к которым относится розувастатин. Розувастатин – относительно новый, полностью синтетический ингибитор, который способен ингибировать более чем на 90% активность ГМГ-КоА-редуктазы, циркулирующей в крови [3]. Основной мишенью розувастатина является печень, где осуществляется синтез холестерина и катаболизм ЛПНП. Молекулы розувастатина более гидрофильны, чем молекулы большинства других статинов, высокоселективны к мембранам гепатоцитов и оказывают более выраженное ингибирующее влияние на синтез ХС ЛПНП и холестерин липопротеидов очень низкой плотности (ХС ЛПОНП), чем другие статины.
Препарат быстро всасывается из кишечника, пища снижает скорость всасывания препарата. Биодоступность розувастатина при пероральном приеме составляет примерно 20%, что выше, чем у ловастатина и симвастатина, и примерно соответствует таковой у права-, флува- и аторвастатина. Максимальная концентрация розувастатина в плазме достигается через 3–5 ч после приема, период его полувыведения составляет 18–20 ч, связь с белками плазмы – 88%, причем у других статинов этот показатель превышает 95%, за исключением правастатина (~50%). Максимальный терапевтический эффект розувастатина развивается в среднем к 4-й неделе, после чего остается постоянным.
Розувастатин снижает уровень общего ХС, ХС ЛПНП, ТГ, повышает уровень ХС ЛПВП, а также снижает уровень аполипопротеина В (Апо-В), ХС неЛПВП, ХС ЛПОНП, ТГ ЛПОНП и увеличивает уровень аполипротеина А-I (АпоА-I).
В отличие от остальных статинов розувастатин минимально взаимодействует с ферментами системы цитохрома Р450, в связи с чем вероятность его взаимодействия со многими лекарственными препаратами небольшая. До 90% принятого препарата выделяется в неизмененном виде с калом, около 10% – с мочой. Метаболизируется лишь 10% розувастатина, его главный метаболит N-десметилрозувастатин примерно в 2 раза менее активен, чем основное вещество.
Одной из главных особенностей розувастатина следует считать его высокую гиполипидемическую эффективность уже в начальной суточной дозе (10 мг/сут), которая возрастает с повышением дозы до максимальной. Установлено, что в дозе 10 мг/сут розувастатин снижает уровень ХС ЛПНП на 47–52% от исходного, а при назначении максимальной разрешенной дозы (40 мг/сут) – на 63% [3].
Данные показатели приобретают особое значение с учетом результатов нескольких отечественных клинических исследований по оценке среднестатистического режима дозирования статинов в рутинной практике (в том числе данные клинического исследования ПОРА). Выявленная среднесуточная доза статинов колебалась от 12 до 17 мг, при этом целевые уровни были достигнуты в среднем менее чем в 30% случаев [3, 7]. У 80% пациентов с гиперхолестеринемией IIa и IIb типа (средний исходный уровень ХС ЛПНП около 4,8 ммоль/л) на фоне приема розувастатина в дозе 10 мг уровень ХС ЛПНП достигает значений менее 3,0 ммоль/л.
Для изучения клинических эффектов приема разных доз розувастатина была проведена крупномасштабная исследовательская программа GALAXY. В эту программу вошли 17 крупных испытаний с участием нескольких десятков тысяч пациентов (исследования STELLAR, MERCURY-1, MERCURY-2, COMETS, PULSAR, POLARIS, ORION, ASTEROID и METEOR, CORONA и AURORA). В названных исследованиях всесторонне изучались влияние розувастатина на течение атеросклероза, возможности первичной и вторичной профилактики ССЗ и их осложнений.
В рандомизированное плацебоконтролируемое исследование JUPITER (Justification for the Use of statins in Primary prevention: an Intervention Trial Evaluating Rosuvastatin) всего было включено 17 800 пациентов с близким к норме уровнем ХС ЛПНП, однако входящих в группу риска развития ССЗ в связи с возрастом и повышенным уровнем СРБ. Показано, что розувастатин на 44% снижает риск развития ССЗ у всех групп пациентов в сравнении с плацебо. Выявлено сокращение риска по всем компонентам первичной конечной точки, которая включала сердечный приступ, инсульт, смерть и артериальную реваскуляризацию. В исследовании JUPITER не зарегистрировано увеличения частоты геморрагических инсультов на фоне приема розувастатина, а риск ишемических инсультов достоверно снизился. Так, если под действием статинов удается снизить уровень ЛПНП до величины < 1,8, а СРБ до < 2 мг/л, такие больные выживают существенно лучше, чем те, у кого целевые уровни не достигнуты. При этом настоящее утверждение справедливо как для больных с ИБС, в том числе при остром коронарном синдроме (исследование PROVE-IT), так и для первичной профилактики (исследование JUPITER). У относительно здоровых людей с повышенным уровнем СРБ назначение активного статина приводит не только к снижению риска ИМ или инсульта, но и к уменьшению частоты тромбоэмболических осложнений и смертности от онкологических заболеваний.
Результаты исследования CORONA (COntrolled ROsuvastatin multiNAtional trial in heart failure) показали, что применение розувастатина в противоположность плацебо приводило к уменьшению числа госпитализаций в связи с осложнениями ССЗ, а также к эффективному снижению концентрации ХС ЛПНП и высокочувствительного СРБ в крови. Изучение эффективности и дозозависимых эффектов статинов позволяет ранжировать препараты этого класса. Так, при использовании одних и тех же доз эффективность снижения ХС ЛПНП при применении розувастатина выше в 1,5–2 раза таковой при приеме аторвастатина, в 4 раза – при приеме симвастатина, в 8 раз – при приеме правастатина и ловастатина. Поскольку уровень ХС ЛПНП при терапии рассматривается в качестве «суррогатной» точки для будущего снижения риска сердечно-сосудистых осложнений, от лечения розувастатином можно ожидать большего клинического эффекта (табл. 1).
Безусловно, при выборе препаратов важно учитывать их переносимость и безопасность. Имеющиеся данные свидетельствуют о хорошей переносимости всех зарегистрированных статинов (в том числе розувастатина) в рекомендованных терапевтических дозах. Случаев фатального рабдомиолиза при лечении розувастатином не отмечено [4, 6]. По современным данным, на 1 млн назначений всех статинов приходится 0,15 летального случая, обусловленного рабдомиолизом. Миотоксическое действие статинов зависит от концентрации препарата в крови и связано с состояниями, повышающими ее.
Что касается протеинурии и гематурии, они наблюдались лишь у небольшого числа пациентов и были транзиторными. При длительном применении розувастатина (в течение 3,8 года) более чем у 10 тыс. пациентов функция почек не ухудшалась, а в ряде случаев имела тенденцию к улучшению [1, 8]. Необходимо также отметить, что при назначении розувастатина у большинства пациентов нет необходимости в титровании дозы, что способствует повышению приверженности лечению. Повышение уровня печеночных ферментов – наиболее частый побочный эффект статинов – наблюдается в 0,5–2% случаев и зависит от дозы препарата. Других признаков гепатотоксичности на фоне лечения статинами не зарегистрировано.
У больных гепатитом С и В с повышенным уровнем трансаминаз назначение статинов не ухудшает течение заболевания. Лечение гиперлипидемии у больных с жировым гепатозом может даже уменьшить уровень трансаминаз в крови.
Частота побочных эффектов розувастатина сравнима с таковой у других статинов. Сообщается, что наиболее частыми побочными эффектами (частота – 5%), согласно данным контролируемых исследований, были фарингит (12,2%), боль (6,7%), головная боль (6,6%), синдром, подобный простуде (5,3%), и миалгия (5,1%). Все случаи миопатии развивались у пациентов, которые получали розувастатин в дозе 80 мг/сут, а повышение уровня креатинфосфокиназы регрессировало после отмены препарата.
Безопасность и переносимость розувастатина оценивали по данным лечения 16 876 пациентов, которые в рамках мультинациональной программы получали препарат в дозе 5–40 мг/сут. Побочные эффекты встречались у 52,1% пациентов на фоне розувастатина и у 51,8% – на фоне плацебо. Во всех сравнительных контролируемых исследованиях профиль безопасности розувастатина в дозе 5–40 мг был аналогичным таковому у других статинов (аторвастатин 10–80 мг, симвастатин 10–80 мг, правастатин 10–40 мг).
Ряд лекарств существенно увеличивают риск осложнений. Это фибраты (особенно гемфиброзил), никотиновая кислота, циклоспорин, противогрибковые препараты (азолы), антибиотики (макролиды), верапамил, амиодарон.
В условиях экономической доступности длительное применение статинов представляется рентабельным методом первичной и вторичной профилактики ССЗ, если учесть частоту госпитализаций в связи с ССЗ, стоимость дорогостоящих процедур, экономические потери от снижения трудоспособности и ее утраты [3, 14].
В настоящее время активно рекомендуется назначать статины в максимальных дозах, однако при этом лечение становится настолько дорогим, что даже в развитых странах такой подход не используется повсеместно.
Основой для анализа послужили результаты сравнительного исследования STELLAR (Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin), в которое было включено 2268 пациентов с первичной гиперхолестеринемией и уровнем ХС ЛПНП в пределах 160–250 мг/дл [10]. Целевые уровни ХС ЛПНП соответствовали рекомендациям экспертов Национальной образовательной программы по холестерину (NCEP АТР III) [11]. После 6-недельной терапии розувастатином в дозе 10–80 мг уровень ХС ЛПНП достоверно снизился (р ≤ 0,001), при этом розувастатин по эффективности превосходил на 26% правастатин (10–40 мг), на 18% – симвастатин (10–80 мг), на 8,2% – аторвастатин (10–80 мг). Установлено также, что препарат способен достоверно повышать уровень ХС ЛПВП плазмы и по этому эффекту превосходит аторвастатин [5]. Применение розувастатина привело не только к увеличению клинической эффективности, но и к снижению стоимости лечения, то есть препарат был доминирующей альтернативой. Стоимость поддерживающей дозы у розувастатина была минимальной (табл. 2).
В клиническом исследовании ПОРА у пациентов, страдающих ИБС/СД 2 типа (n = 531), в качестве причины отказа от приема статинов в 32% случаев отмечена высокая стоимость, а в 33% – боязнь побочных эффектов.
С учетом современных требований к генерическим препаратам по подтверждению их фармацевтической и терапевтической эквивалентности оригинальному препарату, а также положительного фармакоэкономического профиля, широко обсуждаются возможности применения в клинической практике воспроизведенных препаратов – лекарственных средств (ЛС), поступивших в обращение по истечении срока действия патентных прав на оригинальные ЛС [6, 7, 13].
Общепринято, что генерики, повторяющие оригинальные или инновационные ЛС, существенно (в связи с отсутствием затрат на научные исследования, экономией на производстве, маркетинговых технологиях) дешевле и доступнее для здравоохранения [3, 5]. При этом активно дискутируется вопрос о точности воспроизведения генериком фармакологических и терапевтических свойств, а также профиля безопасности референтного оригинального ЛС.
Исследование биоэквивалентности (БЭ) в настоящее время – ключевой метод клинических исследований, определяющий возможность регистрации воспроизведенного ЛС в США, Канаде, Японии, странах Евросоюза [9, 11]. Во всем мире регистрация генериков проводится на основании данных о БЭ. Необходимым условием регистрации является сопоставимость оригинального и воспроизведенного ЛС по эффективности и безопасности [12, 13]. Известно, что оценка био- или фаpмакокинетической эквивалентности ЛС – основной вид медико-биологического контроля качества генерических препаратов [10]. Два лекарственных препарата являются биоэквивалентными, если они обеспечивают одинаковую биодоступность ЛС.
В России появился первый генерик розувастатина – Мертенил (ЗАО «Гедеон Рихтер-РУС»). Мертенил® (розувастатин) – статин нового поколения. Это гиполипидемический препарат с хорошим профилем безопасности для лечения и профилактики атеросклероза. Проведено сравнительное изучение БЭ и фармакокинетики Мертенила® и оригинального препарата (Крестор, «АстраЗенека»). Исследование показало, что они эквивалентны по фармакокинетическим показателям и имеют одинаковую биодоступность.
Препарат Мертенил® зарегистрирован в РФ для применения у пациентов с первичной гиперхолестеринемией (тип IIа) или смешанной гиперхолестеринемией (тип IIb) в качестве дополнения к диете, когда диета и другие немедикаментозные методы лечения недостаточны, а также у пациентов с семейной гомозиготной гиперхолестеринемией. Мертенил® является единственным в России розувастатином с полным спектром дозировок (5, 10, 20 и 40 мг), что облегчает оптимальный подбор терапии для разных категорий пациентов с атеросклерозом и нарушениями липидного обмена. Препарат рекомендован к применению в суточных дозах 5–40 мг. Стартовая доза – 5–10 мг/сут.
Доступность по цене имеет большое значение для долгосрочного применения препарата широкими слоями населения. Назначение Мертенила® в эквивалентной дозе позволяет снизить стоимость проводимой фармакотерапии более чем на 40% по сравнению с применением оригинального препарата.
Таким образом, в лечении гиперлипидемий в последние годы достигнут большой прогресс. Совершен ряд фундаментальных открытий, позволивших разработать принципиально новые фармакологические подходы к лечению гиперлипидемий и атеросклероза. Существенно расширяются показания к длительному приему статинов. Появились новые перспективные препараты. К ним относится и розувастатин, который в ходе крупных испытаний уже в начальных (стартовых) дозах продемонстрировал значимое снижение атерогенных параметров липидного спектра плазмы крови и хорошую переносимость. Появление препарата Мертенил®, генерического препарата с доказанной эффективностью и безопасностью, наличием положительного фармакоэкономического профиля, позволит увеличить число пациентов, принимающих статины, и проводить эффективную первичную и вторичную профилактику сердечно-сосудистых заболеваний.
NB
Гиполипидемический препарат Мертенил® (розувастатин) представляет собой селективный и конкурентный ингибитор ГМГ-КоА-редуктазы, фермента, превращающего 3-гидрокси-3-метилглютарилкоэнзим А в мевалонат, который является предшественником холестерина. Перед началом лечения пациенту следует соблюдать стандартную диету с применением продуктов с низким содержанием холестерина, которая должна быть продолжена и во время всего периода лечения. Дозы препарата следует подбирать индивидуально в соответствии с целью проводимого лечения и терапевтическим ответом пациента, учитывая современные общепринятые рекомендации по целевым уровням липидов.
Препарат принимают внутрь, в любое время суток, независимо от приема пищи. Рекомендуемая начальная доза препарата составляет 5 мг или 10 мг 1 раз/cут. Терапевтический эффект может быть достигнут в течение одной недели после начала лечения, через 2 недели достигается 90% от максимально возможного эффекта. Обычно максимально возможный терапевтический эффект достигается через 4 недели и поддерживается при дальнейшем приеме препарата.
Гиполипидемический препарат Мертенил® (розувастатин) представляет собой селективный и конкурентный ингибитор ГМГ-КоА-редуктазы, фермента, превращающего 3-гидрокси-3-метилглютарилкоэнзим А в мевалонат, который является предшественником холестерина. Перед началом лечения пациенту следует соблюдать стандартную диету с применением продуктов с низким содержанием холестерина, которая должна быть продолжена и во время всего периода лечения. Дозы препарата следует подбирать индивидуально в соответствии с целью проводимого лечения и терапевтическим ответом пациента, учитывая современные общепринятые рекомендации по целевым уровням липидов.
Препарат принимают внутрь, в любое время суток, независимо от приема пищи. Рекомендуемая начальная доза препарата составляет 5 мг или 10 мг 1 раз/cут. Терапевтический эффект может быть достигнут в течение одной недели после начала лечения, через 2 недели достигается 90% от максимально возможного эффекта. Обычно максимально возможный терапевтический эффект достигается через 4 недели и поддерживается при дальнейшем приеме препарата.
1. Затейщиков Д.А. Розувастатин: новые возможности борьбы с атеросклерозом // Фарматека. 2004. № 19–20. С. 25–30.
2. Маколкин В.И. Оптимизация лечения стабильной стенокардии // Consilium Medicum. 2007. Т. 9. № 5. С. 44–48.
3. Шальнова С.А., Деев А.Д., Оганов Р.Г. Факторы, влияющие на смертность от сердечно-сосудистых заболеваний в российской популяции // Кардиоваскулярная терапия и профилактика. 2005. Т. 4. № 1. С. 4–8.
4. Baigent C., Keech A., Kearney P.M., Blackwell L., Buck G., Pollicino C., Kirby A., Sourjina T., Peto R., Collins R., Simes R.; Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90 056 participants in 14 randomised trials of statins // Lancet. 2005. Vol. 366. № 9493. P. 1267–1278.
5. Glynn R.J., Danielson E., Fonseca F.A., Genest J., Gotto A.M. Jr., Kastelein J.J., Koenig W., Libby P., Lorenzatti A.J., MacFadyen J.G., Nordestgaard B.G., Shepherd J., Willerson J.T., Ridker P.M. A randomized trial of rosuvastatin in the prevention of venous thromboembolism // N. Engl. J. Med. 2009. Vol. 360. № 18. P. 1851–1861.
6. Jones P.H., Davidson M.H., Stein E.A., Bays H.E., McKenney J.M., Miller E., Cain V.A., Blasetto J.W.; STELLAR Study Group. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR Trial) // Am. J. Cardiol. 2003. Vol. 92. № 2. P. 152–160.
7. Нeart diseases and stroke statistics – 2010 update. A report from the American Heart Association // Circulation. 2010. Vol. 121. № 7. P. e46–e215.
8. Michos E.D., Blumenthal R.S. Prevalence of low low-density lipoprotein cholesterol with elevated high sensitivity С-reactive protein in the U.S.: Implications of the JUPITER (Justification for the Use of statins in Primary prevention: an Intervention Trial Evaluating Rosuvastatin) Study // J. Am. Coll. Cardiol. 2009. Vol. 53. № 11. P. 931–935.
9. Nissen S.E., Tuzcu E.M., Schoenhagen P., Brown B.G., Ganz P., Vogel R.A., Crowe T., Howard G., Cooper C.J., Brodie B., Grines C.L., DeMaria A.N.; REVERSAL Investigators. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis. a randomized controlled trial // JAMA. 2004. Vol. 291. № 9. P. 1071–1080.
10. Olsson G.O. Safety and efficacy of rosuvastatin // Lancet. 2004. Vol. 364. № 9429. P. 135.
11. Ridker P.M., Danielson E., Fonseca F.A., Genest J., Gotto A.M. Jr., Kastelein J.J., Koenig W., Libby P., Lorenzatti A.J., Macfadyen J.G., Nordestgaard B.G., Shepherd J., Willerson J.T., Glynn R.J.; JUPITER Trial Study Group. Reduction in C-reactive protein and LDL cholesterol and cardiovascular event rates after initiation of rosuvastatin: a prospective study of the JUPITER trial // Lancet. 2009. Vol. 373. № 9670. P. 1175–1182.
12. Schuster H. Rosuvastatin – a highly effective new 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor: review of clinical trial data at 10-40 mg doses in dyslipidemic patients // Cardiology. 2003. Vol. 99. № 3. P. 126–139.
13. Rosamond W., Flegal K., Furie K., Go A., Greenlund K., Haase N., Hailpern S.M., Ho M., Howard V., Kissela B., Kittner S., Lloyd-Jones D., McDermott M., Meigs J., Moy C., Nichol G., O'Donnell C., Roger V., Sorlie P., Steinberger J., Thom T., Wilson M., Hong Y.; American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics – 2008 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee // Circulation. 2008. Vol. 117. № 4. P. e25–e146.
14. Vidt D.G., Cressman M.D., Harris S., Pears J.S., Hutchinson H.G. Rosuvastatin-induced arrest in progression of renal disease // Cardiology. 2004. Vol. 102. № 1. P. 52–60.
Новости на тему
13.02.2025
14.05.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье приводятся данные ряда метаанализов рандомизированных контролируемых исследований, в которых изучались роль статинов в первичной и вторичной профилактике атеросклероза, эффективность и безопасность генерических препаратов.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
