Исследование применения готовой комбинации инсулинов деглудек и аспарт при сахарном диабете (SMART) в Индии: комментарий к основным результатам и выводам*
- Аннотация
- Статья
- Ссылки
- English
Фиксированная комбинация аналогов инсулинов нового поколения с улучшенными фармакокинетическими и фармакодинамическими показателями – базального инсулина деглудек и прандиального инсулина аспарт продемонстрировала ряд преимуществ в рандомизированных клинических исследованиях, однако опыт ее применения в реальной клинической практике пока находится на стадии накопления.
В статье представлены данные открытого пострегистрационного наблюдательного исследования более тысячи пациентов в Индии.
Целью данного исследования была оценка безопасности применения комбинации инсулина деглудек/инсулина аспарт (ИДегАсп) у взрослых пациентов с сахарным диабетом (СД) в условиях рутинной клинической практики в Индии. Пациенты, соответствующие критериям включения, получали ИДегАсп по меньшей мере 12 месяцев. Сбор данных проводили исходно и через три, шесть и 12 месяцев. В исследование включили 1029 взрослых с СД, из них 671 (65,2%) мужчина и 358 (34,8%) женщин. Средний возраст участников исследования составлял 55,0 ± 12,2 года, а средняя продолжительность сахарного диабета – 10,8 ± 7,4 года. В период последующего наблюдения выявлены 30 нежелательных явлений (НЯ) у 23 (2,2%) пациентов. В подавляющем большинстве случаев эти НЯ не были связаны с применением ИДегАсп. На исходном уровне наблюдались 176 подтвержденных эпизодов гипогликемии у 67 (6,7%) пациентов на фоне предшествующей терапии. После 12 месяцев применения ИДегАсп были отмечены 11 подтвержденных эпизодов гипогликемии у 11 (1,1%) пациентов. Эпизодов тяжелой гипогликемии выявлено не было. Средний уровень гликированного гемоглобина снизился с 9,5 ± 1,8% исходно до 7,7 ± 1,1% через 12 месяцев. Данное исследование продемонстрировало безопасность ИДегАсп у пациентов с сахарным диабетом в течение одного года применения в стандартной клинической практике.
Фиксированная комбинация аналогов инсулинов нового поколения с улучшенными фармакокинетическими и фармакодинамическими показателями – базального инсулина деглудек и прандиального инсулина аспарт продемонстрировала ряд преимуществ в рандомизированных клинических исследованиях, однако опыт ее применения в реальной клинической практике пока находится на стадии накопления.
В статье представлены данные открытого пострегистрационного наблюдательного исследования более тысячи пациентов в Индии.
Целью данного исследования была оценка безопасности применения комбинации инсулина деглудек/инсулина аспарт (ИДегАсп) у взрослых пациентов с сахарным диабетом (СД) в условиях рутинной клинической практики в Индии. Пациенты, соответствующие критериям включения, получали ИДегАсп по меньшей мере 12 месяцев. Сбор данных проводили исходно и через три, шесть и 12 месяцев. В исследование включили 1029 взрослых с СД, из них 671 (65,2%) мужчина и 358 (34,8%) женщин. Средний возраст участников исследования составлял 55,0 ± 12,2 года, а средняя продолжительность сахарного диабета – 10,8 ± 7,4 года. В период последующего наблюдения выявлены 30 нежелательных явлений (НЯ) у 23 (2,2%) пациентов. В подавляющем большинстве случаев эти НЯ не были связаны с применением ИДегАсп. На исходном уровне наблюдались 176 подтвержденных эпизодов гипогликемии у 67 (6,7%) пациентов на фоне предшествующей терапии. После 12 месяцев применения ИДегАсп были отмечены 11 подтвержденных эпизодов гипогликемии у 11 (1,1%) пациентов. Эпизодов тяжелой гипогликемии выявлено не было. Средний уровень гликированного гемоглобина снизился с 9,5 ± 1,8% исходно до 7,7 ± 1,1% через 12 месяцев. Данное исследование продемонстрировало безопасность ИДегАсп у пациентов с сахарным диабетом в течение одного года применения в стандартной клинической практике.





Распространенность сахарного диабета (СД) неуклонно возрастает, опережая все прогнозы. За последние десять лет численность больных СД в мире увеличилась более чем в два раза и превысила 537 млн человек к концу 2021 г. Согласно прогнозам Международной диабетической федерации, к 2030 г. число больных достигнет 643 млн, а к 2045 г. – 783 млн [1].
В Российской Федерации так же, как и в большинстве стран мира, отмечается рост распространенности СД. По данным Федерального регистра СД, в России на 1 января 2023 г. на диспансерном учете состояло 4 962 762 человека (3,42% населения), из них 4 581 990 (92,3%) – с СД 2 типа. Однако эти данные недооценивают реальное количество пациентов, поскольку учитывают только зарегистрированные случаи заболевания. Согласно результатам российского эпидемиологического исследования NATION, диагностируется лишь 54% случаев СД 2 типа, поэтому реальная численность пациентов может составлять порядка 10 млн (около 7% населения), что представляет чрезвычайную угрозу для долгосрочных перспектив как здоровья нации, так и организации системы здравоохранения [1].
Самыми опасными последствиями СД признаны его системные сосудистые осложнения – нефропатия, ретинопатия, поражение магистральных сосудов сердца, головного мозга, артерий нижних конечностей. Именно эти осложнения являются основной причиной инвалидизации и смерти больных СД, что приобретает гигантские масштабы в условиях глобальной эпидемии [1].
Инсулин – основа терапии СД 1 типа. В определенный момент он также может быть необходим многим пациентам с СД 2 типа. Такая необходимость может иметь место как при установлении диагноза и выраженной декомпенсации заболевания, так и при невозможности обеспечить гликемический контроль с помощью неинсулиновых сахароснижающих препаратов уже в течение заболевания [2, 3].
В статье представлены результаты исследования реальной клинической практики в Индии, оценившего безопасность применения фиксированной комбинации инсулинов деглудек (70%) и аспарт (30%) (ИДегАсп) у взрослых пациентов с СД 2 типа. Данное пострегистрационное наблюдательное исследование применения ИДегАсп в Индии, названное «Исследование применения препарата Райзодег® при сахарном диабете» (Study of MAnagement of diabetes with Ryzodeg® Treatment (SMART)), было выполнено в связи с регуляторными требованиями. Его целью была оценка безопасности применения ИДегАсп в условиях стандартной реальной клинической практики.
Безусловно, исследование представляет особый интерес вследствие крупной выборки (более 1 тыс. пациентов) и достаточно длительного периода наблюдения (12 месяцев). Ценность для отечественного медицинского сообщества также добавляют общие для России и Индии факторы. В частности, исследование выполнено в одной из крупнейших стран мира (седьмое место по площади) с неоднородной доступностью медицинской помощи, высокой распространенностью СД 2 типа (более 10% населения) и традицией употребления богатой углеводами пищи.
В Индии, так же как в Российской Федерации, в национальных клинических рекомендациях отмечено, что при невозможности достичь целевых показателей гликемического контроля, несмотря на применение комбинации пероральных сахароснижающих препаратов, следует рассмотреть возможность начала инсулинотерапии с применением комбинированного препарата/готовой смеси или базального инсулина один раз в сутки [4]. Базальный инсулин прежде всего позволяет контролировать уровень глюкозы плазмы натощак (ГПН), однако показатели гликированного гемоглобина (HbA1c) по-прежнему могут превышать целевое значение из-за неконтролируемых колебаний уровня постпрандиальной глюкозы в плазме (ППГ) [5, 6]. Высокие уровни ППГ – существенная проблема при лечении пациентов с СД, в том числе в связи с обильным потреблением богатой углеводами пищи [7, 8]. Постпрандиальную гипергликемию можно корректировать с помощью прандиального инсулина [9]. В то же время потребность в дополнительных инъекциях может снизить приверженность лечению [10].
Все перечисленное делает привлекательным использование ИДегАсп, состоящего из 70% инсулина деглудек и 30% инсулина аспарт и обеспечивающего контроль как глюкозы натощак, так и постпрандиальной глюкозы, а также очень удобного в применении.
Следует отметить, что, переводя пациентов на ИДегАсп, врачи называли разнообразные причины этого, например коррекция уровня HbA1c, гликемии натощак и постпрандиальной гликемии, снижение риска гипогликемии, потребность в гибком графике инъекций, неудовлетворенность пациента предшествующей терапией, побочные эффекты предшествующей терапии, улучшение контроля массы тела, улучшение функции β-клеток. Это свидетельствует о понимании того, что препарат может решить многие проблемы при СД 2 типа.
Материал и методы
Участники исследования
В исследование включали пациентов мужского и женского пола с СД в возрасте старше 18 лет, у которых планировалось начало терапии ИДегАсп на основании клинической оценки исследователя в стандартной клинической практике. Пациентов, ранее получавших терапию ИДегАсп или участвующих в другом исследовании, исключали из данного исследования.
Дизайн исследования
Данное многоцентровое проспективное несравнительное пострегистрационное наблюдательное исследование (NCT02230618; CTRI/2015/12/006442) проводили в 40 исследовательских центрах в Индии, в соответствии с принципами Хельсинкской декларации и рекомендациями по надлежащей клинической практике Международной конференции по гармонизации.
На исходном уровне (визит 1) регистрировали демографические данные, анамнез (течение СД, предшествующая терапия СД, эпизоды гипогликемии на фоне предшествующей терапии и причина начала терапии ИДегАсп), сведения о препаратах сопутствующей терапии и данные о росте и массе тела. Пациентам назначали ИДегАсп, представленный на фармацевтическом рынке как Райзодег® и доступный по рецепту. Решение о начале терапии, изменении дозы и интенсификации терапии ИДегАсп, а также его дозе, сроках и частоте применения принимал исследователь в соответствии с инструкцией по применению препарата. Данные по безопасности, включая эпизоды гипогликемии в период с последнего визита, регистрировали через три месяца ± две недели (визит 2), шесть месяцев ± две недели (визит 3) и 12 месяцев ± две недели (визит 4). Данные об эпизодах гипогликемии на фоне предшествующей терапии регистрировали на основании сообщений пациентов о подтвержденных (уровень глюкозы < 3,1 ммоль/л (56 мг%)) или тяжелых, требующих посторонней помощи эпизодах гипогликемии в первые четыре недели до начала терапии ИДегАсп. Поскольку исследование было неинтервенционным, тщательно структурированный самостоятельный мониторинг уровня глюкозы в крови не требовался. Данные об эпизодах гипогликемии в течение 12 месяцев терапии ИДегАсп регистрировали на основании сообщений пациентов о подтвержденных или тяжелых эпизодах гипогликемии на визитах в рамках последующего наблюдения.
Оценка безопасности
В течение года врачи оценивали и квалифицировали сообщения пациентов о проблемах с безопасностью следующим образом: нежелательные явления (НЯ), серьезные НЯ, нежелательные реакции (НР), серьезные НР и подтвержденные или тяжелые эпизоды гипогликемии. Кроме того, регистрировали сведения о причинно-следственной связи (вероятная, возможная или маловероятная), степени тяжести (легкая, умеренная или тяжелая) и исходе (выздоровление/разрешение, в процессе выздоровления/разрешения, выздоровление/разрешение с последствиями, без выздоровления/разрешения, смертельный исход или неизвестно) НЯ/НР.
Оценка сахароснижающей эффективности
Конечные точки включали среднее изменение показателей HbA1c, ГПН и ППГ относительно исходного уровня через три, шесть и 12 месяцев в общей популяции. Дополнительный анализ включал среднее изменение показателей HbA1c, ГПН и ППГ относительно исходного уровня через три, шесть и 12 месяцев со стратификацией по предшествующей терапии (пероральная противодиабетическая терапия (ППДТ), при этом препараты группы агонистов рецепторов глюкагоноподобного пептида 1 получали лишь 0,5% выборки, или инсулин). Поскольку исследование было неинтервенционным, для оценки регистрировали последние значения уровней глюкозы натощак и постпрандиальной глюкозы в разные контрольные моменты времени либо с помощью лабораторного анализа, либо с помощью глюкометра.
Статистический анализ
Статистический анализ данных проводили с использованием программного обеспечения Statistical Analysis Software (версия 9.4). Для оценки изменений уровней HbA1c, ГПН и ППГ и подтвержденных эпизодов гипогликемии использовали парный двусторонний критерий Стьюдента с уровнем значимости 5%.
Результаты
Распределение пациентов и их исходные характеристики
В исследование было включено 1029 пациентов с СД в возрасте старше 18 лет, у которых планировалось начало терапии ИДегАсп на основании клинической оценки исследователя в стандартной клинической практике. Пациентов, ранее получавших терапию ИДегАсп или участвующих в другом исследовании, исключали из данного исследования (табл. 1).
Среди всех участников исследования было 65,2% мужчин. Средний возраст пациентов составлял 55,0 ± 12,2 года, а средняя продолжительность СД – 10,8 ± 7,4 года. Следует принять во внимание особенности популяции. Прежде всего это иные, чем у европейцев, антропометрические показатели: относительно небольшая масса тела (73,2 ± 12,5 кг) при большой окружности талии (95,2 ± 11,6 см). Окружность талии является показателем абдоминального ожирения. Для азиатов таковой составляет более 90 см у мужчин и более 80 см у женщин, для европейцев – более 102 см у мужчин и более 88 см у женщин. Микро- и макрососудистые осложнения регистрировали на исходном уровне (табл. 2). Наиболее частой причиной начала терапии ИДегАсп, упоминаемой лечащими врачами, была коррекция уровня HbA1c – 895 (87,0%) случаев (см. табл. 2). Пациенты могли начать терапию ИДегАсп по нескольким причинам.
Безопасность и переносимость
Нежелательные явления и нежелательные реакции. Среди 1029 пациентов у 23 (2,2%) наблюдалось 30 НЯ, у пяти (0,5%) – более одного. НЯ, наблюдавшиеся у двух пациентов и более, включали гипертермию (n = 5), утомляемость (n = 2), развитие инфекции верхних дыхательных путей (n = 2), головокружение (n = 2) и мышечный спазм (n = 2) (табл. 3). Для большинства НЯ (23 из 30 у 20 пациентов) связь с применением исследуемого препарата была маловероятной. Для пяти НЯ у трех пациентов ассоциация с применением исследуемого препарата была вероятной, для двух НЯ у двух пациентов – возможной. У двух пациентов наблюдались НЯ, приведшие к смертельному исходу. Однако оба этих НЯ не были связаны с применением исследуемого препарата (см. табл. 3).
В период исследования были зарегистрированы семь НР у пяти (0,5%) пациентов: утомляемость, головокружение, увеличение массы тела, гипергликемия, повышение аппетита и травма.
Один пациент мог сообщить о нескольких НЯ/НР.
Эпизоды гипогликемии. За весь период наблюдения тяжелые гипогликемии зарегистрированы не были, в то время как исходно, на фоне другой терапии, было отмечено 24 тяжелых эпизода гипогликемии у 17 (1,7%) пациентов. Через 12 месяцев число эпизодов подтвержденных нетяжелых гипогликемий снизилось с исходных 176 до 11 (табл. 4).
Другие нежелательные явления. Большинство иных нежелательных явлений, связанных с безопасностью, были легкой или умеренной степени тяжести, носили временный характер и не приводили к прекращению терапии исследуемым препаратом.
Прибавки массы тела отмечено не было. Через 12 месяцев средняя масса тела составила 73,5 ± 12,5 кг по сравнению с 73,2 ± 12,5 кг на исходном уровне.
Суточная доза ИДегАсп
Суточная доза ИДегАсп через 12 месяцев применения возросла незначительно по сравнению с исходной – до 22,2 ± 27,9 против 20,4 ± 10,9 ЕД соответственно (для всех пациентов – и инсулин-наивных, и с опытом).
Эффективность
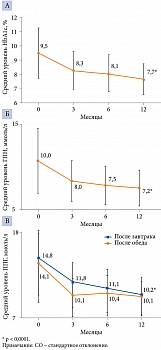
Гликированный гемоглобин. ИДегАсп продемонстрировал высокую сахароснижающую эффективность. Уже к третьему месяцу терапии уровень HbA1c снизился на 1,0 ± 1,2%, а максимальное снижение наблюдалось через 12 месяцев – на 1,7 ± 1,6%. В целом уровень HbA1c снизился с 9,5 ± 1,8% (исходно) до 7,7% ± 1,1% (через 12 месяцев) (рисунок, табл. 5). Снижение уровня HbA1c на каждом визите было статистически значимым (p < 0,0001) по сравнению с исходными значениями как в общей популяции, так и в группах пациентов, получавших ППДТ и инсулин.
Глюкоза плазмы натощак и постпрандиальная глюкоза. Было отмечено значимое снижение гликемии натощак и постпрандиальной гликемии, как после завтрака, так и после обеда. Через 12 месяцев уровень ГПН снизился с 10,0 ± 3,3 до 7,2 ± 1,8 ммоль/л (см. рисунок, табл. 5).
Снижение уровня ГПН на каждом визите было статистически значимым (p < 0,0001) по сравнению с исходными значениями как в общей популяции, так и в группах пациентов, получавших ППДТ и инсулин.
Уровень ППГ после завтрака снизился с 14,8 ± 4,3 до 10,2 ± 2,6 ммоль/л через 12 месяцев. Аналогичным образом изменился уровень ППГ после обеда – с 14,1 ± 4,7 до 10,1 ± 2,2 ммоль/л (см. рисунок). Снижение уровня ППГ после завтрака и обеда во все контрольные моменты времени было статистически значимым (p < 0,0001) по сравнению с показателями на исходном уровне.
Общий холестерин, холестерин липопротеинов высокой плотности и триглицериды. Хотя уровни общего холестерина, холестерина липопротеинов низкой плотности (ЛПНП) и триглицеридов находились исходно в пределах нормы, в процессе наблюдения было отмечено их снижение (табл. 6). Полученные различия не были статистически значимыми, однако эти данные заслуживают внимания, так как сходные результаты, но уже статистически значимые, были получены позднее на фоне применения ИДегАсп в исследовании реальной клинической практики большей длительности (два года) в Турции [11].
Обсуждение
ИДегАсп был впервые одобрен Министерством здравоохранения Японии в декабре 2012 г. [12]. Управление по контролю качества пищевых продуктов и лекарственных средств США одобрило его к применению в сентябре 2015 г. [13]. Данный препарат доступен на рынке Индии с января 2015 г. [14], а в России зарегистрирован в ноябре 2013 г. [15]. ИДегАсп обеспечивает полный (ГПН + ППГ) гликемический контроль, а также прост и удобен в применении [16–18]. Компонент базального инсулина в составе ИДегАсп обладает длительным периодом действия [19, 20].
Эффективность и безопасность ИДегАсп подтверждены результатами предшествующих исследований фаз II и III [16, 21–24]. Тем не менее, чтобы обеспечить безопасность его применения в индийской популяции, было рекомендовано выполнить пострегистрационное исследование безопасности в стандартной клинической практике. Продолжительность исследования в один год сочли достаточной для выявления любых нежелательных явлений и реакций, связанных с применением ИДегАсп.
В данном исследовании у пациентов с СД, получавших ИДегАсп в стандартной клинической практике в течение 12 месяцев, наблюдалась приемлемая переносимость лечения, а также статистически значимое снижение уровней ГПН и ППГ наряду со снижением уровня HbA1c на 1,7 ± 1,6% через 12 месяцев по группе в целом. У пациентов, ранее получавших ППДТ, уровень HbA1c снизился с 9,3 до 7,6%, у ранее получавших инсулин – с 9,9 до 8,1%. Следует обратить внимание на более высокие показатели HbA1c на исходном уровне у получавших инсулин. Своевременная оптимизация дозы и интенсификация инсулинотерапии (факторы, которые часто игнорируются) могли обеспечить более эффективный гликемический контроль. В соответствии с инструкцией по применению лечащий врач мог применять ИДегАсп один или два раза в сутки, что может объяснять улучшение уровня ППГ как после завтрака, так и после обеда. Снижение уровня ППГ после разных приемов пищи также отчасти можно объяснить улучшением уровня глюкозы до приема пищи. Основные причины начала терапии ИДегАсп, указанные врачами, включали улучшение гликемического контроля, снижение риска развития гипогликемии и гибкий график применения препарата.
НЯ, наблюдавшиеся в данном исследовании, были немногочисленными, преимущественно легкой или умеренной степени тяжести, носили временный характер и в основном не были связаны с применением исследуемого препарата. Наиболее частыми НЯ были гипертермия, утомляемость, инфекция верхних дыхательных путей, головокружение и мышечный спазм. Два серьезных НЯ, зарегистрированных в данном исследовании, привели к смертельному исходу; однако они не были связаны с применением исследуемого препарата. Подтвержденные эпизоды гипогликемии были немногочисленными. Случаи развития тяжелых эпизодов гипогликемии в период исследования отсутствовали.
В другом исследовании в условиях реальной клинической практики у 152 пациентов с СД 2 типа в Индии были зарегистрированы только пять нетяжелых эпизодов гипогликемии при средней продолжительности применения ИДегАсп 10,3 месяца [25].
В отличие от традиционных готовых смесей инсулинов при применении ИДегАсп риск развития гипогликемии статистически значимо снижался. Это может быть обусловлено отсутствием эффекта плеча (более продолжительного, нефизиологичного постпрандиального эффекта на готовых смесях) при применении ИДегАсп, а также равномерным, более предсказуемым снижением уровня глюкозы, которое обеспечивает инсулин деглудек [26].
В открытом исследовании фазы III продолжительностью 26 недель у пациентов с СД 2 типа в Японии общее количество подтвержденных эпизодов гипогликемии (134 против 190) и эпизодов ночной гипогликемии (27 против 37) было численно меньше при применении ИДегАсп один раз в сутки по сравнению с применением инсулина гларгин 100 ЕД один раз в сутки [16].
В данном исследовании инсулинотерапия с применением ИДегАсп обеспечивала статистически значимое снижение уровня HbA1c на 1,0 ± 1,2% через три месяца и 1,7 ± 1,6% через 12 месяцев. Аналогичным образом, уровни ГПН статистически значимо снижались через 12 месяцев независимо от ППДТ или инсулинотерапии на исходном уровне. Снижение уровней ППГ после завтрака и обеда через 12 месяцев также было стабильным и статистически значимым.
Результаты, полученные в данном исследовании, согласуются с результатами предшествовавшего исследования в условиях реальной клинической практики, выполненного в Индии, в котором наблюдалось снижение уровня HbA1c с 9,5 ± 1,3% (исходно) до 7,5 ± 0,4% (через 12 месяцев) [27]. В обсуждаемом нами исследовании уровень HbA1c уменьшился с 9,5 ± 1,8 до 7,7 ± 1,1% за аналогичный период. В международных клинических исследованиях снижение среднего уровня HbA1c варьируется в диапазоне 1,1–1,7% за 26 недель, что также сравнимо со снижением в обсуждаемом исследовании – на 1,7% за 52 недели [15, 20, 21, 23]. Снижение уровня ГПН в уже упомянутом наблюдательном исследовании в Индии (с 8,6 ± 1,8 до 5,7± 0,7 ммоль/л через 12 месяцев) также сопоставимо с результатами, полученными в данном исследовании. Так, через 12 месяцев ГПН уменьшилась с 10,0 ± 3,3 до 7,2 ± 1,8 ммоль/л [27].
Преимущества обсуждаемого исследования – длительный период последующего наблюдения (один год) с большим количеством пациентов в условиях стандартной клинической практики и низкая частота выбывания из исследования.
Данное наблюдательное исследование в условиях реальной клинической практики не лишено некоторых ограничений. Так, гипогликемии регистрировались на основании сообщений пациентов о подтвержденных или тяжелых эпизодах гипогликемии, в связи с чем существует вероятность, что не все эпизоды были учтены. Кроме того, протокол исследования не предусматривал группу сравнения, и показатели как безопасности, так и эффективности отражают комбинированный эффект ИДегАсп и других сопутствующих сахароснижающих средств, которые применяли пациенты. Наконец, сведения о типе СД и суточной частоте применения ИДегАсп регистрировали не для всех пациентов.
В Индии у пациентов, получавших ИДегАсп, наблюдалась приемлемая переносимость препарата. Новые сигналы о безопасности выявлены не были. Большинство НЯ были легкой или умеренной степени тяжести, носили временный характер и не приводили к прекращению терапии исследуемым препаратом. У пациентов, получавших ИДегАсп, наблюдалось улучшение гликемического контроля (уровней HbA1c, ГПН и ППГ) без ущерба для безопасности. Большинству пациентов ИДегАсп назначали для улучшения гликемического контроля, снижения риска развития гипогликемии и обеспечения гибкого графика инъекций.
По результатам исследования в целом, бесспорно, можно сделать общий вывод о том, что у пациентов, получавших ИДегАсп, наблюдалось значимое улучшение гликемического контроля (уровни HbA1c, ГПН и ППГ) без ущерба для безопасности. Кроме того, приемлемая переносимость данного препарата и нейтральное влияние на массу тела обеспечивают дополнительные патогенетически значимые преимущества для пациентов с СД.
Вывод
В проспективном неинтервенционном исследовании применения фиксированной комбинации инсулинов деглудек и аспарт при сахарном диабете (SMART) в Индии были подтверждены долгосрочные безопасность и эффективность ИДегАсп в условиях стандартной клинической практики.
Ye.V. Surkova, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Yelena V. Surkova, elenasurkova@mail.ru
Diabetes mellitus (DM) is a disease that determines the high frequency of systemic micro- and macrovascular complications. Achieving high-quality glycemic control along with the absence of adverse events, primarily hypoglycemia, is the basis for improving the prognosis of the disease. Despite the emergence of new classes of non-insulin hypoglycemic drugs, type 2 diabetes often requires resorting to insulin therapy. Therefore, the emergence of new effective and safe insulin preparations is extremely important for real clinical practice.
A fixed combination of new generation insulin analogues with improved pharmacokinetic and pharmacodynamic parameters – basal insulin degludec and prandial insulin aspart has demonstrated a number of advantages in randomized clinical trials, however, the experience of its application in real clinical practice is still at the accumulation stage.
The article presents data from an open post-registration observational study of more than a thousand patients in India.
The aim of this study was to evaluate the safety of the use of the combination of insulin degludec/insulin aspart (IDegAsp) in adult patients with diabetes mellitus (DM) in routine clinical practice in India. Patients who met the inclusion criteria received IDegAsp for at least 12 months. Data collection was carried out initially and after 3, 6 and 12 months. The study included 1,029 adults with diabetes, including 671 (65.2%) men and 358 (34.8%) women. The average age of the study participants was 55.0 ± 12.2 years, and the average duration of diabetes mellitus was 10.8 ± 7.4 years. During the follow-up period, 30 adverse events (AE)were detected in 23 (2.2%) patients. In the vast majority of cases, these AE were not associated with the use of IDegAsp. At baseline, 176 confirmed episodes of hypoglycemia were observed in 67 (6.7%) patients on the background of previous therapy. After 12 months of using IDegAsp, 11 confirmed episodes of hypoglycemia were observed in 11 (1.1%) patients. No episodes of severe hypoglycemia were detected. The average level of glycated hemoglobin decreased from 9.5 ± 1.8% at baseline to 7.7 ± 1.1% after 12 months. This study demonstrated the safety of IDegAsp in patients with diabetes mellitus for one year of use in standard clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.