Течение буллезного пемфигоида на фоне терапии блокаторами иммунного ответа при метастатической меланоме
- Аннотация
- Статья
- Ссылки
- English
В публикации представлено описание клинического случая пациентки с метастатической меланомой кожи, у которой на фоне терапии анти-PD-1-ингибитором возникло редкое дерматологическое нежелательное явление (НЯ) – буллезный пемфигоид. Несмотря на низкую распространенность (менее 1%), буллезный пемфигоид требует незамедлительной диагностики из-за риска прогрессирования в угрожающее жизни состояние. При подозрении на развитие буллезного пемфигоида на фоне иммунотерапии отмечается важность дифференциальной диагностики и междисциплинарного подхода среди онкологов и дерматологов, а именно своевременная отмена противоопухолевой терапии и коррекция НЯ с помощью иммуносупрессивных лекарственных препаратов.
В публикации представлено описание клинического случая пациентки с метастатической меланомой кожи, у которой на фоне терапии анти-PD-1-ингибитором возникло редкое дерматологическое нежелательное явление (НЯ) – буллезный пемфигоид. Несмотря на низкую распространенность (менее 1%), буллезный пемфигоид требует незамедлительной диагностики из-за риска прогрессирования в угрожающее жизни состояние. При подозрении на развитие буллезного пемфигоида на фоне иммунотерапии отмечается важность дифференциальной диагностики и междисциплинарного подхода среди онкологов и дерматологов, а именно своевременная отмена противоопухолевой терапии и коррекция НЯ с помощью иммуносупрессивных лекарственных препаратов.



Иммунотерапия с использованием ингибиторов контрольных точек иммунитета (ИКТИ), таких как анти-PD-1 (программируемый рецептор смерти 1) в монорежиме или в комбинации с анти-CTLA-4 (цитотоксический Т-лимфоцит-ассоциированный антиген 4), является на сегодняшний день одной из основных лекарственных опций при метастатической меланоме. Результаты клинических исследований [1] демонстрируют преимущества назначения терапии ингибиторами контрольных точек иммунитета при метастатической меланоме кожи в первую линию. Однако важно учитывать, что столь широкое применение иммунотерапии и, как следствие, активация иммунной системы приводят к различным нежелательным явлениям [НЯ]. В частности, НЯ со стороны кожных покровов являются одними из наиболее часто регистрируемых на фоне терапии ингибиторами контрольных точек (от 30% на фоне моноиммунотерапии до 50% на фоне комбинированной терапии) [2]. Несмотря на общее снижение качества жизни пациентов с кожной токсичностью, подобные реакции регистрируются чаще на раннем этапе и успешно поддаются коррекции. Более редкие, но серьезные формы кожной токсичности включают буллезные поражения, такие как синдром Стивенса – Джонсона, или токсический эпидермальный некролиз, или лихеноидный дерматит, и требуют повышенной настороженности среди специалистов, а порой приводят к экстренной госпитализации пациентов. Частота серьезных НЯ со стороны кожных покровов не превышает 1% на фоне ИКТИ.
Клинический случай
Пациентке К., 1939 г. рождения, в июне 2023 г. выполнено хирургическое вмешательство в объеме широкого иссечения меланоцитарного образования с биопсией сторожевого лимфатического узла. По данным гистологического заключения была диагностирована узловая эпителиоидноклеточная меланома, с изъязвлением, толщина по Breslow 8,2 мм, IV уровень инвазии по Кларку, 25 митозов на 1 мм2, R0, в лимфатическом узле метастазов и изолированных опухолевых клеток не обнаружено.
При контрольном обследовании по данным позитронно-эмиссионной и компьютерной томографий (ПЭТ/КТ) от сентября 2023 г. у пациентки обнаружены метастазы в левых аксиллярных лимфатических узлах. В октябре 2023 г. выполнена тонкоигольная биопсия левого аксиллярного лимфатического узла. По данным цитологического исследования обнаружен метастаз меланомы. Лечение не проводилось. По результатам контрольного обследования от декабря 2023 г. у пациентки были обнаружены метастазы в левых аксиллярных лимфоузлах, в мягких тканях левой подмышечной и лопаточной областей, в легких и обоих надпочечниках. На момент визита к онкологу-химиотерапевту зарегистрирован эквивалент стадии M1c(0). Пациентке была назначена анти-PD-1-терапия ниволумабом в дозе 480 мг один раз в 28 дней. После первого введения у пациентки развился гипертиреоз 1-й степени по CTCAE-NCI v5.0 на фоне терапии, перед четвертым введением ниволумаба зарегистрирован гипотиреоз 2-й степени, пациентке назначена заместительная терапия левотироксином.
По результатам контрольного обследования после третьего введения у пациентки зарегистрирован частичный ответ по критериям RECIST 1.1.
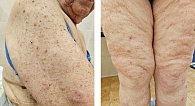
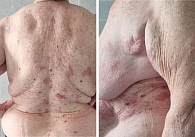
Спустя пять месяцев после начала лечения, в мае 2024 г., у пациентки впервые появилась макуло-папулезная сыпь на коже предплечий и в зоне декольте, а также зуд 1-й степени. Были назначены симптоматическая терапия антигистаминными препаратами и эмоленты (местно). Спустя месяц симптоматической терапии зарегистрирована сыпь 3-й степени тяжести согласно критериям CTCAE-NCI v5.0 (рис. 1). Пациентка направлена к дерматологу.
При дерматологическом осмотре в июне 2024 г. определяются множественные пятна и папулы розово-красного цвета с нечеткими границами и местами с мелкопластинчатым шелушением, визуализируются экскориации с геморрагическими корками на поверхности (рис. 1).
Перед началом дерматологического лечения для подтверждения характера высыпаний проведена punch-биопсия с дальнейшим патоморфологическим исследованием, в результате которого в эпидермисе определяется ортокератоз, нерегулярный гипергранулез, в дерме периваскулярные полиморфно-клеточные инфильтраты, дистрофические изменения коллагеновых и эластических волокон с гомогенизацией (рис. 2).
Назначено дерматологическое лечение в объеме: системно – таблетки цетиризин 20 мг в сутки, таблетки гидроксизин 17,5 мг на ночь; наружно – мазь клобетазола пропионат 0,05% тонким слоем на высыпания и участки повышенного зуда два раза в день в течение 10 дней, далее один раз в сутки утром в течение 10 дней, эмоленты с противозудным эффектом и солнцезащитный крем SPF 50.
После завершения курса топическими глюкокортикостероидами высыпания регрессировали до 1-й степени тяжести кожной токсичности согласно критериям CTCAE-NCI v5.0, терапия ИКТИ не прерывалась.
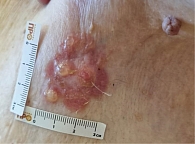
Однако спустя четыре месяца, в октябре 2024 г., у пациентки вновь возникли сыпь и зуд. Кроме того, в левой подмышечной области появились пузыри размерами до 1 см, заполненные прозрачной жидкостью. Пациентка направлена к дерматологу. Анти-PD-1-терапия прервана.
Зарегистрирован буллезный дерматит (пемфигоид) 1-й степени тяжести согласно критериям CTCAE-NCI v5.0 (рис. 3), назначена наружная терапия комбинированным препаратом бетаметазона дипропионат + гентамицин + клотримазол два раза в сутки, порошок бацитрацин + неомицин и спрей пантенол один раз в сутки продолжительностью семь дней.
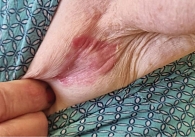
Спустя семь дней терапии в левой подмышечной области пузыри полностью разрешились, инфильтрация отсутствует, сохраняется умеренная эритема (рис. 4), новые буллезные высыпания не появляются, иммунотерапия продолжена.
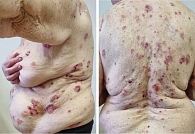
Проведено еще два введения ниволумаба и перед очередным введением в январе 2025 г. у пациентки появились новые элементы – пузыри на коже туловища и предплечий. Пациентка направлена к дерматологу. Зарегистрирован буллезный пемфигоид 3-й степени согласно критериям CTCAE-NCI v5.0: визуализируются множественные пузыри с плотной покрышкой, пятна, папулы, экскориации, геморрагические корки (рис. 5). Для подтверждения характера высыпаний проведены исследования в объеме: биопсия морфологического элемента с дальнейшим гистологическим исследованием, а также исследование антител к белкам BP180 и BP230.
По результатам патоморфологического исследования: в эпидермисе умеренно выраженная лимфоплазмоцитарная инфильтрация с примесью нейтрофилов в акантотических тяжах, зернистый слой сохранен. Визуализируется субэпидермальный пузырь, в полости которого эозинофилы, нейтрофилы, лимфоциты, гистиоциты, фибрин; в верхних слоях дермы – лимфоцитарный инфильтрат с примесью большого числа эозинофилов и нейтрофилов, придатки кожи сохранны (рис. 6).
По результатам аутоиммунной лабораторной диагностики антител к BP180 – > 200 RU/мл (N < 20 RU/мл), что говорит об активной фазе буллезного пемфигоида, к BP230 – 18,69 RU/мл (N < 20 RU/мл), что может свидетельствовать не о классическом буллезном пемфигоиде, а об аутоиммунном поражении кожи, связанном с противоопухолевой иммунотерапией. Пациентке назначена терапия преднизолоном в дозе 40 мг до стабилизации состояния кожных покровов, с последующим медленным снижением дозировки. Также назначены топический глюкокортикостероид (клобетазола пропионат) и раствор антисептика для обработки эрозий после вскрытия пузырей.
Терапия ниволумабом завершена ввиду развившейся токсичности спустя 13 месяцев после начала лечения, пациентка продолжает динамически наблюдаться каждые три месяца. Буллезные высыпания полностью регрессировали, сохраняется слабовыраженная поствоспалительная эритема без инфильтрации, в некоторых местах визуализируется слабое шелушение (рис. 7). По результатам очередного обследования от марта 2025 г. у пациентки сохраняется частичный ответ.
Обсуждение
Механизм развития кожной токсичности на фоне ИКТИ до конца не изучен. Активация Т-лимфоцитов под воздействием анти-PD-1-терапии приводит к нарушению баланса между провоспалительными и противовоспалительными цитокинами. Это вызывает повышенную продукцию интерферона γ (IFN-γ) и фактора некроза опухоли α (TNF-α), что способствует воспалению кожи. Интересно отметить, что не у всех пациентов развивается токсичность, и даже при развитии одного вида токсичности степень ее может значительно разниться у пациентов с одним диагнозом, что может быть связано с генетической предрасположенностью. Исследования показывают, что полиморфизмы генов HLA, участвующих в презентации антигенов, могут влиять на риск развития НЯ со стороны кожи [3].
Подробнее патогенез кожной токсичности представлен в табл. 1.
Буллезный пемфигоид, ассоциированный с применением ИКТИ (ICI-BP), представляет собой редкое, но клинически значимое осложнение иммунотерапии злокачественных новообразований. Анти-PD-1-терапия нарушает периферическую толерантность к собственным антигенам кожи, что приводит к продукции аутоантител против BP180 и BP230 [4]. Интересно отметить, что комбинированная терапия анти-PD-1/анти-CTLA-4 усиливает этот эффект за счет дополнительной активации Т-клеток и увеличения продукции провоспалительных цитокинов. Изучая по этому вопросу источники литературы, можно обнаружить лишь единичные клинические случаи и небольшие ретроспективные обзоры. Проведенный Asdourian M.S. и соавт. систематический обзор 70 исследований (127 пациентов; медиана возраста 71 год [IQR: 64–77], 21,3% женщин) позволил выявить ключевые закономерности буллезного пемфигоида на фоне ИКТИ [5]. Буллезный пемфигоид развивался как на фоне терапии, так и спустя несколько месяцев после ее прекращения, что подчеркивает необходимость длительного мониторинга за пациентами [6]. У нашей пациентки буллезный пемфигоид развился через девять месяцев на фоне проводимой иммунотерапии без ее остановки, что подтверждает возможность позднего дебюта кожной токсичности в процессе лечения и подчеркивает важность регулярной дерматологической оценки на всех этапах лекарственной терапии при злокачественных новообразованиях.
В обзоре 2022 г. «Cutaneous adverse events associated with immune checkpoint inhibitors» подчеркивается, что макулопапулезные высыпания могут быть начальными проявлениями буллезного пемфигоида, индуцированного ИКТИ [7]. А в исследовании «A retrospective, single-institution experience of bullous pemphigoid as an adverse effect of immune checkpoint inhibitors» отмечается, что развитию буллезного пемфигоида, индуцированного ИКТИ, может предшествовать продромальный период, характеризующийся возникновением зуда и макуло-папулезной сыпи, которые затем прогрессируют до развития буллезных высыпаний [8]. Это подчеркивает необходимость раннего распознавания и мониторинга кожных проявлений у пациентов, получающих противоопухолевую иммунотерапию, как и в контексте нашей пациентки.
В исследовании Apalla Z. и соавт. «Management of immune checkpoint inhibitor-induced bullous pemphigoid» отмечается, что у пациентов, получающих ИКТИ, диагноз буллезного пемфигоида подтверждается не только патоморфологически, но и с помощью серологических тестов на аутоантитела к BP180 и BP230. В частности, у 88,2% пациентов были обнаружены положительные результаты на BP180, а у 67,4% – на BP230, что подчеркивает высокую диагностическую ценность этих маркеров в контексте буллезного пемфигоида, индуцированного ИКТИ, как в нашем случае [9].
Антитела к BP180 и BP230 являются относительно специфичными для буллезного пемфигоида, однако BP180 (особенно к домену NC16A) – наиболее специфичный маркер буллезного пемфигоида, включая его классические, лекарственные и ассоциированные с противоопухолевой терапией формы. BP230 менее специфичный, может встречаться также при других аутоиммунных буллезных дерматозах и даже при псориазе, дерматомиозите и других воспалительных состояниях кожи.
В контексте буллезного пемфигоида, индуцированного ИКТИ, исследования показывают, что у таких пациентов также чаще всего выявляются антитела к BP180, подтверждая аутоиммунный патогенез, аналогичный идиопатическому буллезному пемфигоиду, как в случае с нашей пациенткой, получающей лечение ИКТИ [10].
Тактика лечения буллезного пемфигоида чаще всего включает отмену иммунотерапии (78% случаев) с последующим назначением системных кортикостероидов, которые остаются золотым стандартом. Однако их длительное применение сопряжено с риском осложнений, что актуализирует использование стероид-сберегающих подходов. Адъювантная терапия доксициклином, метотрексатом или биологическими агентами (ритуксимаб, омализумаб) продемонстрировала эффективность в рефрактерных случаях, но при этом важно понимать, что доказательная база ограничена отсутствием рандомизированных исследований.
Заключение
Коррекция иммуноопосредованных дерматологических НЯ, индуцированных ИКТИ, а также принятие решений о приостановке или прекращении противоопухолевой терапии должны осуществляться в тесном междисциплинарном взаимодействии с врачом-дерматологом.
В обязательном порядке следует проводить стадирование выявленных дерматологических НЯ в соответствии с критериями оценки их токсичности (CTCAE-NCI v5.0), что позволяет стандартизировать подход к оценке тяжести кожной токсичности и корректно подобрать стратегию ведения пациента.
Терапевтическая тактика при развитии кожных реакций должна соответствовать актуальным клиническим рекомендациям, включая международные протоколы NCCN (National Comprehensive Cancer Network) и Российские клинические рекомендации RUSSCO по лечению иммуноопосредованных НЯ.
Принятие решения о временной приостановке или полном прекращении иммунотерапии должно носить строго индивидуализированный характер и опираться на ряд клинически значимых факторов, включая степень тяжести кожной токсичности, отсутствие клинического ответа на стандартную терапию (в первую очередь системные глюкокортикостероиды), общую длительность проводимой иммунотерапии, достигнутый противоопухолевый ответ, а также индивидуальные характеристики пациента, включая сопутствующую патологию, возраст, качество жизни и степень приверженности лечению.
Такой комплексный и персонализированный подход обеспечивает оптимальный баланс между контролем иммуноопосредованных НЯ и сохранением жизненно необходимой иммунотерапии.
V.V. Nazarova, PhD, A.Yu. Syryseva, Z.R. Magomedova, N.V. Danilova, PhD, Ye.A. Shatokhina, PhD, K.V. Orlova, PhD
Contact person: Anastasia Yu. Syryseva, syryseva.a@yandex.ru
0N.N. Blokhin National Medical Research Center of Oncology, Moscow
Oncology Center No 1 of the S.S. Yudin City Clinical Hospital, Moscow
Central State Medical Academy of the Presidential Administration of the Russian Federation, Moscow
Medical Scientific and Educational Institute of Moscow State University named after M.V. Lomonosov
Therapy with immune checkpoint blockers significantly affected the survival rates of patients with metastatic melanoma. However, immunotherapy may be accompanied by the development of various immune-mediated complications. Skin adverse events are the most common (from 30 to 50% in anti-PD-1 therapy and against the background of combination therapy with anti-PD-1 and anti-CTLA-4).
The publication describes a clinical case of a patient with metastatic skin melanoma who developed a rare dermatological adverse event - bullous pemphigoid, against the background of anti-PD-1 inhibitor therapy. Despite its low prevalence (less than 1%), bullous pemphigoid requires immediate diagnosis due to the risk of progression to a life-threatening condition. If the development of bullous pemphigoid is suspected against the background of immunotherapy, the importance of differential diagnosis and an interdisciplinary approach among oncologists and dermatologists is noted, specifically, early cancellation of antitumor therapy and correction of the undesirable phenomenon with the help of immunosuppressive drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.