Аналоги инсулина ультракороткого действия
К данной группе аналогов относятся инсулин лизпро (Хумалог), инсулин аспарт (НовоРапид), инсулин глулизин (Апидра®). Структура новых инсулинов идентична человеческому инсулину, отличие заключается в инверсии (взаимной замене) двух аминокислотных остатков лизина и пролина в положениях В29 и В28 соответственно (препарат Хумалог) или замене пролина в 28 положении В-цепи молекулы инсулина на аспарагиновую кислоту (НовоРапид). Это изменение положения аминокислот не изменило биологической активности В-цепи, но позволило уменьшить процессы самоассоциации молекул инсулина и увеличить скорость всасывания препарата из подкожного депо. При получении Апидры произведена замена аспарагина на лизин в положении В3, а в положении В29 – лизина на глутамин, благодаря чему Апидра, в отличие от других ультракоротких аналогов, сохраняет стабильность в растворе в виде димеров и мономеров без добавления цинка [1]. При подкожном введении Хумалог, НовоРапид и Апидра имеют более быстрое начало и пик действия, соответствующие уровню пост-алиментарной гипергликемии, и меньшую продолжительность действия в сравнении с растворимым человеческим инсулином. Это дает возможность вводить препараты непосредственно перед приемом пищи (или после) и позволяет избежать дополнительных перекусов.
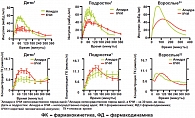
Скорость всасывания и пиковые уровни быстродействующих аналогов инсулина в два раза выше, чем у человеческого инсулина. Продолжительность действия препаратов составляет 3–4 часа. Другое отличие, имеющее клиническое значение, заключается в том, что анатомическая локализация инъекции меньше влияет на скорость всасывания препарата. Время пика и общая продолжительность действия не зависит от дозы инсулина, как при введении простого человеческого инсулина. В ряде исследований доказано, что у больных, получающих быстродействующие инсулины, наблюдается достоверно менее выраженная степень постпрандиальной гипергликемии и снижение такого важного показателя компенсации углеводного обмена, как гликированный гемоглобин НbА1с [3, 4, 5]. Еще одним важным эффектом ультракоротких аналогов инсулина является снижение частоты ночных гипогликемий [9]. Данное свойство этих препаратов обусловлено тем, что при их применении отсутствует «шлейф» действия инсулина, введенного перед ужином, что характерно для простого короткого инсулина. Инсулин Апидра был зарегистрирован к применению у детей в РФ в 2009 году. На рис. 1 представлена фармакокинетическая и фармакодинамическая характеристика препарата, которая не зависит от возраста пациентов [6, 7].
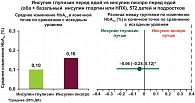
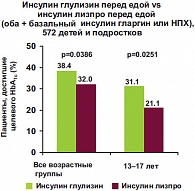
Для оценки эффективности и безопасности применения инсулина Апидра у детей и подростков было проведено крупное многоцентровое международное исследование, проходившее в 65 центрах мира, включая Россию. В исследование вошло 572 детей и подростков с СД 1 типа в возрасте 4–17 лет, которые в течение 26 недель получали инсулины глулизин или лизпро. В качестве базального препарата пациенты получали инсулин гларгин либо НПХ. Целью исследования было доказательство гипотезы «не хуже» для инсулина глулизин по сравнению с инсулином лизпро. В конце исследования у пациентов наблюдались сопоставимые показатели гликированного гемоглобина, различия в частоте гипогликемий, а также неблагоприятных событий в период исследования отсутствовали [8, 9]. Однако среди пациентов, получавших инсулин Апидра, отмечалась более высокая частота достижения целевого уровня HbA1c, что было особенно выражено в группе подростков 13–17 лет (рис. 2, 3). Большинство пациентов предпочитают лечение инсулиновыми аналогами ультракороткого действия, мотивируя это большим удобством в применении (возможность делать инъекции непосредственно перед едой), быстрым сахароснижающим эффектом при случайной гипергликемии, более легким управлением диабетом в нестандартных ситуациях, уменьшением количества гипогликемических состояний, а также возможностью при желании несколько расширить диету за счет легкоусвояемых углеводов. Таким образом, к преимуществам использования быстродействующих аналогов инсулина следует отнести:
1. Улучшение состояния углеводного обмена:
- снижение уровня постпрандиальной гликемии;
- снижение уровня гликированного гемоглобина (в основном при одновременной оптимизации базальной инсулино-терапии).
- удобство применения (непосредственно перед едой);
- возможность применения после еды (при изменяющемся аппетите);
- уменьшение риска гипогликемий, в том числе и в ночное время;
- гибкость режима питания [2].
Базальные беспиковые аналоги инсулина
К этой группе препаратов относятся инсулин гларгин (Лантус) и инсулин детемир (Левемир) [1, 2]. Структура инсулина гларгина отличается от структуры человеческого инсулина тремя аминокислотными остатками: глицин вместо аспарагина в положении А21, и два остатка аргинина, присоединенные к карбоксильному концу В-цепи в положениях В31 и В32. Эти изменения структуры привели к смещению изоэлектрической точки молекулы в сторону более нейтральных значений (с рН 5,4 до 7,0), благодаря чему инсулин лучше растворяется в кислом содержимом флакона, но становится нерастворимым при нейтральном рН в подкожной клетчатке. Образование микропреципитатов в месте иньекции замедляет поступление инсулина гларгин в кровоток. Замена глицина на аспарагин в положении А21 сделала более стабильной гексамерную структуру инсулина. Благодаря этим изменениям инсулин гларгин медленно всасывается из подкожной клетчатки, дает длительный эффект и обеспечивает постоянную базальную концентрацию инсулина [2].
Молекулярная структура инсулина детемир отличается от структуры человеческого инсулина отсутствием аминокислоты треонин в положении B30 и присоединением к лизину в положении B29 жирнокислотного остатка из 14 атомов углерода (С14) – миристиновой кислоты. Таким образом, к каждому мономеру инсулина детемир присоединена боковая цепочка миристиновой кислоты, которая может связываться с альбумином в депо (подкожно-жировой клетчатке), в циркуляции (кровяном русле) или в интерстиции (в органах-мишенях). Ацилирование молекулы инсулина жирной кислотой не только обеспечивает связывание с альбумином, но также усиливает самоассоциацию гексамеров инсулина. В основном механизм пролонгированного действия инсулина обусловлен более длительным всасыванием из подкожного депо; обратимое связывание с альбумином в плазме также играет некоторую роль в дальнейшей пролонгации действия. Продолжительность действия инсулина гларгин достигает 24 часов. Препарат вводится один раз в сутки всегда в одно и тоже время, у подростков предпочтительнее введение в вечерние часы. Начальная доза составляет 80% от суммарной суточной дозы пролонгированного инсулина. Дальнейшая титрация дозы проводится по показателям глюкозы крови натощак и в ночные часы с учетом уровня гликемии перед сном. Уровень гликемии после завтрака, в дневные и вечерние часы регулируется инсулином короткого или ультракороткого действия. Назначение Лантуса позволяет избежать дополнительных инъекций короткого инсулина в ранние утренние часы у большинства подростков с феноменом «утренней зари», а также уменьшает лабильность течения сахарного диабета у многих больных.
Инсулин детемир обладает дозозависимой длительностью действия [T. Heise et al., 2004]. При дозе 0,4 ЕД/кг длительность действия инсулина составляла 20 ч, при дозе более 0,4 ЕД/кг – 22–24 часа. В нашей практике подавляющее большинство пациентов вводят препарат два раза в сутки. У детей первых лет жизни вследствие низкой потребности в базальном инсулине в ночные часы уровень гликемии нередко может быть компенсирован однократным утренним введением препарата. Клинический опыт показывает, что у детей первых лет жизни потребность в базисном инсулине выше в дневные часы, а у подростков – в ночные. В связи с этим двукратный режим введения инсулина, позволяющий дозировать его ночной и дневной фон, является преимуществом у ряда больных. Многочисленные исследования посвящены эффективности и безопасности применения базальных инсулиновых аналогов у детей и подростков. Убедительно доказано снижение вариабельности действия базальных инсулиновых аналогов. Было установлено, что при использовании как инсулина гларгин, так и инсулина детемир, происходит достоверное снижение утренней гликемии, уровня гликированного гемоглобина, снижение частоты гипогликемий, как дневных, так и ночных, в том числе и тяжелых. Снижение частоты гипогликемий происходит благодаря не только максимальному приближению профиля действия базальных и ультракоротких аналогов к физиологической инсулинемии, но и вследствие снижения вариабельности их действия, что позволяет создать предсказуемую концентрацию инсулина в крови. При терапии инсулином детемир наблюдается снижение массы тела или отсутствие ее прибавки, что чрезвычайно важно для подростков, склонных к ожирению.
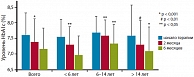
В открытом 6-месячном исследовании, включавшем 80 детей и подростков с СД 1 типа в возрасте от 2 до 19 лет, получавших интенсифицированную инсулинотерапию инсулином Лантус (1 раз в сутки) в сочетании с прандиальным инсулином (простым человеческим или ультракоротким аналогом), было получено достоверное снижение уровня гликированного гемоглобина во всех возрастных группах (рис. 4) при достоверном снижении уровня гликемии натощак и суточной потребности в инсулине [10]. Непрерывная подкожная инфузия инсулина (НПИИ) с помощью инсулиновых помп в настоящее время считается наиболее эффективным методом заместительной терапии у больных сахарным диабетом. В работе Garcia-Garcia E. и соавт. [12] проведено исследование долгосрочной эффективности и безопасности инсулина гларгин в режиме базально-болюсной инсулинотерапии по сравнению с НПИИ у детей и подростков c CД 1 типа в течение 2 лет. Критерии включения: пациенты с СД1 типа (n = 32) в возрасте 12,5 ± 2,4 лет, имеющие HbA1c > 7,5% (> 8% для пациентов в препубертатном периоде) или частые эпизоды гипогликемий, диагноз СД поставлен до 14 лет, терапия НПХ-инсулином 3 раза/сут в комбинации с инсулином лизпро 3 раза/сут. Инсулин гларгин пациенты получали 1 раз в сутки, инсулин лизпро – 3 раза перед едой (n = 24). На помповой инсулинотерапии находились 8 пациентов. Были получены близкие показатели по уровню HbA1c, потребности в инсулине, частоте гипогликемий и диабетического кетоацидоза (табл. 1). Таким образом, было показано, что использование инсулина гларгин в терапии СД 1 типа у детей и подростков близко по эффективности к терапии инсулиновыми помпами, считающимися золотым стандартом современной инсулинотерапии.
Заключение
Проводимая в последние годы терапия сахарного диабета с помощью инсулиновых аналогов является новым, эффективным и безопасным методом лечения, позволяющим достигать целевых уровней углеводного обмена у больных при одновременном снижении риска гипогликемий. Целью перевода пациентов на инсулиновые аналоги является профилактика специфических осложнений сахарного диабета и повышение качества жизни детей и подростков с сахарным диабетом. Инсулиновые аналоги ультракороткого действия и беспиковые базальные инсулиновые аналоги в настоящее время признаны всем мировым медицинским сообществом как лучшие инсулиновые препараты, том числе и для использования в педиатрической практике. Применение инсулиновых аналогов ультракороткого действия и беспиковых пролонгированных аналогов в детской практике также рекомендуется ISPAD [13]. В России у детей и подростков в последние годы рекомендованы к применению только человеческие генно-инженерные инсулины и инсулиновые аналоги, обеспечивающие лучший контроль гликемии и повышение качества жизни пациентов.
СПРАВКА
Сахарный диабет 1 типа (инсулинозависимый диабет, ювенильный диабет) – заболевание эндокринной системы, характеризующееся абсолютной недостаточностью инсулина, вызванной деструкцией бета-клеток поджелудочной железы. Диабет 1 типа может развиться в любом возрасте, однако наиболее часто заболевают лица молодого возраста (дети, подростки, взрослые люди моложе 30 лет). В клинической картине преобладают классические симптомы: жажда, полиурия, потеря веса, кетоацидотические состояния.
В основе патогенетического механизма развития диабета 1 типа лежит недостаточность выработки инсулина эндокринными клетками (β-клетки островков Лангерганса поджелудочной железы), вызванное их разрушением под влиянием тех или иных патогенных факторов (вирусная инфекция, стресс, аутоиммунные заболевания и другие). Диабет 1 типа составляет 10–15% всех случаев диабета, чаще развивается в детском или подростковом периоде. Для этого типа диабета характерно появление основных симптомов, которые быстро прогрессируют с течением времени. Основным методом лечения являются инъекции инсулина, нормализующие обмен веществ пациента. В отсутствие лечения диабет 1 типа быстро прогрессирует и приводит к возникновению тяжелых осложнений, таких как кетоацидоз и диабетическая кома, заканчивающиеся смертью больного.
Вследствие инсулиновой недостаточности, инсулинзависимые ткани (печеночная, жировая и мышечная) теряют способность утилизировать глюкозу крови и, как следствие, повышается уровень глюкозы в крови (гипергликемия) – кардинальный диагностический признак сахарного диабета. Вследствие инсулиновой недостаточности в жировой ткани стимулируется распад жиров, что приводит к повышению их уровня в крови, а в мышечной ткани – стимулируется распад белков, что приводит к повышенному поступлению аминокислот в кровь. Субстраты катаболизма жиров и белков трансформируются печенью в кетоновые тела, которые используются инсулиннезависимыми тканями (главным образом мозгом) для поддержания энергетического баланса на фоне инсулиновой недостаточности.