Интенсификация инсулинотерапии: персонализация против клинической инерции в реальной практике
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрены проблемы инсулинотерапии и клинической инерции в отношении ее назначения. Представлен опыт эндокринологов Северо-Западного федерального округа преодоления клинической инерции с помощью доступных в настоящее время инструментов.
Практические наработки касаются интенсификации базальной инсулинотерапии фиксированной комбинацией базального инсулина гларгин 100 ЕД и агониста рецепторов глюкагоноподобного пептида 1 ликсисенатида (препаратом Соликва СолоСтар®) у пациентов с неудовлетворительным гликемическим контролем. Для обоснования и оценки результатов интенсификации лечения по истечении трех месяцев использовали дневник вариабельности гликемии как доступную валидированную альтернативу непрерывному мониторингу гликемии. Для интенсификации была выбрана фиксированная комбинация инсулинов деглудек и аспарт (иДегАсп) (препарат Райзодег®).
Полученные нами результаты подтверждают целесообразность преодоления клинической инерции, а также эффективность, безопасность и удобство применения иДегАсп. Данная комбинация продемонстрировала нейтральность в отношении массы тела. Кроме того, было отмечено, что дневник вариабельности гликемии является доступным инструментом для детальной оценки качества гликемического контроля.
В статье рассмотрены проблемы инсулинотерапии и клинической инерции в отношении ее назначения. Представлен опыт эндокринологов Северо-Западного федерального округа преодоления клинической инерции с помощью доступных в настоящее время инструментов.
Практические наработки касаются интенсификации базальной инсулинотерапии фиксированной комбинацией базального инсулина гларгин 100 ЕД и агониста рецепторов глюкагоноподобного пептида 1 ликсисенатида (препаратом Соликва СолоСтар®) у пациентов с неудовлетворительным гликемическим контролем. Для обоснования и оценки результатов интенсификации лечения по истечении трех месяцев использовали дневник вариабельности гликемии как доступную валидированную альтернативу непрерывному мониторингу гликемии. Для интенсификации была выбрана фиксированная комбинация инсулинов деглудек и аспарт (иДегАсп) (препарат Райзодег®).
Полученные нами результаты подтверждают целесообразность преодоления клинической инерции, а также эффективность, безопасность и удобство применения иДегАсп. Данная комбинация продемонстрировала нейтральность в отношении массы тела. Кроме того, было отмечено, что дневник вариабельности гликемии является доступным инструментом для детальной оценки качества гликемического контроля.

Введение
В январе 2024 г. эксперты Американской диабетической ассоциации в стандартах оказания помощи при диабете впервые за многие годы сделали акцент на применение инсулина. Они предложили рассматривать возможность введения инсулина на любой стадии сахарного диабета (СД) 2 типа независимо от получения других сахароснижающих препаратов (ССП) пациентам, которые в этом нуждаются, с возможной коррекцией дозы других ССП при риске развития гипогликемии [1]. Американские рекомендации, так же как и российские [2], нацелены на повышение внимания к проблеме клинической инерции в отношении старта и интенсификации инсулинотерапии и, главное, на ее преодоление.
Появление новых групп ССП, таких как ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2) и агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1), открыло новые возможности влияния на патогенез и прогноз СД 2 типа. Результаты применения иНГЛТ-2 и арГПП-1 в отношении снижения риска развития микро- и макрососудистых осложнений, воздействия на кардиоренальный континуум оказались впечатляющими. Как следствие, предположили, что данные препараты могут стать альтернативой инсулину при СД 2 типа. Это привело к усилению клинической инерции в отношении инсулинотерапии и даже некоторой ее стигматизации. Однако у части пациентов назначение иНГЛТ-2 и арГПП-1 может быть неприемлемым из-за непереносимости, противопоказаний, развития побочных эффектов и/или стоимости.
В одном из недавних литературных обзоров, посвященных формированию клинической инерции, была выделена роль специалистов здравоохранения, пациентов и системы здравоохранения [3]. Так, в начале инсулинотерапии или на этапе ее интенсификации высказывались опасения по поводу риска возникновения гипогликемии и увеличения веса, а также по поводу отсутствия у пациентов способности придерживаться схемы терапии [4–6].
Согласно данным других работ, у пациентов с СД 2 типа, принимавших два или три ССП, медиана времени до начала введения инсулина варьировалась от пяти лет до 7,1 года и более [7–13]. Исследование с участием пациентов с СД 2 типа, которые впервые начали получать базальную инсулинотерапию, показало, что через шесть месяцев плохой гликемический контроль сохранялся у 81% [10]. Через 12 месяцев только 34% пациентов с неконтролируемой гликемией на фоне базальной инсулинотерапии предприняли шаги по интенсификации лечения [10].
В обзоре 2023 г. отмечено, что у больных СД 2 типа со средним показателем гликированного гемоглобина (HbA1c) более 8% время до интенсификации лечения составляло не менее пяти лет [11]. Эти данные убедительно свидетельствуют о значительной задержке начала и интенсификации инсулинотерапии у подходящих для этого по клиническому статусу пациентов. В связи со сказанным необходимо отметить, что клинически подходящие пациенты, которые впервые начали вводить инсулин по рекомендациям врачей, в среднем достигали уровня HbA1c 7,0% через 18 месяцев в отличие от отказавшихся от такого лечения [12]. В последнем случае для достижения такого уровня HbA1c требовалось 30 месяцев.
Как упоминалось выше, одной из основных причин клинической инерции в отношении назначения инсулинотерапии является страх гипогликемий. Однако в ряде исследований, в частности в исследованиях ACCORD и SOLVE [13, 14], после старта и интенсификации инсулинотерапии наблюдалось даже уменьшение случаев гипогликемии. Во многом это связано с появлением новых поколений инсулинов, обладающих низкой вариабельностью сахароснижающего эффекта, оптимальной продолжительностью действия в зависимости от задач (длительной (гларгин) и сверхдлительной (деглудек) – для базальных инсулинов, ультракороткой (аспарт, лизпро, глулизин) и сверхбыстрой (аспарт сверхбыстрого действия) – для прандиальных инсулинов), а также значительно более безопасных в отношении риска развития гипогликемий.
Важно подчеркнуть, что уменьшить страх гипогликемий и снизить терапевтическую инерцию помогают новые технологии мониторинга, специально ориентированные на непрерывную оценку уровня глюкозы (во избежание гипогликемических эпизодов) и улучшение качества жизни пациентов. Проведенные за последнее десятилетие исследования доказали, что непрерывный мониторинг связан со значительным снижением количества тяжелых гипогликемий и улучшением способности распознавать гипогликемии [15, 16].
Вопрос о применении препаратов инсулинового ряда рано или поздно встает перед многими пациентами. Известно, что по мере прогрессирования СД 2 типа нарастает дисфункция β-клеток, поэтому лечение неинсулиновыми ССП не позволяет достигать или поддерживать адекватный гликемический контроль. Кроме того, только инсулин способен целенаправленно влиять на все патофизиологические дефекты СД 2 типа, а именно на нарушение действия инсулина, инсулинорезистентность и дефицит инсулина [17].
Таким образом, своевременное активное управление гликемией является не только оправданным, но и необходимым [17], в том числе более раннее, чем было принято считать, применение или интенсификация инсулинотерапии. При этом инсулинотерапия должна быть максимально физиологичной, не только обеспечивать базальный уровень инсулина для поддержания баланса между скоростью продукции глюкозы печенью и периферическим захватом глюкозы глюкозозависимыми тканями в ночное время и длительных промежутках между приемами пищи, но и влиять на постпрандиальную инсулинемию и гликемию.
Приведенные данные подтверждают острую необходимость преодоления клинической инерции для предотвращения негативных последствий длительного отсутствия надлежащего гликемического контроля. Современные группы препаратов, инсулины последних поколений, ассоциированные с низким риском гипогликемий, новые технологии и подходы к самоконтролю способны уменьшить клиническую инерцию.
Необходимо отметить, что в условиях рутинной клинической практики эндокринологи решают множество задач, среди которых обеспечение персонализированного подхода к выбору целевых показателей гликемического контроля, подбору сахароснижающей терапии, ее своевременной адаптации и/или интенсификации [2, 18], поддержание мотивации пациентов к соблюдению рекомендаций и проведению регулярного самоконтроля, преодоление страха перед гипогликемией и набором веса. Из них наиболее сложная именно интенсификация инсулинотерапии, требующая перехода на большее количество инъекций и точек самоконтроля, а также более значимо влияющая на образ жизни и режим питания.
В последние несколько лет в Российской Федерации доступен современный препарат Соликва СолоСтар® с фиксированным соотношением компонентов. В его состав входят базальный инсулин гларгин 100 ЕД и арГПП-1 ликсисенатид (иГларЛикси).
Ликсисенатид – производное арГПП-1 эксендина. Он обеспечивает уменьшение постпрандиальной гликемии главным образом за счет задержки опорожнения желудка и снижения высвобождения глюкагона.
Период полураспада ликсисенатида составляет два – четыре часа. Это означает, что контроль постпрандиальной гликемии происходит преимущественно во время еды после инъекции [19].
Ликсисенатид особенно широко применяется на старте инсулинотерапии [20].
Однако через один – три года применения иГларЛикси, даже после добавления дополнительных ССП, его эффект ускользает, качество гликемического контроля снижается.
В силу клинической инерции усиление коррекции прандиальной гликемии нередко происходит с отсрочкой. К уже получаемым препаратам добавляют два-три ССП из всех возможных групп, хотя, согласно современным стандартам терапии СД 2 типа [1, 2], требуется интенсификация инсулинотерапии. В действующих на сегодняшний день российских рекомендациях указывается, что в данной ситуации возможны два варианта: применение базис-болюсного режима инсулинотерапии либо фиксированной комбинации инсулина сверхдлительного действия и ультракороткого инсулина или смесей инсулинов [2]. Поскольку смеси инсулинов и базис-болюсный режим инсулинотерапии предполагают от трех до пяти инъекций в день, увеличение частоты самоконтроля, повышение риска и страха гипогликемий, а также снижение качества жизни, многие специалисты для интенсификации инсулинотерапии выбирают фиксированную комбинацию инсулинов деглудек и аспарт (иДегАсп). Это комбинация инсулина сверхдлительного и инсулина ультракороткого действия.
Безусловно, в основе этого выбора лежит персонализированный подход к пациенту, при котором учитываются осложнения СД 2 типа и сопутствующая патология.
Согласно данным рандомизированных клинических исследований и исследований реальной клинической практики, перевод на иДегАсп должен обеспечивать качественный гликемический контроль в течение суток с минимальным риском развития гипогликемий и безопасность в отношении сердечно-сосудистой системы [21–23].
Гибкий режим дозирования позволяет адаптировать терапию иДегАсп к любому образу жизни и режиму дня. Препарат не требует ресуспендирования.
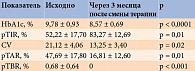
Согласно современным российским и зарубежным рекомендациям, степень гликемического контроля при СД определяется не только по достижению целевого уровня HbA1c, но и по времени нахождения в целевом диапазоне (time in range, TIR), в диапазонах гипо- (time below range, TBR) и гипергликемий (time above range, TAR) [1, 2], вариабельности гликемии (коэффициенту вариации (coefficient of variation, CV)) [16]. Показатель TIR связан с риском развития микрососудистых осложнений, поэтому может использоваться в качестве критерия оценки наличия таковых. Время нахождения в диапазонах выше и ниже целевого диапазона может быть полезным для определения эффективности и безопасности применяемых схем лечения. При амбулаторном самоконтроле следует ориентироваться на уровень HbA1c менее 7%, TIR более 70% в сочетании с TBR менее 4% в диапазоне гликемии менее 3,9 ммоль/л [1, 2, 24].
Необходимо отметить, что в Северо-Западном федеральном округе многие специалисты уже более двух лет используют дневник вариабельности гликемии (ДВГ) [25]. Валидированный инструмент, позволяющий рассчитывать целевые значения TIR (рTIR), TAR (рTAR) и TBR (рTBR) в условиях рутинной амбулаторной практики, когда для большинства пациентов в силу различных причин непрерывный мониторинг гликемии недоступен. В данном случае р перед показателем означает, что последний является расчетным. Это позволяет дифференцировать полученный результат и показатели TIR, TBR, TAR при непрерывном мониторировании.
Благодаря ведению ДВГ пациенты становятся активными участниками процесса управления заболеванием. Они видят, сколько показателей самоконтроля находится в целевом диапазоне, а также каков риск развития гипогликемий, в том числе бессимптомных. В ДВГ для оцениваемых параметров помимо числовых значений предусмотрена цветовая индикация (рис. 1). Это облегчает понимание полученных данных, что особенно важно для пожилых пациентов.
Ниже представлен опыт преодоления клинической инерции в отношении интенсификации инсулинотерапии в амбулаторной практике врачей-эндокринологов Северо-Западного федерального округа, осуществленной с помощью доступных в настоящее время в РФ препаратов и средств контроля.
Клиническое наблюдение
Среди наблюдавшихся у разных врачей-эндокринологов пациентов во время очередных визитов были выявлены лица с несоответствующими индивидуальным целям гликемического контроля результатами на фоне терапии иГларЛикси и от одного до трех ССП. В результате была сформирована группа из 25 человек, из них 11 (44%) мужчин и 14 (56%) женщин. Средний возраст больных составил 62,0 ± 7,8 года (от 48 до 76 лет), длительность СД 2 типа – 12,0 ± 5,4 года, индекс массы тела – 30,0 ± 1,7 кг/м2. Доза иГларЛикси была подобрана индивидуально и титровалась в соответствии с тощаковой гликемией.
Использование ДВГ предлагалось во время плановых визитов пациентов в лечебно-профилактические учреждения. Пациенты вели ДВГ для оценки качества гликемического контроля и необходимости изменения схемы терапии. После корректировки проводимого лечения показатели самоконтроля мониторировали повторно с использованием ДВГ для оценки эффективности и безопасности в отношении риска развития гипогликемических состояний.
Пациенты проводили ежедневный самоконтроль в соответствии с рекомендациями разработчиков ДВГ (от четырех до семи раз в сутки) в течение двух недель.
Статистическая обработка полученных данных осуществлялась с помощью программ описательной статистики. Для расчета использовали Т-критерий Уилкоксона. Результаты представляли в виде среднего значения и стандартного отклонения.
Исходно с помощью ДВГ у пациентов были выявлены не соответствующие целям лечения результаты (таблица). Было принято решение о переводе больных на двукратный режим введения фиксированной комбинации иДегАсп с коррекцией остальной сахароснижающей терапии. В основном в схеме терапии оставляли терапевтические дозы иНГЛТ-2 с доказанными кардио- и нефропротективными свойствами.
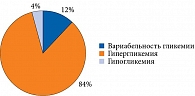
Ключевой причиной интенсификации инсулинотерапии и перевода с иГларЛикси на иДегАсп ожидаемо оказалась гипергликемия – 84% случаев (рис. 2).
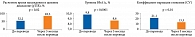
Через три месяца полученные результаты подтвердили правильность принятого решения об интенсификации инсулинотерапии (см. таблицу). Так, наблюдались положительные количественные и качественные изменения всех показателей углеводного обмена: HbA1c, рTIR, рTAR и CV (рис. 3). Уровень HbA1c в среднем снизился на 1,2% (см. рис. 3), продолжительность расчетного времени нахождения в целевом диапазоне увеличилась практически на 70%. При этом большая часть пациентов превзошла минимальный рекомендуемый порог в 70% по показателю времени нахождения в целевом диапазоне (см. рис. 3). У пациентов также исчезли единичные гипогликемические состояния, которые отмечались на фоне предшествующей терапии.
Необходимо отметить, что интенсификация инсулинотерапии не повлияла на массу тела.
Таким образом, данные российской амбулаторной практики подтвердили результаты рандомизированных клинических исследований и исследований реальной клинической практики в отношении эффективности и безопасности, а также в отношении удобства применения иДегАсп. Так, ни у одного пациента не возникло сложностей с титрацией доз при смене терапии (перевод с иГларЛикси на иДегАсп).
Заключение
Современная диабетология предлагает широкий спектр инструментов для качественного управления СД 2 типа. В рамках персонализированного подхода к лечению основные задачи врачей заключаются в своевременной оценке гликемического контроля у пациента и его текущих потребностей, а также в подборе для него терапии такой интенсивности, которая будет способствовать достижению целевых показателей гликемии, улучшению прогноза СД 2 типа и качества жизни.
Конфликт интересов
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи, а также отсутствие любой финансовой поддержки.
Kh.S. Astamirova, E.A. Babayeva, T.S. Ivanenko, L.V. Kancherova, Ye.A. Matushkina, N.P. Nikolayeva, V.A. Parshina, O.Yu. Presnyakova, A.K. Rogaleva, Ye.Yu. Smirnova, M.A. Startseva, M.K. Torosyan, P.A. Uybo, L.M. Filippova, N.I. Kholmskaya, A.A. Chvertkina, Ye.P. Chistyakova, I.G. Yurikova
City Consulting and Diagnostic Center No 1, St. Petersburg
City Hospital No 2, Kaliningrad
City Clinic No 114, St. Petersburg
City Clinic No 106, St. Petersburg
City Clinic No 43, St. Petersburg
City Clinic No 3, Kaliningrad
City Clinic No 23, St. Petersburg
City Clinic No 117, St. Petersburg
Arkhangelsk Regional Clinical Hospital
City Clinic No 44, St. Petersburg
Ministry of Health of the Arkhangelsk Region
City Clinic No 100, St. Petersburg
Vologda City Clinic No 3
Clinic of the Russian Railways Hospital, Komi Republic, Sosnogorsk
Vologda Regional Center of Endocrinology
Murmansk Regional Clinical Hospital named after P.A. Bayandin
Contact person: Maria A. Startseva, startsevamaria@gmail.com
In recent years, the society of endocrinologists has regained recognition of the importance of timely insulin therapy for type 2 diabetes mellitus. However, due to clinical inertia, the inclusion of insulin therapy in the treatment regimen and especially its intensification is significantly delayed.
The article discusses the problems of insulin therapy and clinical inertia in relation to its administration. The experience of endocrinologists of the Northwestern Federal District in overcoming clinical inertia with the help of currently available tools is presented.
Practical developments concern the intensification of basal insulin therapy with a combined preparation of basal insulin glargine 100 U and glucagon-like peptide 1 receptor agonist lixisenatide with a fixed ratio (commercial name Soliqua SoloStar) in patients with unsatisfactory glycemic control. To substantiate and control the results of intensification after 3 months of therapy, the diary of glycemic variability was used as an available validated alternative to continuous glycemic monitoring. A fixed combination of insulin degludec and aspart (iDegAsp) (commercial name Ryzodeg) was selected for intensification.
According to the observation data, firstly, the feasibility of overcoming clinical inertia and intensifying insulin therapy did not raise any doubts. Secondly, the literature data on the effectiveness of iDegAsp, its safety and convenience of flexible use, as well as its neutral effect on weight were confirmed. In addition, the diary of glycemic variability demonstrated itself as a worthy and accessible tool for a detailed assessment of the quality of glycemic control once again.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


