Сравнительная оценка применения фиксированной комбинации алоглиптина и пиоглитазона и других режимов пероральной сахароснижающей терапии у пациентов с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить клинико-экономическую целесообразность применения фиксированной комбинации пиоглитазона и алоглиптина (препарата Инкресинк) по сравнению с использованием других режимов пероральной сахароснижающей терапии у пациентов с СД 2 типа.
Материал и методы. Была разработана клинико-экономическая модель двухэтапного лечения СД 2 типа: первый этап – применение пероральных сахароснижающих препаратов, второй этап – инсулинотерапия.
Исследование проводили с позиции системы здравоохранения. Учитывались прямые медицинские затраты на пероральные сахароснижающие препараты и инсулинотерапию, самоконтроль уровня глюкозы, мониторинг СД, лечение кардиоваскулярных осложнений СД и гипогликемии.
Горизонт моделирования – десять лет, размер моделируемой когорты – 10 000 пациентов.
Результаты. При десятилетнем горизонте моделирования наибольшие средневзвешенные прямые затраты системы здравоохранения в расчете на одного пациента для терапии комбинацией «метформин + ингибитор дипептидилпептидазы 4» составили 29 593,2 руб./год. Суммарные прямые затраты при использовании комбинации «метформин + пиоглитазон + алоглиптин» оказались на 25% меньше, достигнув 22 246,2 руб./год. По прошествии одного года суммарные затраты в группах «метформин + пиоглитазон + алоглиптин» и «метформин + ингибитор дипептидилпептидазы 4» не различались. В последующем в группе
«метформин + ингибитор дипептидилпептидазы 4» суммарные затраты превысили затраты в группе «метформин + пиоглитазон + алоглиптин». Комбинация «метформин + пиоглитазон + алоглиптин» в отличие от комбинации «метформин + ингибитор дипептидилпептидазы 4» продемонстрировала большую экономическую целесообразность из-за меньшего количества пациентов, переходящих на инсулинотерапию. При этом экономический эффект ощущался уже через год от начала применения.
Заключение. Комбинация «метформин + пиоглитазон + алоглиптин» по сравнению с комбинацией «метформин + ингибитор дипептидилпептидазы 4» является экономически более целесообразной на горизонтах моделирования один год и более.
Цель исследования – оценить клинико-экономическую целесообразность применения фиксированной комбинации пиоглитазона и алоглиптина (препарата Инкресинк) по сравнению с использованием других режимов пероральной сахароснижающей терапии у пациентов с СД 2 типа.
Материал и методы. Была разработана клинико-экономическая модель двухэтапного лечения СД 2 типа: первый этап – применение пероральных сахароснижающих препаратов, второй этап – инсулинотерапия.
Исследование проводили с позиции системы здравоохранения. Учитывались прямые медицинские затраты на пероральные сахароснижающие препараты и инсулинотерапию, самоконтроль уровня глюкозы, мониторинг СД, лечение кардиоваскулярных осложнений СД и гипогликемии.
Горизонт моделирования – десять лет, размер моделируемой когорты – 10 000 пациентов.
Результаты. При десятилетнем горизонте моделирования наибольшие средневзвешенные прямые затраты системы здравоохранения в расчете на одного пациента для терапии комбинацией «метформин + ингибитор дипептидилпептидазы 4» составили 29 593,2 руб./год. Суммарные прямые затраты при использовании комбинации «метформин + пиоглитазон + алоглиптин» оказались на 25% меньше, достигнув 22 246,2 руб./год. По прошествии одного года суммарные затраты в группах «метформин + пиоглитазон + алоглиптин» и «метформин + ингибитор дипептидилпептидазы 4» не различались. В последующем в группе
«метформин + ингибитор дипептидилпептидазы 4» суммарные затраты превысили затраты в группе «метформин + пиоглитазон + алоглиптин». Комбинация «метформин + пиоглитазон + алоглиптин» в отличие от комбинации «метформин + ингибитор дипептидилпептидазы 4» продемонстрировала большую экономическую целесообразность из-за меньшего количества пациентов, переходящих на инсулинотерапию. При этом экономический эффект ощущался уже через год от начала применения.
Заключение. Комбинация «метформин + пиоглитазон + алоглиптин» по сравнению с комбинацией «метформин + ингибитор дипептидилпептидазы 4» является экономически более целесообразной на горизонтах моделирования один год и более.









Введение
Сахарный диабет (СД) представляет собой группу метаболических (обменных) заболеваний, характеризующихся хронической гипергликемией вследствие нарушения секреции инсулина, действия инсулина или обоих этих факторов вместе. Хроническая гипергликемия ассоциирована с повреждением, дисфункцией и недостаточностью различных органов, особенно глаз, почек, нервов, сердца и кровеносных сосудов [1].
Согласно данным Федерального регистра СД, на 1 сентября 2024 г. в России на диспансерном учете состояло 5,265 млн больных, из них 4,86 млн – с СД 2 типа, 293 тыс. – с СД 1 типа, 111 тыс. – с другими типами диабета [2].
Современное управление СД 2 типа подразумевает изменение образа жизни (соблюдение диеты, увеличение физических нагрузок), снижение массы тела, а также прием пероральных сахароснижающих препаратов (ПССП).
Критерием эффективности сахароснижающей терапии является достижение и длительное сохранение целевых значений гликированного гемоглобина (HbA1c). В зависимости от исходного уровня HbA1c для контроля заболевания может назначаться как монотерапия метформином, так и комбинация двух и более ПССП разных фармакологических групп [1].
Серьезной проблемой практической диабетологии является недостижение целей гликемического контроля у значительной части пациентов, в том числе на моно- и двойной комбинированной терапии ПССП. Так, согласно данным Федерального регистра СД, уровень HbA1c выше 7,5% среди получающих только метформин (35,5% всех больных СД 2 типа) выявлен более чем у 18,6%, среди получающих двойную терапию метформином и производными сульфонилмочевины (24,8%) – у 40,4%, среди получающих терапию метформином и ингибиторами дипептидилпептидазы 4 (иДПП-4) (8,2%) – у 30,4%.
Сочетанное применение метформина с иДПП-4 и пиоглитазоном, а также метформина с производными сульфонилмочевины признано рациональным [2]. При этом комбинация иДПП-4 и пиоглитазона обладает рядом преимуществ вследствие положительного влияния и на инсулинорезистентность, и на функцию β-клеток [3]. Известно, что пиоглитазон активирует специфические ядерные рецепторы (γ-рецепторы, активируемые пролифератором пероксисом), что приводит к увеличению чувствительности к инсулину клеток печени, жировой ткани и скелетных мышц. Пиоглитазон уменьшает выработку глюкозы в печени и увеличивает периферическую утилизацию глюкозы при инсулинорезистентности [4]. Раннее начало терапии пиоглитазоном характеризуется хорошим контролем гликемии, длительным эффектом и замедлением прогрессирования СД 2 типа [5]. Кроме того, в проспективных рандомизированных клинических исследованиях PROactive и IRIS пиоглитазон продемонстрировал способность снижать частоту развития больших атеросклеротических событий у пациентов как с СД 2 типа, так и с предиабетом/инсулинорезистентностью и подтвержденными сердечно-сосудистыми заболеваниями, что может быть обусловлено его плейотропными эффектами. Речь, в частности, идет о снижении артериального давления, концентрации провоспалительных цитокинов и протромботических факторов, антиатерогенном воздействии, что способствует улучшению состояния сосудистой стенки, уменьшению объема висцерального жира с мобилизацией жира из печени [6].
Подобная доказательная база делает Инкресинк, в состав которого входит пиоглитазон, самым доступным на сегодняшний день препаратом для болезнь-модифицирующей терапии.
Цель исследования
Целью настоящего исследования стала оценка клинико-экономической целесообразности применения фиксированной комбинации пиоглитазона и алоглиптина (препарата Инкресинк) по сравнению с использованием других режимов пероральной сахароснижающей терапии у пациентов с СД 2 типа.
Материал и методы
При разработке методологии клинико-экономического анализа использовали методические рекомендации Центра экспертизы и контроля качества медицинской помощи [7, 8], государственные стандарты [9, 10], а также руководства по проведению такого рода исследований [11].
При проведении фармакоэкономического анализа методом анализа влияния на бюджет рассчитывали общую сумму прямых медицинских затрат для сравниваемых альтернатив, а также разницу расходов (экономия бюджета/дополнительные затраты бюджета), связанную с применением фиксированной комбинации пиоглитазона и алоглиптина по сравнению с использованием других вариантов сахароснижающей терапии.
Исследование проводили c позиции системы здравоохранения. Рассматривались только прямые медицинские затраты в системе здравоохранения отдельно:
- для бюджета субъекта РФ на осуществление программ льготного лекарственного обеспечения;
- для бюджета системы обязательного медицинского страхования (ОМС) на оказание медицинской помощи.
Горизонт моделирования был выбран равным десяти годам.
Для включения в модель параметров и их значений был проведен систематический поиск клинических исследований фиксированной комбинации «алоглиптин + пиоглитазон», а также исследований пиоглитазона и алоглиптина (табл. 1) [12–15].
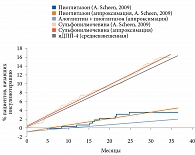
С целью построения кривой, характеризующей долю пациентов, переходящих на инсулинотерапию при применении комбинации «алоглиптин + пиоглитазон», были использованы результаты исследования A. Scheen и соавт. [14]. Аппроксимацию кривых выполняли методом линейной регрессии, оцифровку самих кривых – с применением программы Digitizeit.
Для построения средневзвешенной кривой, характеризующей группу иДПП-4, был проведен систематический поиск клинических исследований препаратов данной группы. В каждом из отобранных исследований осуществляли поиск значения количества пациентов, перешедших на фоне применения комбинации «метформин + иДПП-4» на инсулинотерапию через 12, 24 и 36 месяцев (табл. 2) [16–19].
С учетом ряда допущений и в отсутствие прямых сравнительных рандомизированных клинических испытаний по данным модели построены кривые, характеризующие долю пациентов, переходящих на инсулинотерапию с течением времени, из групп сульфонилмочевины, «алоглиптин + пиоглитазон» и иДПП-4, применявшихся на фоне терапии метформином (рис. 1). Анализ кривых показал, что с каждым месяцем количество пациентов, переходящих на инсулинотерапию в группах «метформин + сульфонилмочевина» и «метформин + иДПП-4», было существенно больше, чем в группе «метформин + пиоглитазон + алоглиптин».
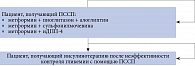
Для проведения клинико-экономических расчетов была построена модель Маркова, схематично представленная на рис. 2.
Моделирование осуществляли на гипотетической когорте из 10 000 пациентов с последующим расчетом средних затрат на одного пациента. Интервал между переходами в модели Маркова был равен одному месяцу. В исследовании A. Scheen и соавт. [14] длительность наблюдения составила 36 месяцев. Однако для целей настоящего исследования длительность наблюдения была увеличена до десяти лет (120 месяцев). Значения количества пациентов, переходящих на инсулинотерапию на горизонте моделирования от 36 до 120 месяцев, были получены путем продления аппроксимированных прямых, представленных на рис. 1.
Частота развития кардиоваскулярных осложнений для сравниваемых в модели групп пациентов приведена в табл. 3 [15, 18–21].
Перечень прямых затрат системы здравоохранения:
- стоимость ПССП (метформин, пиоглитазон + алоглиптин, сульфонилмочевина, иДПП-4) (бюджет субъекта РФ);
- стоимость инсулинотерапии, в том числе тест-полосок и глюкометров для самоконтроля уровня глюкозы (бюджет субъекта РФ);
- затраты на мониторинг состояния пациента с СД 2 типа в течение одного года при условии отсутствия осложнений (бюджет ОМС);
- стоимость лечения и реабилитации при возникновении кардиоваскулярных осложнений (бюджет ОМС).
Стоимость ПССП и препаратов инсулина оценивали по данным Государственного реестра предельных отпускных цен (табл. 4) [4, 14, 16–19, 21, 22].
Затраты на мониторинг состояния пациентов с СД 2 типа, а также на лечение осложнений оценивали в соответствии с Методическими рекомендациями по способам оплаты медицинской помощи ФФОМС [23] и Программой государственных гарантий оказания гражданам Российской Федерации бесплатной медицинской помощи [24].
Стоимость тест-полосок для самоконтроля уровня глюкозы в крови определяли по данным открытых источников интернет-аптек [25, 26].
Результаты
В основном сценарии была оценена стоимость подходов к лечению пациентов целевой группы. Рассчитаны суммарные затраты при применении сравниваемых стратегий. Полученные результаты представлены на рис. 3–6.
При рассмотрении суммарных прямых затрат в расчете на моделируемую когорту пациентов в группе «метформин + иДПП-4» за десять лет они составили 2 959 323 099 руб. В группе «метформин + пиоглитазон + алоглиптин» таковые оказались на 25% ниже – 2 224 617 371 руб.
Разница в основном возникала из-за разной стоимости ПССП, а также инсулинотерапии (рис. 2 и 4). Так, в группе «метформин + пиоглитазон + алоглиптин» затраты на ПССП составили 1 983 001 172 руб. в расчете на целевую популяцию, в то время как в группе «метформин + иДПП-4» соответствующая сумма была на 32,8% меньше – 1 333 609 400 руб. При этом в группе «метформин + иДПП-4» относительно группы «метформин + пиоглитазон + алоглиптин» затраты на инсулинотерапию были в 7,1 раза больше – 1 611 934 671 против 225 489 499 руб. Следует также отметить, что наибольшая стоимость инсулинотерапии зафиксирована при использовании комбинации «метформин + сульфонилмочевина» – 1 696 607 699 руб., что превышает соответствующие затраты в группе «метформин + пиоглитазон + алоглиптин» в 7,5 раза.
При выделении затрат бюджета субъекта РФ и бюджета ОМС большая часть нагрузки приходилась на бюджет субъекта РФ.
Помесячная динамика суммарных затрат нарастающим итогом представлена на рис. 7.
Исходя из данных, представленных на рис. 7, к 12-му месяцу суммарные затраты в группах «метформин + иДПП-4» и «метформин + пиоглитазон + алоглиптин» сравнялись, в последующем в группе «метформин + иДПП-4» они превысили таковые в группе «метформин + пиоглитазон + алоглиптин». Разница в затратах прежде всего обусловлена количеством пациентов, переходящих на инсулинотерапию.
Вероятностный анализ чувствительности выполняли путем многократного изменения значения ключевых параметров модели (изменение стоимости лекарственного препарата и частоты развития осложнений). Анализ чувствительности подтвердил выводы, полученные в основном сценарии.
Обсуждение
Клинико-экономический анализ целесообразности применения разных ПССП при СД 2 типа проведен в условиях экономики РФ не впервые. Большинство ранее выполненных исследований были посвящены сравнительному анализу двух или нескольких ПССП [27] без учета последующего перехода пациента на инсулинотерапию и ее экономической нагрузки. Авторы ряда сравнительных клинико-экономических исследований препаратов инсулина [28–30] рассматривали только этап инсулинотерапии без учета предшествующей терапии ПССП. Таким образом, отличительной особенностью настоящего исследования стала попытка объединить в одном клинико-экономическом анализе затраты как на ПССП, так и на инсулинотерапию, то есть оценить наиболее полно стоимость лечения пациента с СД 2 типа лекарственными средствами. Еще одной особенностью работы является то, что в качестве критерия эффективности был выбран не используемый в большинстве работ уровень гликированного гемоглобина, а такой показатель, как % пациентов, перешедших на инсулинотерапию. Выбранный критерий позволяет провести полноценное моделирование этапов лечения и объединить в одну модель терапию ПССП и инсулинотерапию. Кроме того, он представляется как более интегральный показатель успешности проводимой терапии, поскольку подразумевает не только достижение целевых параметров углеводного обмена, но и косвенную оценку влияния сахароснижающих препаратов на функцию и сохранность пула β-клеток поджелудочной железы.
Важно добавить, что инициация инсулинотерапии в большинстве случаев подразумевает увеличение массы тела, что обусловлено увеличением потребления калорий вследствие повышения аппетита и опасением развития гипогликемии, а также инсулин-индуцированным увеличением безжировой массы тела, связанным с его анаболическими эффектами. Так, в исследовании UKPDS у пациентов с СД 2 типа после перевода на инсулинотерапию масса тела оказалась на 4 кг больше, чем у получавших ПССП [31]. Улучшение контроля гликемии со снижением уровня HbA1c на каждый 1% подразумевало увеличение веса на 2 кг.
Как показано в многочисленных исследованиях, у пациентов с СД 2 типа подобное увеличение массы тела, а также проатерогенные, провоспалительные, прокоагулянтные, митогенные эффекты высокодозовой инсулинотерапии (более 0,6 ЕД/кг) способны привести к повышению кардиоваскулярного и онкологического риска, а также к ухудшению почечных исходов [32–34].
При этом важно учитывать, что, несмотря на установленную дозозависимую связь проводимой инсулинотерапии и неблагоприятных исходов, достижение целевых показателей гликемии в реальной клинической практике нередко подразумевает постоянное возрастание доз, способствующее увеличению веса и новому пересмотру количества вводимого инсулина.
Предотвращение или отсрочка назначения инсулинотерапии имеет огромное клиническое значение, поскольку это будет дополнительно снижать вероятность развития неблагоприятных кардиоваскулярных событий, ассоциированных с применением высоких доз инсулина. Это обстоятельство необходимо учитывать в отношении двойной комбинированной терапии метформином и производным сульфонилмочевины, которая, согласно результатам нашего исследования, существенно чаще способствует переводу на инсулинотерапию, чем тройная комбинированная терапия метформином, алоглиптином и пиоглитазоном. Однако ввиду ее дешевизны и сложности моделирования рисков инсулинотерапии с оценкой непрямых затрат на проведение таковой не представляется возможным корректно соотнести их клинико-экономические показатели.
Таким образом, в настоящем исследовании впервые было показано, что применение на ранних этапах лечения ПССП, способных отсрочить начало инсулинотерапии, имеет значимые клинические преимущества, существенные экономические выгоды, которые, однако, становятся очевидными только на длительных горизонтах планирования.
Выводы
- Непрямое сравнительное исследование показало, что комбинация метформина, пиоглитазона и алоглиптина характеризуется большей эффективностью, выражающейся в наименьшем количестве пациентов, переводимых на инсулинотерапию.
- При горизонте моделирования десять лет наибольшие средневзвешенные прямые затраты в расчете на одного пациента были при применении комбинации «метформин + иДПП-4» (29 593,2 руб./год), а суммарные прямые затраты при использовании комбинации «метформин + пиоглитазон + алоглиптин» оказались на 25% меньше (22 246,2 руб./год).
- По прошествии одного года суммарные затраты в группах «метформин + пиоглитазон + алоглиптин» и «метформин + иДПП-4» оказались одинаковыми, в последующем в группе «метформин + иДПП-4» суммарные затраты превысили таковые в группе «метформин + пиоглитазон + алоглиптин».
- Комбинация «метформин + пиоглитазон + алоглиптин» по сравнению с комбинацией «метформин + иДПП-4» является экономически более целесообразной вследствие меньшего количества пациентов, переходящих на инсулинотерапию, при этом эффект экономии отмечается через год от начала ее применения.
- Двойная комбинированная терапия метформином и производным сульфонилмочевины ассоциирована со значимо более высоким риском перевода на инсулинотерапию, чем тройная комбинированная терапия метформином, пиоглитазоном и алоглиптином. Однако затраты на комбинацию «метформин + сульфонилмочевина» не превышают 4% среднегодовых затрат на одного пациента. Таким образом, применение этих лекарственных препаратов не оказывает влияние на результаты клинико-экономического анализа.
Практические рекомендации
- Комбинация «метформин + пиоглитазон + алоглиптин» характеризуется большей эффективностью по сравнению с другими схемами лечения, что выражается в снижении количества пациентов, переводимых на инсулин.
- Комбинация «метформин + пиоглитазон + алоглиптин» по сравнению с комбинацией «метформин + иДПП-4» является экономически более целесообразной.
- Пациенты, не достигающие гликемического контроля (целевого уровня HbA1c) на фоне монотерапии метформином или двойной комбинированной терапии метформином с производным сульфонилмочевины или метформином с иДПП-4, получат дополнительную пользу от назначения фиксированной комбинации пиоглитазона и алоглиптина (препарата Инкресинк) в дополнение к монотерапии метформином или вместо производного сульфонилмочевины либо иДПП-4 в виде улучшения показателей углеводного обмена и перспективы отсрочки инсулинотерапии.
A.S. Kolbin, A.A. Kurylev, Yu.Ye. Balykina, M.A. Proskurin, V.V. Salukhov
Academician I.P. Pavlov First St. Petersburg State Medical University
Saint-Petersburg State University
Military Medical Academy named after S.M. Kirov
Contact person: Aleksei S. Kolbin, аlex.kolbin@mail.ru
The treatment of diabetes mellitus 2 type (T2DM) includes oral glucose-lowering agents and if non-effective insulin. The later start if insulin is preferrable from the clinical point of view and demonstrates lower disease progression. We were not able to find studies evaluating the economic consequences of as late as possible change from oral glucose-lowering agents to insulin.
Aim – to assess the economic consequences of fixed combination ‘pioglitazone + alogliptin’ (drug Incresync) in comparison with other oral glucose-lowering agents in patients with T2DM.
Material and methods. Health-economic model includes two stages of T2DM therapy: oral glucose-lowering agents and insulin. The study was done from the perspective of healthcare system and accounting for the following direct medical costs: oral glucose-lowering agents, insulin, self-control of blood glucose, T2DM monitoring, treatment of cardiovascular events and hypoglycemia episodes. The cost information was taken from governmental drug price register and medical insurance system. The modelling horizon was 10 years, modelling cohort accounts for 10 000 patients. The cost of regional budget and medical insurance cost we analyzed separately.
Results. At 10 years modeling horizon ‘metformin + inhibitor of dipeptidyl peptidase 4’ showed the highest direct medical costs – 29 593.2 rubles/year. The cost of ‘metformin + pioglitazone + alogliptin’ combination was by 25% lower, amounting to 22 246.2 rubles/year. After 1 year from the start of therapy the total direct medical costs of ‘metformin + inhibitor of dipeptidyl peptidase 4’ and ‘metformin + pioglitazone + alogliptin’ became equal to each other, and then the ‘metformin + inhibitor of dipeptidyl peptidase 4’ stays always higher comparing to ‘metformin + fixed pioglitazone + alogliptin’. ‘Metformin + fixed pioglitazone + alogliptin’ combination demonstrates economic feasibility due to lower number of patients moving to insulin therapy and this effect is visible after 1 year.
Conclusion. ‘Metformin + fixed pioglitazone + alogliptin’ combination comparing to ‘metformin + inhibitor of dipeptidyl peptidase 4’ is more economically feasible at the modelling horizon of 1 year and later.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.