Ангиопротекторный и регенеративный потенциал полипептидного препарата Славинорм при эндотелиальной дисфункции и атеросклеротическом поражении сосудов
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить ангиопротекторную активность препарата Славинорм на моделях in vitro, а также определить его потенциал в терапии атеросклероза.
Материал и методы. Исследование выполнено на клеточных линиях эндотелиоцитов человека и мыши. Оценивалась миграционная, пролиферативная активность клеток на фоне действия цитотоксических факторов и самого препарата, а также влияние Славинорма на клеточный цикл, апоптоз и процесс ангиогенеза.
Результаты. Славинорм стимулирует миграцию эндотелиоцитов, увеличивает активность клеток в формировании новых сосудистых структур, обладает выраженным антиапоптотическим и протективным эффектами. Кроме того, препарат характеризуется регенеративной активностью, позволяет нормализовать клеточный цикл и снижает долю клеток в фазе покоя на фоне действия цитотоксических факторов.
Цель – оценить ангиопротекторную активность препарата Славинорм на моделях in vitro, а также определить его потенциал в терапии атеросклероза.
Материал и методы. Исследование выполнено на клеточных линиях эндотелиоцитов человека и мыши. Оценивалась миграционная, пролиферативная активность клеток на фоне действия цитотоксических факторов и самого препарата, а также влияние Славинорма на клеточный цикл, апоптоз и процесс ангиогенеза.
Результаты. Славинорм стимулирует миграцию эндотелиоцитов, увеличивает активность клеток в формировании новых сосудистых структур, обладает выраженным антиапоптотическим и протективным эффектами. Кроме того, препарат характеризуется регенеративной активностью, позволяет нормализовать клеточный цикл и снижает долю клеток в фазе покоя на фоне действия цитотоксических факторов.




Введение
Атеросклероз представляет собой мультифокальное прогрессирующее заболевание артерий, характеризующееся нарушением обмена липидов, утолщением и потерей эластичности сосудистой стенки. Данная патология является основной причиной развития сердечно-сосудистых заболеваний и одной из основных причин смертности и инвалидизации населения [1].
Главным пусковым механизмом развития атеросклероза считается развитие эндотелиальной дисфункции – системной патологии, связанной с нарушением структуры и секреторной функции эндотелия – монослойной внутренней выстилки кровеносных сосудов. Эндотелий секретирует химические факторы, влияющие на сосудистый тонус, проницаемость сосудистой стенки, агрегацию тромбоцитов, процессы воспаления, активации и угнетения роста сосудов: оксид азота, простациклины (простагландин I2), эндотелиальный гиперполяризующий фактор, эндотелин I, ангиотензин II, тромбоксан [2, 3]. Повреждение эндотелия приводит к дисбалансу между вазоконстрикцией и вазодилатацией, увеличению проницаемости эндотелия, агрегации тромбоцитов, адгезии лейкоцитов и высвобождению цитокинов, что влечет за собой развитие и прогрессирование сосудистой патологии.
Факторами риска развития эндотелиальной дисфункции служат не только биологический возраст человека и его наследственность, но и образ жизни: курение, психоэмоциональный стресс, малоподвижный образ жизни, несбалансированное питание, нарушение режима сна и бодрствования и, как следствие, дислипидемия (гиперхолестеринемия), метаболический синдром, ожирение, сахарный диабет, артериальная гипертензия и др. [4, 5]. Указанные факторы приводят к многочисленным биохимическим и метаболическим изменениям, способствующим повреждению эндотелия сосудов, снижению выживаемости клеток и замедлению регенеративных процессов.
Большие усилия исследователей направлены на поиск средств, влияющих непосредственно на состояние эндотелия [6]. В последнее время особый интерес вызывают препараты на основе регуляторных пептидов, оказывающие патогенетическое действие при эндотелиальной дисфункции. Пептиды образуются из белков во всех тканях и являются одной из самых эволюционно ранних систем регуляции гомеостаза.
Препарат Славинорм, в состав которого входят полипептиды сосудов крупного рогатого скота, запускает каскад метаболических реакций, приводящих к снижению перекисного окисления липидов и нормализации эндотелиальной функции, и потенциально препятствует развитию атеросклероза [7].
Клиническая эффективность препарата Славинорм подтверждена в клинических исследованиях с участием пациентов с облитерирующими заболеваниями артерий нижних конечностей. На фоне терапии отмечалось значимое увеличение дистанции безболевой ходьбы, максимально проходимого расстояния и лодыжечно-плечевого индекса [8].
В настоящем исследовании использовались различные методики оценки функциональности эндотелиальных клеток человека и мыши in vitro на фоне применения препарата Славинорм – способности к миграции и инвазии при формировании новых микрососудов, протективного действия на эндотелиальные клетки при индукции апоптоза и гибели клеток, оценка влияния Славинорма на клеточный цикл. Для повышения значимости полученных результатов в экспериментах использовались различные культуры эндотелиальных клеток человека и мыши.
Материал и методы
Материал
Исследование было выполнено на клеточных линиях:
- эндотелиальные клетки мыши SVEC-4-10 (ATCC, США);
- эндотелиальные клетки человека HUVEC (Lonza, Швейцария), EA.hy926 (ATCC, США).
Для культивирования клеток использовали:
- среду культуральную DMEM (Gibco, США);
- среду культуральную для эндотелиальных клеток EGM-2 (Lonza, Швейцария) с добавлением L-глутамина (Capricorn Scientific, США);
- ЭТС (HyClone, США), PenStrep (Lonza, Швейцария);
- рекомбинантный фактор роста эндотелия сосудов человека – VEGF (Invitrogen, США);
- рекомбинантный фактор роста эндотелия сосудов мыши – VEGF (Invitrogen, США);
- рекомбинантный фактор роста фибробластов человека – FGF (Invitrogen, США).
Препарат Славинорм (ООО «Самсон-Мед», Россия) был предоставлен ООО «ПептидПро» (Москва, Россия). В работе также использовались МТТ (3-[4,5-диметилтиазол-2]-2,5-дифенилтетразол бромид (Sigma-Aldrich, США)), формалин (БиоВитрум, Россия), кристаллический фиолетовый краситель (Хеликон, Россия), аннексин V-FITC (Invitrogen, США), йодид пропидия (Invitrogen, США), антитела к активной каспазе-3 (Invitrogen, США).
Исследование влияния препарата Славинорм на миграционный потенциал эндотелиоцитов в камерах Бойдена
Данный метод применяли для оценки потенциала препарата в индуцировании миграции эндотелиальных клеток для формирования новых микрососудов взамен поврежденных.
Клетки высеивали на поверхность полупроницаемой мембраны камеры Бойдена с порами размером 8 мкм, покрытую полимеризованным матриксом Матригель (1,0 мг/мл) для имитации условий естественного микроокружения, которые допускают миграцию клеток только к аттрактанту, размещенному в нижней камере.
Растворы исследуемого лекарственного средства вносили в камеры Бойдена к суспензии эндотелиальных клеток человека и мыши. В нижнюю камеру вносили 700 мкл среды DMEM с ЭТС 20%. В качестве положительного контроля использовали клетки в культуральной среде без добавления исследуемого лекарственного средства. По истечении 24 часов инкубации клетки фиксировали в формалине 4%, проводили пермеабилизацию клеток 0,1% Tween 20 в PBS и окрашивали кристаллическим фиолетовым красителем. Результаты ингибирования инвазивного потенциала оценивали как отношение количества клеток в опытных группах к количеству клеток группы интактного контроля.
Исследование миграционной активности эндотелиальных клеток
Определение блокирования миграционной активности проводили на культурах эндотелиальных клеток человека и мыши в 24-луночных культуральных планшетах. С помощью наконечника удаляли монослой клеток прямоугольной формы в центре каждой лунки, чтобы обеспечить пространство для миграции клеток и повторного формирования монослоя. Исследуемое вещество разводили в полной среде (со стандартным содержанием сыворотки) до исследуемых концентраций и вносили в лунки планшета. В качестве положительного контроля использовали клетки в полной культуральной среде. По окончании инкубации планшеты промывали фосфатно-солевым буфером (PBS) дважды и фиксировали формалином 4%. После фиксации клеток монослой дважды отмывали в PBS и окрашивали с помощью кристаллического фиолетового красителя.
После окраски монослой клеток дважды отмывали в PBS и делали серию микрофотографий области «раны» на инвертированном микроскопе с фотокамерой. Результаты ингибирования миграционной активности оценивали как процент прироста мигрирующих клеток в опыте по отношению к проценту прироста клеток.
Определение уровня активной каспазы-3 методом проточной цитометрии
Гибель эндотелиоцитов на фоне нарушения транспорта кислорода преимущественно происходит по механизму апоптоза (реже – некроза) и приводит к дисфункции эндотелия [9]. Активация каспазы-3 является основным этапом и индикатором индукции клеточного апоптоза. Протеолитический фермент определяли окрашиванием эндотелиальных клеток человека и мыши флуоресцентным конъюгатом антител к активной каспазе-3. К клеточной суспензии однократно добавляли цисплатин (индуктор повреждения клеточной ДНК), H2O2 (индуктор клеточного окислительного повреждения) и препарат Славинорм, а также их комбинации. Клетки инкубировали при 37 °C в течение 24 часов.
Клетки переносили из культурального планшета в пробирки для проточной цитометрии, пермеабилизировали клетки с помощью 0,1% Tween 20 в PBS, отмывали и добавляли в каждую пробирку по 5 мкл флуоресцентного конъюгата антител к активной каспазе-3 с фикоэритрином или соответствующие изотипические антитела, инкубировали на льду в течение 30 минут. Клетки промывали буфером FACS (PBS, 0,2% BSA, 10 мМ азида натрия) и оценивали количество клеток с экспрессией активной каспазы-3.
Определение уровня апоптоза, гибели и влияния на клеточный цикл эндотелиальных клеток
Клеточные линии SVEC-4-10, HUVEC и EA.hy926 (эндотелиальные клетки мыши и человека) высаживали по 2 × 105 на шестилуночные планшеты в полной среде. Через 24 часа для оценки протективных свойств исследуемого препарата в культуру клеток добавляли 5 мкM H2O2 либо 3 мкг/мл цисплатина (cis-Pt) или в комбинации с 50 мкг/мл Славинорма и инкубировали в течение 24 часов.
Для оценки индукции клеток на ранний и поздний апоптоз использовали коммерческий набор Annexin-V FITC Apoptosis Kit. После инкубации клеток с препаратами их центрифугировали, осадок ресуспендировали в 100 мкл PBS, добавляли раствор, содержащий пропидия йодид и аннексин V. Клетки инкубировали при комнатной температуре в темноте в течение 15 минут, затем добавляли 350–400 мкл связывающего буфера для остановки реакции. Анализ данных (не менее 10 000 событий) проводили на проточном цитофлуориметре ACEA NovoCyte с использованием программного обеспечения NovoExpress.
Для анализа клеточного цикла после инкубации с препаратами клетки промывали и снимали с планшетов раствором Версена. Осадок клеток ресуспендировали в 400 мкл буфера, содержащего 50 мкг/мл пропидия йодида, инкубировали в темноте при комнатной температуре в течение 15 минут. Флуоресценцию пропидия йодида измеряли на проточном цитометре ACEA NovoCyte, а распределение клеток по G0 (фаза покоя), G1 (фаза начального роста), S (фаза удвоения молекул ДНК), G2 (премитотическая фаза роста), M-фазам (непосредственно митоз) клеточного цикла анализировали путем определения относительного содержания ДНК.
Изучение влияния препарата на способность эндотелиальных клеток формировать сосудоподобные структуры в 3D-культуре
Анализ формирования сосудоподобных структур (СПС) является одним из наиболее широко используемых анализов in vitro для моделирования стадии реорганизации ангиогенеза и тестирования новых препаратов с потенциальной ангиогенной активностью.
Для проведения исследования 24-луночный культуральный планшет покрывали матриксом Матригель (8,7 мг/мл) и инкубировали в течение часа при комнатной температуре для его полимеризации. Эндотелиальные клетки (5 × 105 клеток/мл) человека и мыши инкубировали в культуральной среде с добавлением нецитотоксических концентраций испытуемых соединений или их комбинации в течение 30 минут при температуре 37 ºС. Затем клетки наносили на лунки, покрытые матриксом Матригель, и инкубировали в СО2-инкубаторе в течение восьми часов. В качестве положительного контроля использовали клетки, инкубируемые в культуральной среде без добавления испытуемого объекта с VEGF/FGF.
По окончании инкубации делали серию фотоснимков образовавшейся сети СПС цифровой фотокамерой и оценивали количество замкнутых сегментов СПС, длину СПС из эндотелиальных клеток в составе замкнутой сети с помощью программы ImageJ v.1.51.
Результаты
Исследование влияния препарата Славинорм на миграционный потенциал эндотелиоцитов в камерах Бойдена
Сокультивирование эндотелиальных клеток человека HUVEC c 5 мкг/мл цисплатина вызывало статистически значимое снижение количества клеток, прошедших через мембрану, – 26,9% от контрольной группы (р < 0,01) (рис. 1). Сокультивирование эндотелиальных клеток человека HUVEC c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило поддержать количество клеток на уровне 47,7% (p < 0,01) от уровня интактной группы. Аналогичные изменения происходили и при сокультивировании HUVEC c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – снижение количества клеток, прошедших через мембрану под действием 5 мкМ H2O2 (24,2% от контроля; р < 0,01), и восстановление количества эндотелиальных клеток при сокультивировании в комбинации с 50 мкг/мл Славинорма (41,3% от контроля; р < 0,01).
Сокультивирование эндотелиальных клеток человека линии EA.hy926 c 5 мкг/мл цисплатина вызывало статистически значимое снижение количества клеток, прошедших через мембрану, в поле зрения по сравнению с количеством клеток в контрольной группе – 24,1% (р < 0,01). Сокультивирование эндотелиальных клеток человека EA.hy926 c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило частично восстановить количество клеток, прошедших через мембрану (41,1% от контроля; p < 0,01). Аналогичные изменения наблюдались и при сокультивировании EA.hy926 c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – снижение количества эндотелиальных клеток, прошедших через мембрану под действием 5 мкМ H2O2 (23,8% от контроля; р < 0,01), и восстановление их количества при сокультивировании в комбинации с 50 мкг/мл Славинорма (38,6% от контроля; р < 0,01).
Культивирование эндотелиальных клеток мыши SVEC-4-10 в присутствии 5 мкг/мл цисплатина вызывало статистически значимое снижение количества клеток, прошедших через мембрану, в поле зрения по сравнению с количеством клеток в контрольной группе – 21,9% (р < 0,01). Сокультивирование эндотелиальных клеток мыши SVEC-4-10 c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило поддержать количество клеток, прошедших через мембрану, на уровне 53,7% (p < 0,01) от интактной группы. Аналогичные изменения отмечались и при сокультивировании SVEC-4-10 c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – снижение количества клеток, прошедших через мембрану, под действием 5 мкМ H2O2 (20,3% от контроля; р < 0,01) и восстановление их количества при сокультивировании в комбинации с 50 мкг/мл Славинорма (45,0% от контроля; р < 0,01).
Таким образом, Славинорм увеличивает активность эндотелиоцитов в формировании новых сосудистых структур, о чем свидетельствует увеличение количества клеток, мигрирующих через мембрану в камере Бойдена даже в присутствии цитотоксических факторов.
Исследование миграционной активности эндотелиальных клеток
Анализ методом «заживления раны» позволяет измерить миграцию эндотелиоцитов при удалении монослоя клеток. Созданная область «раны» стимулирует различные клеточные реакции, в основном коллективную миграцию клеток. Данный метод имитирует процесс повреждения и регенерации эндотелия, позволяя оценить выраженность миграции эндотелиальных клеток в зону повреждения.
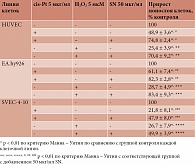
Сокультивирование эндотелиальных клеток человека HUVEC c 5 мкг/мл цисплатина вызывало статистически значимое снижение миграционной активности клеток по сравнению с контрольной группой – 48,9% (р < 0,01) (таблица). Сокультивирование эндотелиальных клеток человека HUVEC c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило увеличить миграционную активность клеток (74,8% от контроля; p < 0,01). Аналогичные изменения отмечались и при сокультивировании HUVEC c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – снижение миграционной активности клеток под действием 5 мкМ H2O2 (25,4% от контроля; р < 0,01) и восстановление количества эндотелиальных клеток при сокультивировании в комбинации с 50 мкг/мл Славинорма (70,4% от контроля; р < 0,01).
Сокультивирование эндотелиальных клеток человека линии EA.hy926 c 5 мкг/мл цисплатина вызывало статистически значимое снижение миграционной активности клеток по сравнению с контрольной группой – 61,1% (р < 0,01). Сокультивирование эндотелиальных клеток человека EA.hy926 c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило увеличить миграционную активность клеток (82,3%; p < 0,01). Аналогичные изменения наблюдались и при сокультивировании EA.hy926 c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – снижение миграционной активности клеток под действием 5 мкМ H2O2 (28,7%; р < 0,01) и восстановление при их сокультивировании в комбинации с 50 мкг/мл Славинорма (83,4%; р < 0,01).
Культивирование эндотелиальных клеток мыши SVEC-4-10 в присутствии 5 мкг/мл цисплатина вызывало статистически значимое снижение миграционной активности клеток по сравнению с контрольной группой – 21,8% (р < 0,01). Сокультивирование эндотелиальных клеток мыши SVEC-4-10 c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма восстанавливает миграционную активность клеток (47,9%; p < 0,01). При сокультивировании SVEC-4-10 c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма имело место снижение миграционной активности клеток под действием 5 мкМ H2O2 (26,7%; р < 0,01), при сокультивировании в комбинации с 50 мкг/мл Славинорма – увеличение (49,9%; р < 0,01).
Определение уровня активной каспазы-3 методом проточной цитометрии
Препарат Славинорм уменьшал количество проапоптотической активной каспазы-3 эндотелиальных клеток человека (HUVEC, EA.hy926) и мыши (SVEC-4-10) в присутствии индукторов повреждения 5 мкг/мл цисплатина и 5 мкМ H2O2. Для клеточной линии HUVEC Славинорм снизил количество клеток cCasp3+ с 4,41 до 1,27% при использовании цисплатина и с 3,80 до 1,05% на фоне применения H2O2 (рис. 2). Сходные изменения были установлены для клеточной линии EA.hy926: количество клеток cCasp3+ снизилось с 7,90 до 1,85% на фоне применения цисплатина и с 8,31 до 1,88% при использовании H2O2. Для клеточной линии SVEC-4-10 Славинорм снизил количество клеток cCasp3+ с 15,17 до 6,26% при применении цисплатина и с 32,93 до 15,07% при использовании H2O2. Таким образом, Славинорм показал антиапоптотический эффект, что свидетельствует о протективном действии препарата на клетки эндотелия в условиях патологии.
Определение уровня апоптоза, гибели и клеточного цикла эндотелиальных клеток
Для клеточной линии HUVEC количество живых клеток уменьшилось с 98,23 до 44,70% при применении цисплатина и до 57,83% при использовании H2O2. Введение Cлавинорма в среду культивирования позволило восстановить содержание живых клеток до 74,64 и 90,58% соответственно (рис. 3). Сходные изменения наблюдались и в клеточной линии EA.hy926: количество живых клеток снизилось с 97,27 до 42,94% при использовании цисплатина и до 49,82% на фоне применения H2O2. Введение Cлавинорма в среду культивирования позволило восстановить содержание живых клеток до 63,22 и 75,79% соответственно.
Для клеточной линии SVEC-4-10 количество живых клеток снижалось с 97,13 до 6,17% при применении цисплатина и до 62,92% при применении H2O2. Введение Cлавинорма в среду культивирования позволило восстановить содержание живых клеток до 41,04 и 87,47% соответственно.
Во время фазы G0 клетка находится в состоянии покоя, а в фазе G1 клетка начинает увеличиваться в размерах, синтезировать мРНК и белки и готовиться к митозу. Для клеточной линии SVEC-4-10 доля клеток в состоянии покоя увеличивалась с 25,29 до 49,10% при использовании цисплатина и до 36,72% на фоне применения H2O2. Введение Славинорма в среду культивирования позволило увеличить количество клеток, переходящих в фазу подготовки к митозу, что выразилось в снижении доли клеток в фазе покоя при сокультивировании с комбинацией Славинорма и цисплатина до 27,73 и до 30,20% – при сокультивировании с комбинацией Славинорма и H2O2 (рис. 4). Полученный результат свидетельствует о том, что меньшее количество клеток остается в фазе покоя и соответственно больший процент эндотелиоцитов активируется для участия в процессах регенерации.
Для клеточной линии HUVEC количество клеток в фазе покоя увеличивалось с 41,06 до 58,72% при использовании цисплатина и до 62,90% на фоне применения H2O2. Введение Славинорма в среду культивирования позволило нормализовать распределение клеток по фазам клеточного цикла, что выразилось в снижении доли клеток в фазе покоя до 48,79% при сокультивировании с цисплатином и до 52,57% при сокультивировании с H2O2 соответственно.
Изучение влияния препарата на способность эндотелиальных клеток формировать СПС в 3D-культуре
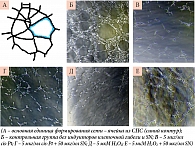
При культивировании на матриксе Матригель эндотелиальные клетки человека и мыши претерпевают дифференцировку и изменение морфологии, формируя сеть из СПС. Контрольная сеть из СПС, сформированная в присутствии VEGF и FGF, отличается большим количеством структурных элементов небольшого размера, имеющих стенки из нескольких слоев эндотелиальных клеток, а также большим количеством узлов ветвления. Сокультивирование эндотелиальных клеток с индукторами повреждения 5 мкг/мл цисплатина или 5 мкМ H2O2 вызывает нарушения формирования сети из СПС, заключающиеся в упрощении ее структуры, увеличении количества СПС вне сети, снижении количества структурных элементов сети – «замкнутых» ячеек из СПС, увеличении размеров ячеек, уменьшении количества узлов ветвления.
Сокультивирование эндотелиальных клеток человека HUVEC c 5 мкг/мл цисплатина вызывало статистически значимое снижение количества структурных элементов сети в поле зрения по сравнению с контрольной группой – 36,4% (рис. 5). Сокультивирование эндотелиальных клеток человека HUVEC c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило частично восстановить структуру сети из СПС (60,5% от контроля). Аналогичные изменения отмечались и при сокультивировании HUVEC c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – снижение количества структурных элементов сети под действием 5 мкМ H2O2 (39,6%) и восстановление этой структуры при сокультивировании в комбинации с 50 мкг/мл Славинорма (54,1%).
Сокультивирование эндотелиальных клеток человека линии EA.hy926 c 5 мкг/мл цисплатина приводило к статистически значимому снижению количества структурных элементов сети в поле зрения по сравнению с контрольной группой – 33,2%. Сокультивирование эндотелиальных клеток человека EA.hy926 c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило частично восстановить структуру сети из СПС (51,6% от контроля). Аналогичные изменения наблюдались при сокультивировании EA.hy926 c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – нарушение структуры сети под действием 5 мкМ H2O2 (36,1%) и восстановление при сокультивировании в комбинации с 50 мкг/мл Славинорма (47,3%).
Культивирование эндотелиальных клеток мыши SVEC-4-10 в присутствии 5 мкг/мл цисплатина вызывало статистически значимое снижение количества структурных элементов сети в поле зрения по сравнению с контрольной группой – 28,2%. Сокультивирование эндотелиальных клеток мыши SVEC-4-10 c 5 мкг/мл цисплатина и 50 мкг/мл Славинорма позволило восстановить структуру сети из СПС (45,6% от контроля). Аналогичные изменения имели место при сокультивировании SVEC-4-10 c 5 мкМ H2O2 и в комбинации с 50 мкг/мл Славинорма – нарушение структуры сети под действием 5 мкМ H2O2 (34,1%) и восстановление при сокультивировании в комбинации с 50 мкг/мл Славинорма (48,8%).
Таким образом, препарат Славинорм оказывает протективное действие на процесс формирования сети СПС из эндотелиальных клеток человека и мыши в присутствии индукторов повреждения.
Обсуждение
Атеросклероз как системное сосудистое поражение начинается с повреждения клеток внутренней выстилки сосуда и формирования эндотелиальной дисфункции. В области повреждения запускается процесс клеточной адгезии. Одновременно частицы липопротеинов проникают в субэндотелиальное пространство, окисляются и становятся цитотоксическими, провоспалительными и проатерогенными. Простой адгезии к эндотелию недостаточно, чтобы переносимые кровью моноциты попали в очаг поражения. Необходимо воздействие хемоаттрактантов, таких как окисленные липопротеины низкой плотности и МСР-1 (моноцитарный хемотаксический фактор-1), рецепторы к которому присутствуют у моноцитов и макрофагов. Внутри интимы созревшие макрофаги поглощают атерогенные липопротеины рецептор-зависимым путем, трансформируясь в пенистые клетки. Переполненные атерогенными липопротеинами макрофаги погибают и способствуют формированию некротического, богатого липидами ядра бляшки. Данный патологический механизм приводит к сужению просвета сосуда, нарушая нормальный кровоток [10].
Таким образом, атерогенез запускается в момент повреждения и последующей гибели эндотелиальной клетки. Согласно результатам проведенных исследований, препарат Славинорм на основе регуляторных пептидов восстанавливает регенеративную способность эндотелиоцитов в условиях окислительного стресса и воздействия цитотоксических факторов, нормализуя миграцию клеток, подавляя процесс апоптоза и увеличивая количество живых эндотелиоцитов. Кроме того, добавление препарата Славинорм в среду культивирования позволяет нормализовать распределение эндотелиальных клеток по стадиям клеточного цикла: снижается доля клеток в G0/G1-точке – фазе покоя, что свидетельствует о стимуляции к митотическому делению большего количества клеток.
Атеросклероз характеризуется прогрессирующим течением. Как правило, к моменту проявления клинических симптомов патология уже имеет системный характер. Как показали результаты данного исследования, Славинорм поддерживает процесс инвазии эндотелиальных клеток через полупроницаемую мембрану в присутствии индукторов повреждения, а также стимулирует миграцию эндотелиальных клеток для формирования сети из СПС. Исходя из этих данных, можно предположить, что на фоне окислительного стресса и глубокого повреждения эндотелиальной ткани препарат запускает процесс неоангиогенеза. Следует отметить, что СПС не являются сосудами как таковыми: они не имеют просвета и состоят из клеточного, эндотелиального слоя. Однако способность стимулировать образование таких структур свидетельствует о наличии у препарата специфических ангиотропных свойств.
В клинических исследованиях Славинорм продемонстрировал благоприятный профиль безопасности: частота развития нежелательных явлений у пациентов с заболеваниями артерий нижних конечностей группы Славинорма статистически значимо не отличалась от аналогичного показателя в группе плацебо (p = 0,59983) [8]. Согласно данным настоящего исследования, Славинорм не стимулирует гиперпластических процессов в сосудистой стенке. Интимальная гиперплазия характеризуется утолщением сосудистой стенки за счет гладкомышечных клеток и богатого протеогликанами внеклеточного матрикса, расположенного между эндотелием и внутренней эластичной пластинкой. Для индукции интимальной гиперплазии необходима инициация пролиферации гладкомышечных клеток [11, 12]. В данном исследовании проводилась сравнительная оценка влияния препарата на пролиферативную активность культуры клеток миоцитов мыши линии C2C12. Установлено, что Славинорм не вызывает индукцию пролиферации миоцитов в применяемых концентрациях.
Полученные данные подтверждают патогенетический механизм действия препарата при атеросклерозе и его ангиопротекторные свойства. В настоящее время препарат зарегистрирован для терапии перемежающейся хромоты у пациентов с заболеваниями артерий нижних конечностей. Однако, учитывая системный характер атеросклероза, перспективным представляется дальнейшее изучение применения Славинорма для лечения данного заболевания [13].
Перспективной представляется и возможность исследования эффективности препарата при ковид-ассоциированном эндотелиите, воспалении внутренней оболочки кровеносных сосудов, характеризующемся острым повреждением эндотелиальных клеток [14].
Выводы
Препарат Славинорм на культурах эндотелиальных клеток человека и мыши демонстрирует специфическую ангиопротекторную и ангиогенную активность. Полученные результаты обосновывают высокую перспективность патогенетического применения препарата при системном заболевании – атеросклеротическом поражении артериальных сосудов.
Yu.A. Khochenkova, D.A. Khochenkov, PhD, K.V. Korzhova, PhD, Ye.Yu. Kazharskaya, PhD, Yu.S. Machkova, T.A. Sidorova, PhD
N.N. Blokhin National Medical Research Center of Oncology
Togliatti State University
PeptidPRO LLC, Moscow
Contact person: Ksenia V. Korzhova, k.korzhova@peptidpro.com
Background. Currently, the lack of effective drugs for pharmacotherapy of endothelial dysfunction in atherosclerotic vascular lesions remains a pressing problem for clinicians. In this regard, the development of drugs with angioprotection and antiatherosclerotic activity is relevant.
Оbjective. To evaluate angioprotective activity of the drug Slavinorm on models in vitro, as well as to identify its potential in atherosclerosis therapy.
Material and methods. The study was carried out on human and mouse endotheliocyte cell lines. The migratory and proliferative cell activity was assessed against the action of cytotoxic factors and the drug itself, as well as the effect of Slavinorm on the cell cycle, apoptosis and angiogenesis.
Results. Slavinorm stimulates the migration of endotheliocytes, increases cell activity to form new vascular structures, has pronounced antiapoptotic and protective effects. In addition, the drug has regenerative activity, allows to normalize the cell cycle and reduces the proportion of cells in the resting phase against the action of cytotoxic factors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.