Антропометрические и биоимпедансометрические предикторы нутритивной недостаточности у больных раком пищевода
- Аннотация
- Статья
- Ссылки
- English
Цель. Определить антропометрические и биоимпедансометрические предикторы нутритивной недостаточности у больных раком пищевода с использованием метода логистической регрессии.
Материал и методы. Обследованы 106 пациентов с диагнозом рак пищевода в период за 2023–2024 гг. Скрининг нутритивного статуса (или недостаточности питания) проводили по шкале NRS-2002 (Nutritional Risk Screening). Степень недостаточности питания определяли с использованием показателей сывороточного альбумина и общего белка, абсолютных лимфоцитов, значения индекса массы тела (ИМТ) и дефицита массы тела. При антропометрическом обследовании пациентов измеряли рост и массу тела, обхват талии и бедер, рассчитывали ИМТ. Для комплексной оценки нутритивного статуса всем обследуемым пациентам проводился биоимпедансометрический анализ на аппаратно-программном комплексе АВС-01 «Медасс». Проведена статистическая обработка полученных результатов. Для выявления антропометрических и биоимпедансометрических показателей – предикторов нутритивной недостаточности у больных раком пищевода использовался метод множественного логистического регрессионного анализа. Проверка значимости модели осуществлялась при помощи критерия χ2. При значении р < 0,05 гипотеза о незначимости модели отвергалась. Соответствие модели использованным данным характеризовали с помощью критерия согласия Хосмера – Лемешева. При р > 0,05 принималась гипотеза о согласованности модели. Чувствительность и специфичность полученных моделей оценивалась при помощи ROC-анализа. Для анализа корреляционной связи между исследуемыми признаками были использованы коэффициент корреляции Пирсона и коэффициент корреляции Спирмена.
Результаты. При первичном обследовании нутритивная недостаточность была выявлена у 42,5% пациентов. Выявлены статистически значимые корреляции между нутритивной недостаточностью, антропометрическими показателями (ИМТ, обхват талии и бедер) и составом тела. Методом множественной логистической регрессии была разработана предиктивная модель (AUC = 0,864), демонстрирующая очень хорошее качество прогнозирования нутритивной недостаточности. Значимыми предикторами стали фазовый угол, уровень общего белка, объем внеклеточной жидкости, основной обмен, возраст и диаметр плеч. Модель обладает специфичностью 82,0% и чувствительностью 75,6%.
Заключение. Нутритивная недостаточность является распространенным осложнением рака пищевода. Разработанная прогностическая модель на основе антропометрических и биоимпедансометрических показателей позволяет с высокой точностью выявлять пациентов группы риска для своевременного начала нутритивной поддержки.
Цель. Определить антропометрические и биоимпедансометрические предикторы нутритивной недостаточности у больных раком пищевода с использованием метода логистической регрессии.
Материал и методы. Обследованы 106 пациентов с диагнозом рак пищевода в период за 2023–2024 гг. Скрининг нутритивного статуса (или недостаточности питания) проводили по шкале NRS-2002 (Nutritional Risk Screening). Степень недостаточности питания определяли с использованием показателей сывороточного альбумина и общего белка, абсолютных лимфоцитов, значения индекса массы тела (ИМТ) и дефицита массы тела. При антропометрическом обследовании пациентов измеряли рост и массу тела, обхват талии и бедер, рассчитывали ИМТ. Для комплексной оценки нутритивного статуса всем обследуемым пациентам проводился биоимпедансометрический анализ на аппаратно-программном комплексе АВС-01 «Медасс». Проведена статистическая обработка полученных результатов. Для выявления антропометрических и биоимпедансометрических показателей – предикторов нутритивной недостаточности у больных раком пищевода использовался метод множественного логистического регрессионного анализа. Проверка значимости модели осуществлялась при помощи критерия χ2. При значении р < 0,05 гипотеза о незначимости модели отвергалась. Соответствие модели использованным данным характеризовали с помощью критерия согласия Хосмера – Лемешева. При р > 0,05 принималась гипотеза о согласованности модели. Чувствительность и специфичность полученных моделей оценивалась при помощи ROC-анализа. Для анализа корреляционной связи между исследуемыми признаками были использованы коэффициент корреляции Пирсона и коэффициент корреляции Спирмена.
Результаты. При первичном обследовании нутритивная недостаточность была выявлена у 42,5% пациентов. Выявлены статистически значимые корреляции между нутритивной недостаточностью, антропометрическими показателями (ИМТ, обхват талии и бедер) и составом тела. Методом множественной логистической регрессии была разработана предиктивная модель (AUC = 0,864), демонстрирующая очень хорошее качество прогнозирования нутритивной недостаточности. Значимыми предикторами стали фазовый угол, уровень общего белка, объем внеклеточной жидкости, основной обмен, возраст и диаметр плеч. Модель обладает специфичностью 82,0% и чувствительностью 75,6%.
Заключение. Нутритивная недостаточность является распространенным осложнением рака пищевода. Разработанная прогностическая модель на основе антропометрических и биоимпедансометрических показателей позволяет с высокой точностью выявлять пациентов группы риска для своевременного начала нутритивной поддержки.

Введение
Рак пищевода является одним из самых неблагоприятных злокачественных новообразований и по данным Международного агентства по изучению рака (International Agency for Research on Cancer, IARC) занимает одиннадцатое место в структуре распространенности среди всех онкологических заболеваний и седьмое место по частоте причин смерти от рака во всем мире. На его долю приходится 2,6% всех новых случаев злокачественных опухолей и 4,6% случаев смерти от рака [1, 2]. Выделяют два основных подтипа заболевания: плоскоклеточный рак пищевода и аденокарциному пищевода, которые развиваются из различных предшествующих поражений и имеют различные факторы риска и молекулярные пути канцерогенеза [3–5]. Улучшение методов диагностики, совершенствование методов лечения рака пищевода за последние два десятилетия привели к значимому прогрессу в лечении заболевания [6]. Однако смертность от рака пищевода остается высокой [7].
Нутритивная недостаточность является одним из наиболее частых и клинически значимых паранеопластических синдромов у больных раком пищевода [8, 9]. Патогенез недостаточности питания представляет собой многокомпонентный процесс, в основе которого лежит сочетанное воздействие алиментарных, метаболических и ятрогенных факторов, формирующих развитие синдрома анорексии-кахексии у онкологических больных. Первичным звеном в развитии нутритивного дефицита является снижение количества потребляемой пищи, обусловленное механической обструкцией пищевода, наличием дисфагии. Ключевым патогенетическим элементом является прогрессирующая потеря скелетной мускулатуры и жировой ткани. Важную роль в патогенезе нутритивной недостаточности отводят системному воспалению: опухоль и микроокружение опухоли продуцируют провоспалительные цитокины (фактор некроза опухоли α (TNF-α), интерлейкин (ИЛ) 1, ИЛ-6, интерферон γ (IFN-γ)). Эти медиаторы напрямую воздействуют на центральную нервную систему, угнетая аппетит в гипоталамусе и запускают системную воспалительную реакцию. Под влиянием цитокинов и опухолевых факторов происходит катаболическая перестройка обмена веществ [10, 11].
Нутритивная недостаточность оказывает негативное влияние на переносимость химиолучевой, противоопухолевой лекарственной терапии и может являться непосредственной причиной отказа от специализированного лечения у больных раком пищевода [12, 13]. Белково-энергетические нарушения и дефицит мышечной массы (саркопения) коррелируют с неблагоприятными исходами у пациентов, перенесших радикальное оперативное лечение по поводу рака пищевода [14, 15].
Оценка нутритивного статуса у больных раком пищевода проводится на этапе установления диагноза. Однако даже при отсутствии нарушений в пищевом статусе при первичной оценке, нутритивную недостаточность диагностируют в процессе лечения рака пищевода, что приводит к снижению толерантности к противоопухолевому лечению и качества жизни [16, 17]. В связи с этим объективная и своевременная оценка нутритивного статуса приобретает первостепенное значение. Помимо традиционных методов, таких как анализ антропометрических и лабораторных показателей, все более востребованной становится биоимпедансометрия, позволяющая получить объективные данные о составе тела [18, 19].
Цель нашего исследования – определить антропометрические и биоимпедансометрические предикторы нутритивной недостаточности у больных раком пищевода.
Материал и методы
Исследование проведено на базе торакоабдоминального отделения поликлиники Красноярского краевого онкологического диспансера в период 2023–2024 гг. В исследование включено 106 больных первичным раком пищевода (83 мужчины и 23 женщины в возрасте 39–83 лет), которым планировалось специализированное лечение (химиолучевая терапия, радикальное оперативное лечение, противоопухолевая лекарственная терапия). Все пациенты подписали добровольное информированное согласие на участие в исследовании. Всем пациентам проводили скрининг недостаточности питания по шкале NRS-2002 (Nutritional Risk Screening) [20]. Степень тяжести нутритивной недостаточности оценивалась на основании лабораторных и антропометрических показателей (табл. 1) [21].
Антропометрическое обследование включало измерение роста и массы тела, обхвата талии и бедер, диаметра плеч, грудной клетки, таза. На основании полученных показателей рассчитывали индекс массы тела и индекс полового диморфизма (ИПД) по Таннеру с определением морфотипа телосложения (андроморфия, мезоморфия,
гинекоморфия).
Всем обследуемым пациентам проводилась биоимпедансометрия на аппарате «Медасс» ABC-01-036 с определением показателей компонентного состава тела и метаболических параметров: абсолютной жировой массы (кг), тощей массы (кг), активной клеточной массы и ее доли (кг, %), скелетно-мышечной массы и ее доли (кг, %), удельного основного обмена (ккал/м2/сут), основного обмена (ккал/сут), общей жидкости (кг), внеклеточной жидкости (кг), величины фазового угла
в градусах.
Проведена статистическая обработка полученных результатов с использованием метода множественного логистического регрессионного анализа. Математически модель логистической регрессии представляет собой зависимость логарифма шанса наступления прогнозируемого события (логита) от линейной комбинации факторных переменных. Соответственно, вероятность наступления прогнозируемого события может быть представлена следующим уравнением:
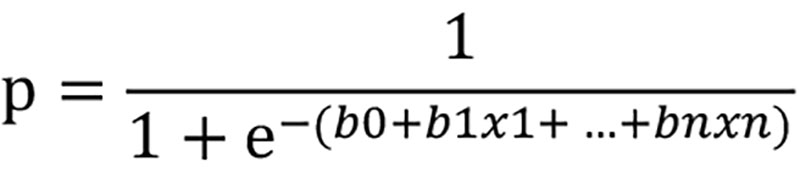 ,
,
где
р – вероятность прогнозируемого события;
е – математическая константа 2,72;
b0 – константа модели;
b1 – коэффициент при предикторной переменной х1, показывающий изменение логарифмических шансов, вызванное единичным изменением независимых переменных;
n – порядковый номер предиктора, включенного в уравнение.
В качестве отклика в моделях рассматривалась бинарная переменная, где 0 – принадлежность пациента к контрольной группе (без нутритивной недостаточности), 1 – принадлежность к группе пациентов с нутритивной недостаточностью. Построение логистической регрессионной модели осуществлялось методом пошагового включения прогностических факторов с определением минимального набора предикторов по оценке значения коэффициента детерминации R2, показывающего долю влияния всех предикторов модели на дисперсию зависимой переменной. Проверка значимости модели осуществлялась при помощи критерия χ2. При значении р < 0,05 гипотеза о незначимости модели отвергалась.
Интерпретация параметров логистической регрессии производилась на основе величины exp(b), соответствующей отношению шансов наступления прогнозируемого события к вероятности его отсутствия (OR). При положительном коэффициенте b – значение exp(b) превышает 1 и шансы наступления прогнозируемого события возрастают.
Отрицательный коэффициент b и величина
exp(b) < 1 указывают на снижение шансов.
Соответствие модели использованным данным характеризовали с помощью критерия согласия Хосмера – Лемешева. При р > 0,05 принималась гипотеза о согласованности модели. Чувствительность и специфичность полученных моделей оценивались при помощи ROC-анализа. Количественная интерпретация результатов проводилась по ROC-кривым с оценкой показателя AUC (Area under ROC curve – площадь под ROC-кривой). Значение площади от 0,9 до 1 соответствует отличному качеству модели; 0,8–0,9 – очень хорошему; 0,7–0,8 – хорошему; 0,6–0,7 – среднему; 0,5–0,6 – неудовлетворительному.
Для анализа линейной связи между количественными показателями, распределение которых соответствовало нормальному закону, использовали коэффициент корреляции Пирсона. Сила корреляции интерпретировалась согласно общепринятым критериям: r < 0,3 – слабая, 0,3 ≤ r < 0,7 – умеренная, r ≥ 0,7 – сильная. Для оценки статистических связей между порядковыми и количественными переменными, не подчиняющимися нормальному распределению, применяли непараметрический коэффициент корреляции Спирмена. Статистическая значимость коэффициентов корреляции определялась при уровне p < 0,05.
Результаты
Нутритивная недостаточность при первичном обследовании у онколога была диагностирована у 45 обследуемых пациентов (42,5%). Легкая степень тяжести отмечена у 32 больных (71,1%), средняя степень тяжести – у десяти больных (22,2%), тяжелая степень недостаточности питания выявлена у трех пациентов (6,7%).
Проведен анализ ряда антропометрических и биоимпедансометрических показателей у больных раком пищевода во взаимосвязи с наличием нутритивной недостаточности.
Корреляционный анализ установил ряд статистически значимых корреляционных связей между наличием недостаточности питания и антропометрическими и биоимпедансометрическими параметрами. Выявлены положительные корреляционные связи между дефицитом массы тела (%) и нутритивной недостаточностью (r = 0,763;
p = 0,001). Отрицательные корреляционные связи выявлены между наличием нутритивной недостаточности и значением ИМТ (r = -0,745; p = 0,001), обхватом талии в см (r = -0,586; p = 0,001), обхватом бедер в см (r = -0,619; p = 0,001), жировой массой в кг (r = -0,661; p = 0,001).
Для выявления антропометрических и биоимпедансометрических показателей – возможных предикторов нутритивной недостаточности у больных раком пищевода использовался метод множественного логистического регрессионного анализа.
В исследуемых группах в качестве возможных предикторов рассматривались клинико-анамнестические показатели: пол, возраст, наличие/отсутствие стеноза пищевода, курение, злоупотребление алкоголем, общий белок (г/л), альбумин (г/л); антропометрические показатели и индексы: вес (кг), рост (см), ИМТ, дефицит массы тела (%), диаметр плеч (см), диаметр грудной клетки (см), диаметр таза (см), обхват талии (см), обхват бедер (см), морфотип телосложения по ИПД; биоимпедансометрические показатели: жировая масса (кг), тощая масса (кг), активная клеточная масса (кг), доля активной клеточной массы (%), скелетно-мышечная масса (кг), доля скелетно-мышечной массы (%), основной обмен (ккал/сут), удельный основной обмен (ккал/м2/сут), общая жидкость (кг), внеклеточная жидкость (кг), фазовый угол (градусы).
С учетом данных 106 пациентов с первичным раком пищевода была построена предиктивная регрессионная модель для пациентов с нутритивной недостаточностью различной степени тяжести на основании антропометрических и биоимпедансометрических показателей:
![]()
р – вероятность наличия нутритивной недостаточности;
х1 – фазовый угол (градусы);
х2 – общий белок (г/л);
х3 – внеклеточная жидкость (кг);
х4 – основной обмен (ккал/сут);
х5 – возраст (лет);
х6 – диаметр плеч (см).
Модель является согласованной по Хосмеру – Лемешеву (характеристики многофакторной модели: коэффициент детерминации R2 Нейджелкерка – 0,459, значение теста согласия Хосмера – Лемешева – χ2 = 9,357 (df = 8; р = 0,313).
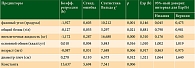
Результаты построения регрессионной модели на пятом шаге представлены в табл. 2.
Для данной модели коэффициент детерминации R2 = 0,459, что показывает статистически значимое объяснение данными предикторами изменения переменной отклика на 45,9%. Повышение вероятности наличия нутритивной недостаточности имеет место при увеличении показателей основного обмена, диаметра плеч и при снижении показателей величины фазового угла, общего белка, внеклеточной жидкости, возраста. При этом модель имеет специфичность 82,0% (предсказывает отсутствие нутритивной недостаточности на основании антропометрических и биоимпедансометрических показателей в 82,0% случаев), чувствительность (точность прогнозирования наличия нутритивной недостаточности) – 75,6%. Общий процент корректных предсказаний составил 79,2%.
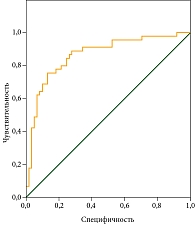
По результатам построения ROC-кривой показатель AUC составил 0,864 ± 0,037 (95% ДИ 0,792–0,937; р < 0,001) (рисунок).
Данный показатель указывает на очень хорошее качество модели для прогнозирования характера наличия нутритивной недостаточности по состоянию антропометрических и биоимпедансометрических показателей.
Обсуждение
Результаты нашего исследования демонстрируют, что нутритивная недостаточность является распространенным осложнением у больных раком пищевода, выявляясь при первичном обследовании у 42,5% больных, что согласуется с данными многочисленных исследований, в которых показана высокая частота развития недостаточности питания у больных со злокачественными опухолями желудочно-кишечного тракта [22–24].
Не менее важным результатом является структура выявленных нарушений питания: преобладание легкой степени нутритивной недостаточности (71,1%) над средней (22,2%) и тяжелой (6,7%). Белково-энергетические нарушения у значительной части пациентов носят начальный, не всегда очевидный при первичном осмотре врача, характер. Такая ситуация диктует необходимость обязательного скрининга нутритивного статуса у всех больных раком пищевода уже на этапе первичной диагностики, что позволит своевременно начать нутритивную поддержку и предотвратить прогрессирование недостаточности до тяжелых, резистентных к терапии форм.
Корреляционный анализ выявил сильные и статистически значимые связи между наличием нутритивной недостаточности и рядом антропометрических и биоимпедансометрических показателей. Ожидаемо была обнаружена прямая сильная корреляция между нутритивной недостаточностью и дефицитом массы тела (r = 0,763; p = 0,001). Данные подтверждают, что потеря массы тела остается классическим и высокоинформативным маркером нутритивных нарушений [25].
В свою очередь, обратные корреляции недостаточности питания с ИМТ (r = -0,745; p = 0,001), окружностью талии и бедер (r = -0,586 и r = -0,619 соответственно; p = 0,001), а также с массой жировой ткани (r = -0,661; p = 0,001) объективно отражают катаболическую направленность обмена веществ и истощение энергетических резервов организма у больных раком пищевода до начала лечения. Особого внимания заслуживает сильная корреляция с уменьшением жировой массы, что свидетельствует об активной мобилизации и расходе жировых запасов для компенсации энергодефицита, вызванного заболеванием. Полученные данные согласуются с результатами работ, в которых подчеркивается роль истощения жировых депо как ключевого компонента кахексии у онкологических больных [26].
Для углубленного понимания факторов, независимо влияющих на развитие нутритивной недостаточности, был применен метод множественной логистической регрессии. Построенная модель выявила комплекс антропометрических и биоимпедансометрических предикторов, повышающих вероятность наличия недостаточности питания.
Повышение вероятности белково-энергетической недостаточности при увеличении основного обмена логично объясняется гиперметаболическим состоянием, характерным для онкологических заболеваний, при котором энергетические потребности организма возрастают, усугубляя нутритивный дефицит.
Увеличение диаметра плеч, вероятно, не является самостоятельным фактором риска (предиктором нутритивной недостаточности), а выступает в модели как переменная, связанная с другими параметрами. Возможно, это косвенно отражает особенности перераспределения жидкостных сред или отечный синдром, часто сопутствующий гипопротеинемии при тяжелой нутритивной недостаточности, что требует дальнейшего изучения.
Снижение величины фазового угла, выявленное в модели как значимый предиктор, является одним из наиболее информативных показателей биоимпедансометрического анализа, отражает нарушение целостности клеточных мембран и изменение соотношения внутри- и внеклеточной жидкостей, являясь интегральным маркером пищевого статуса. Пониженные показатели величины фазового угла коррелируют с неблагоприятными исходами злокачественных новообразований [27].
Снижение уровня общего белка закономерно указывает на белково-энергетическую недостаточность, а уменьшение объема внеклеточной жидкости может быть связано с общим снижением мышечной массы и гиповолемией на фоне недостаточного питания.
Включение возраста в модель в качестве отрицательного предиктора (снижение возраста повышает риск нутритивной недостаточности) представляет особый интерес. Это может быть связано с более агрессивным течением заболевания или более выраженными метаболическими нарушениями у более молодых пациентов, однако интерпретация этого факта требует дополнительных исследований с учетом стадии заболевания и гистологического типа опухоли.
Полученная статистическая значимость (p < 0,001) и узкий 95%-ный доверительный интервал (0,792–0,937) делают данную модель предсказания нарушений питания надежным инструментом скрининга и стратификации риска развития нутритивной недостаточности в исследуемой популяции больных раком пищевода.
Заключение
Таким образом, полученные результаты исследования доказывают, что нутритивная недостаточность является частым и серьезным осложнением у больных раком пищевода. Комплексная оценка нутритивного статуса с использованием антропометрических и биоимпедансометрических методов позволяет не только констатировать наличие дефицита питания, но и выявить дополнительные информативные предикторы его развития. Разработанная прогностическая модель с высокой точностью может быть использована в клинической практике для раннего выявления пациентов группы риска и своевременного начала персонализированной нутритивной поддержки, что в конечном итоге может положительно повлиять на переносимость лечения и качество жизни больных раком пищевода.
S.S. Startsev, Ye.A. Gorbunova, PhD, I.P. Safontsev, PhD, R.A. Zukov, PhD
Pacific State Medical University, Vladivostok
Sakhalin Regional Clinical Oncology Center
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Contact person: Yekaterina A. Gorbunova, opium-100@yandex.ru
Assessment of nutritional status is an essential component of the initial examination for newly diagnosed patients with esophageal cancer. Adequate assessment of nutritional impairments allows for the timely diagnosis of nutritional insufficiency, correction of nutritional status, and improvement of treatment outcomes.
Objective. To identify anthropometric and bioimpedance analysis predictors of nutritional deficiency in newly diagnosed patients with esophageal cancer using logistic regression analysis.
Material and methods. The study included 106 patients diagnosed with esophageal cancer between 2023 and 2024. All patients underwent nutritional status screening using the NRS 2002 scale. The degree of malnutrition was determined using serum albumin and total protein levels, absolute lymphocyte count, Body Mass Index (BMI), and percentage of weight loss. During the anthropometric examination, patient height, body weight, waist and hip circumference were measured, and BMI was calculated. For a comprehensive assessment of nutritional status, all subjects underwent bioimpedance analysis using the ABC-01 “Medass” hardware-software complex. Statistical processing of the obtained results was performed. To identify anthropometric and bioimpedance analysis indicators as predictors of nutritional deficiency, the multiple logistic regression analysis method was used. The significance of the model was tested using the χ2 test. With a p-value < 0.05, the hypothesis of model insignificance was rejected. The model's goodness-of-fit was assessed using the Hosmer-Lemeshow test. With a p-value > 0.05, the hypothesis of model fit was accepted. The sensitivity and specificity of the obtained models were evaluated using ROC analysis.
Results. At the initial examination, nutritional deficiency was identified in 42.5% of patients with esophageal cancer. Statistically significant correlations were found between nutritional deficiency and anthropometric parameters (BMI, waist and hip circumferences) and body composition. A predictive model was developed using multiple logistic regression (AUC = 0.864), demonstrating very good quality for predicting nutritional deficiency. Significant predictors included phase angle, total protein level, extracellular water, basal metabolic rate, age, and shoulder diameter. The model has a specificity of 82.0% and a sensitivity of 75.6%.
Conclusion. Nutritional deficiency is a common complication of esophageal cancer. The developed predictive model based on anthropometric and bioimpedance parameters enables highly accurate identification of at-risk patients for the timely initiation of nutritional support.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


