Влияние энтерального питания на клиническое течение послеоперационного периода у больных раком желудка
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование было включено 87 пациентов, прооперированных в радикальном объеме по поводу рака желудка. Пациенты были разделены на две группы – основную и контрольную.
В основной группе (n = 39) пациенты в течение 14 дней до оперативного лечения получали дополнительное энтеральное питание в виде высокобелкового сипинга и энтеральное зондовое питание с повышенным содержанием белка в течение семи дней начиная с первых суток после операции, с восьмых суток – сипинг. В контрольной группе (n = 48) пациенты получали парентеральное питание с первых суток после оперативного лечения, обычную диету – с восьмых суток.
Результаты. В основной группе послеоперационных осложнений не было зарегистрировано. В контрольной группе осложнения в послеоперационном периоде были у 25% пациентов (p = 0,0003). Длительность госпитализации в основной группе была статистически значимо меньше, чем в контрольной. Так, медиана длительности пребывания в стационаре составила 18 койко-дней в основной группе и 21 койко-день – в контрольной (p = 0,00025151). Кроме того, энтеральное питание в основной группе положительно влияло на нутритивный статус пациентов в послеоперационном периоде.
Заключение. Применение энтерального питания в периоперационном периоде у больных раком желудка способствует улучшению их нутритивного статуса, снижению количества послеоперационных осложнений, сокращению продолжительности пребывания в стационаре. Раннее энтеральное питание специализированными смесями с первых суток после операции в отсутствие противопоказаний приводит к более ранней активизации моторики кишечника, что является профилактикой развития синдрома кишечной недостаточности, улучшает иммунный статус пациентов, снижает риск развития септических послеоперационных осложнений.
Материал и методы. В исследование было включено 87 пациентов, прооперированных в радикальном объеме по поводу рака желудка. Пациенты были разделены на две группы – основную и контрольную.
В основной группе (n = 39) пациенты в течение 14 дней до оперативного лечения получали дополнительное энтеральное питание в виде высокобелкового сипинга и энтеральное зондовое питание с повышенным содержанием белка в течение семи дней начиная с первых суток после операции, с восьмых суток – сипинг. В контрольной группе (n = 48) пациенты получали парентеральное питание с первых суток после оперативного лечения, обычную диету – с восьмых суток.
Результаты. В основной группе послеоперационных осложнений не было зарегистрировано. В контрольной группе осложнения в послеоперационном периоде были у 25% пациентов (p = 0,0003). Длительность госпитализации в основной группе была статистически значимо меньше, чем в контрольной. Так, медиана длительности пребывания в стационаре составила 18 койко-дней в основной группе и 21 койко-день – в контрольной (p = 0,00025151). Кроме того, энтеральное питание в основной группе положительно влияло на нутритивный статус пациентов в послеоперационном периоде.
Заключение. Применение энтерального питания в периоперационном периоде у больных раком желудка способствует улучшению их нутритивного статуса, снижению количества послеоперационных осложнений, сокращению продолжительности пребывания в стационаре. Раннее энтеральное питание специализированными смесями с первых суток после операции в отсутствие противопоказаний приводит к более ранней активизации моторики кишечника, что является профилактикой развития синдрома кишечной недостаточности, улучшает иммунный статус пациентов, снижает риск развития септических послеоперационных осложнений.


Введение
Проблема лечения рака желудка остается актуальной для медицинского сообщества [1, 2]. Ежегодно в мире диагностируется более миллиона новых случаев заболевания. Несмотря на достижения медицины в области диагностики ранних форм рака желудка, внедрение таргетной терапии и иммунотерапии, рак желудка продолжает занимать третье место в структуре общей смертности от онкологических заболеваний [3]. В России в 2019 г. было выявлено свыше 33 тыс. случаев рака желудка, летальность на первом году с момента установления диагноза составила 45,8% [4].
Своевременная диагностика рака желудка на начальных стадиях, радикальное удаление опухоли, в ряде случаев дополненное лекарственной терапией, способствуют более благоприятному прогнозу течения заболевания [5, 6].
Оперативное лечение рака желудка связано с высоким риском развития послеоперационных осложнений [7, 8]. Повышенный катаболизм, ослабленный анаболизм, снижение иммунной функции в раннем послеоперационном периоде могут привести к недостаточности питания или усугубить ее, увеличить частоту развития послеоперационных осложнений и смертности [9, 10].
Согласно результатам исследования ECOG, частота нутритивной недостаточности при опухолевом поражении органов желудочно-кишечного тракта (ЖКТ) колеблется от 70 до 83%. Нутритивная недостаточность чаще наблюдается при раке желудка и пищевода (75–80%) [9].
В улучшении результатов лечения рака желудка, снижении частоты развития послеоперационных осложнений, профилактике рецидивов заболевания, повышении качества жизни пациентов важную роль играет поддерживающая терапия, в частности нутритивная поддержка [11, 12].
Предоперационная нутритивная поддержка у больных раком желудка улучшает их нутритивный статус, снижает количество и тяжесть послеоперационных осложнений [13, 14].
В соответствии с рекомендациями ESPEN (2017 г.), нутритивную поддержку следует начинать при наличии нутритивной недостаточности или риске ее развития, в том случае, когда пациент не может питаться обычным путем свыше семи суток или прием пищи недостаточен (менее 60% суточной потребности) в течение более одной-двух недель [15].
Раннее энтеральное питание в послеоперационном периоде позволяет компенсировать высокий метаболизм, вызванный хирургической травмой, поддержать барьерную функцию слизистой оболочки кишечника, предотвратить энтерогенные инфекции, снизить частоту инфекционных осложнений в послеоперационном периоде и длительность госпитализации, а следовательно, ускорить выздоровление пациентов [16, 17].
Вопросы снижения частоты послеоперационных осложнений и улучшения непосредственных результатов лечения больных раком желудка остаются крайне актуальными [18].
Цель исследования – оценить влияние применения энтерального питания в периоперационном периоде на клиническое течение послеоперационного периода у больных раком желудка.
Материал и методы
Исследование проведено на базе амбулаторно-поликлинического и онкоабдоминального отделения Красноярского краевого клинического онкологического диспансера им. А.И. Крыжановского в период с 2016 по 2018 г.
В исследование было включено 87 пациентов с верифицированным раком желудка. Все пациенты были прооперированы в радикальном объеме: гастрэктомия – 32 (36,2%) пациента, субтотальная проксимальная резекция – 7 (8,0%), субтотальная дистальная резекция – 37 (42,5%), паллиативные операции – 11 (12,6%) больных.
Пациенты были разделены на две группы – основную и контрольную. Пациенты в основной группе (n = 39; 44,8%) получали энтеральное питание «Нутридринк Компакт Протеин» (18 г белка и 300 ккал в 125 мл) методом сипинга по 250 мл в день в течение 14 дней до оперативного лечения и энтеральное зондовое питание с повышенным содержанием белка из расчета 1,5 г белка и 25 ккал на 1 кг массы тела с первых суток после операции в течение семи дней. Стандартно использовали смесь Nutrison Advanced Protison (7,5 г белка и 128 ккал в 100 мл). В настоящее время данная смесь представлена на отечественном фармацевтическом рынке под названием Nutrison Protein Advance. С восьмых суток послеоперационного периода пациенты получали энтеральное питание «Нутридринк Компакт Протеин» методом сипинга до момента выписки из стационара на 14-е сутки. Пациентам со стрессовой гипергликемией, сахарным диабетом назначали Nutrison Advanced Diason Energy HP (7,7 г белка и 150 ккал в 100 мл). В контрольной группе (n = 48; 55,2%) пациенты получали парентеральное питание после оперативного лечения в течение семи суток, с восьмых суток – обычную диету до момента выписки из стационара на 14-е сутки.
Оценка нутритивного статуса и мониторинг нутритивной поддержки проводились в основной группе на амбулаторно-поликлиническом этапе при первичном обращении к онкологу, затем в стационаре через 14 дней после проведения предоперационной нутритивной поддержки и на шестые-седьмые сутки после операции, в контрольной – при поступлении в стационар для оперативного лечения и на шестые-седьмые сутки после операции.
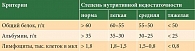
Тяжесть нутритивной недостаточности оценивали по лабораторным показателям (уровни общего белка, альбумина, лимфоцитов) на основании практических рекомендаций по нутритивной поддержке у онкологических больных RUSSCO, 2016 [19]. Критерии степени тяжести представлены в табл. 1. Нутритивная недостаточность определялась как наличие у пациента одного из следующих показателей: уровень сывороточного альбумина < 35 г/л или общего белка < 60 г/л или индекс массы тела (ИМТ) < 18,5 кг/м2.
Кроме того, для оценки уровня обменных процессов и общего состояния в обеих группах с помощью биоимпедансометрии на аппарате ABC01-036 «Медасс» определяли величину фазового угла: в основной группе – при первичном обращении и через 14 дней после применения сипинга, в контрольной – при поступлении в стационар по поводу оперативного лечения [20].
Первичная конечная точка исследования – влияние нутритивной поддержки на частоту развития осложнений в послеоперационном периоде. Оценивались интраабдоминальные и инфекционные экстраабдоминальные осложнения в первые 14 дней после операции.
Вторичные конечные точки – влияние нутритивной поддержки на нутритивный статус, продолжительность пребывания в стационаре.
Статистические расчеты выполнялись в программах IBM SPSS v.22 и StatSoft STATISTICA v.10. Описательные статистики для количественных признаков приведены в виде медианы и межквартильных интервалов [Q25; Q75], для номинальных признаков – в процентах. Проверка нормальности распределения значений переменных в группах наблюдения выполнена на основании критериев Шапиро – Уилка и Колмогорова – Смирнова.
Исходя из характера распределения переменных, при сравнении зависимых групп в динамике использовали параметрический критерий Стьюдента для связанных выборок и непараметрический критерий Вилкоксона. Порог статистической значимости р < 0,05.
Значимость различий качественных и порядковых признаков в группах наблюдения оценивали с помощью непараметрического критерия χ2 Пирсона с поправкой на непрерывность. При ожидаемой частоте встречаемости признака ≤ 5 в четырехпольных таблицах использовали точный критерий Фишера.
Результаты и обсуждение
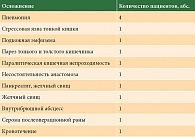
При анализе результатов лечения послеоперационных осложнений в основной группе не выявлено. В то же время в контрольной группе у 12 (25%) пациентов в послеоперационном периоде развились осложнения, в том числе у десяти пациентов – интраабдоминальные, такие как подкожная эмфизема, парез тонкого и толстого кишечника, паралитическая кишечная непроходимость, несостоятельность анастомоза, панкреатит, желчные свищи, внутрибрюшной абсцесс, кровотечение, серома послеоперационной раны. У одного пациента контрольной группы течение раннего послеоперационного периода осложнилось стрессовой язвой тонкой кишки, по поводу которой выполнены релапаротомия, ушивание язвы, неоднократное дренирование брюшной полости. Данное осложнение привело к летальному исходу. У двух пациентов зафиксировано инфекционное экстраабдоминальное осложнение – пневмония. Кроме того, у двух пациентов интраабдоминальное осложнение сочеталось с пневмонией. Характер послеоперационных осложнений в контрольной группе представлен в табл. 2.
Частота развития послеоперационных осложнений у обследованных пациентов повлияла на длительность их пребывания в стационаре. Так, количество общих койко-дней, проведенных в стационаре пациентами основной группы, было статистически значимо меньше по сравнению с группой контроля (p = 0,00025151). Результаты представлены в табл. 3.
В результате сравнения величины фазового угла в основной группе до и через 14 дней после применения сипинга в предоперационном периоде было установлено, что Me величины фазового угла до нутритивной поддержки составила 6,06°, после – 6,32° (p = 0,00000035). Выявленные различия свидетельствуют о положительном влиянии высокобелкового сипинга на нутритивный статус пациентов.
По сравнению с контрольной в основной группе через 14 дней после применения сипинга в предоперационном периоде лабораторные показатели, в частности уровни лимфоцитов, общего белка, альбумина, а также величина фазового угла были выше. Различия по уровню альбумина в сыворотке крови между группами были статистически значимы (p = 0,00000005). Данные представлены в табл. 4.
При сравнении лабораторных показателей на шестые-седьмые сутки после оперативного лечения в основной и контрольной группах наблюдалась тенденция, аналогичная той, которая имела место при оценке в предоперационном периоде показателей контрольной и основной группы, со статистически значимо более высокими значениями медианы сывороточного альбумина в основной группе через 14 дней после применения сипинга по сравнению с группой контроля (30,3 г/л против 25,3 г/л, p = 0,000007). Это объясняется тем, что альбумин – один из ключевых и широко применяемых лабораторных показателей оценки нутритивного статуса, который, по данным ряда авторов, может служить предиктором послеоперационных осложнений и худшей выживаемости при раке желудка [21–24].
При оценке нутритивного статуса пациентов исходно нутритивная недостаточность была выявлена у 10 (25,6%) больных основной группы и 24 (50%) пациентов контрольной (сывороточный альбумин < 35 г/л, или общий белок < 60 г/л, или ИМТ < 18,5 кг/м2). В то же время при оценке нутритивного статуса в послеоперационном периоде на шестые-седьмые сутки после операции нутритивная недостаточность определялась у 100% пациентов обеих групп. Это обусловлено тем, что само по себе оперативное вмешательство и связанный с ним операционный стресс вызывают функциональную перестройку всех систем организма и приводят к значительному усилению катаболических процессов в послеоперационном периоде. Потери азота в раннем послеоперационном периоде бывают очень высокие: в сутки может теряться около 25 г азота. Дело в том, что для осуществления анаболических процессов в ране, поддержания синтезирующей функции печени, обеспечения адекватной работы иммунной системы необходимо большое количество пластического и энергетического материала, которым становятся мышечные белки, жировая ткань и кожа. Как следствие, в раннем послеоперационном периоде отмечается резкое снижение концентрации белковых фракций крови [25]. На фоне применения специализированного энтерального питания в периоперационном периоде (за 10–14 дней до хирургического вмешательства и начиная с первых суток после операции в течение как минимум 14 дней), согласно результатам ряда исследований, достоверно снижается количество осложнений в послеоперационном периоде, уменьшается длительность пребывания в стационаре и себестоимость лечения [26, 27]. Это подтверждают и полученные нами в ходе исследования данные. Так, при детальном анализе нутритивного статуса пациентов на шестые-седьмые сутки после операции, несмотря на то, что нутритивная недостаточность отмечалась у всех пациентов обеих групп, ее тяжесть в группах значительно отличалась. В основной группе преобладали пациенты с легкой степенью недостаточности питания – 21 (53,8%) случай. Средняя степень нутритивной недостаточности была диагностирована у 15 (38,5%) пациентов, тяжелая – у 3 (7,7%). В группе контроля, по сравнению с основной группой, были получены противоположные результаты. Легкая степень недостаточности питания была выявлена лишь у 8 (16,7%) больных, средняя – у 20 (41,7%), тяжелая – у 20 (41,7%) пациентов. Более тяжелая степень нутритивной недостаточности на шестые-седьмые сутки после операции в контрольной группе по сравнению с основной коррелировала с худшими показателями частоты развития осложнений в послеоперационном периоде и длительности госпитализации.
Кроме того, в ходе исследования показано, что раннее энтеральное питание специализированными смесями с первых суток после операции в отсутствие противопоказаний способствует более ранней активизации моторики кишечника, что является профилактикой развития синдрома кишечной недостаточности, улучшает иммунный статус пациентов, снижает риск развития септических послеоперационных осложнений.
Таким образом, энтеральное питание в периоперационном периоде у больных раком желудка улучшает их нутритивный статус, снижает количество послеоперационных осложнений и сокращает продолжительность пребывания в стационаре.
Важно, что даже в отсутствие нутритивной недостаточности исходно ассоциированное с опухолью нарушение метаболизма может привести к развитию нутритивной недостаточности и ухудшению результатов хирургического лечения. Поэтому важно еще на этапе установления диагноза оценивать потенциальный риск развития нутритивной недостаточности и своевременно начинать нутритивную поддержку.
Заключение
На основании изложенного можно сделать несколько выводов:
- Оценку нутритивного статуса у больных раком желудка необходимо проводить с момента установления диагноза. Это позволит выявить пациентов с риском развития недостаточности питания на этапе первичного обследования и своевременно провести нутритивную поддержку.
- Нутритивная поддержка должна проводиться у пациентов с нутритивной недостаточностью и риском ее развития за 10–14 дней до хирургического лечения и в течение не менее 14 дней, начиная с первых суток после операции. Предпочтение следует отдавать энтеральному питанию.
- Предоперационная нутритивная поддержка с применением высокобелкового специализированного питания в виде сипинга как дополнительного источника нутриентов улучшает нутритивный статус больных раком желудка и в сочетании с ранним энтеральным питанием в послеоперационном периоде способствует снижению риска развития послеоперационных осложнений, что улучшает непосредственные результаты лечения.
- Раннее энтеральное питание специализированными смесями с первых суток после операции в отсутствие противопоказаний способствует более ранней активизации моторики кишечника, что является профилактикой развития синдрома кишечной недостаточности, улучшает иммунный статус пациентов, снижает риск развития септических послеоперационных осложнений.
- Нутритивная поддержка у больных раком желудка с применением энтерального питания экономически эффективна за счет снижения частоты послеоперационных осложнений, сокращения количества дней пребывания в стационаре и, как следствие, уменьшения расходов на лечение и реабилитацию пациентов.
Авторы сообщают об отсутствии каких-либо конфликтов интересов при планировании, выполнении и использовании результатов настоящего исследования.
Ye.A. Gorbunova, G.N. Filkin, PhD, N.N. Medvedeva, PhD, Prof., R.A. Zukov, PhD, Prof.
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Contact person: Yekaterina A. Gorbunova, opium-100@yandex.ru
The aim of the study was to evaluate the effect of enteral nutrition in the perioperative period on the clinical course of the postoperative period in patients with gastric cancer.
Material and methods. The study included 87 patients who were operated in radical volume for stomach cancer. The study participants were divided into two groups. 39 patients of the main group received additional enteral nutrition in the form of high-protein sipping and enteral probe nutrition with the increased protein content for seven days, starting from the first day after surgery, and sipping from the eighth day. 48 patients of the control group received parenteral nutrition from the first day after surgical treatment, from the eighth day – the usual diet.
Results. No postoperative complications were registered in the main group. In the control group, complications occurred in 25% of patients (p = 0.0003). The duration of hospitalization in the main group was significantly less than in the control group. Thus, the median length of hospital stay was 18 bed-days in the main group and 21 bed-days in the control group (p = 0.00025151). In addition, enteral nutrition in the main group had a positive effect on the nutritional status of patients in the postoperative period.
Conclusions. The use of enteral nutrition in the perioperative period in patients with gastric cancer improves the nutritional status of patients, reduces the number of postoperative complications, and reduces the length of hospital stay period. Early enteral nutrition with specialized mixtures from the first day after surgery in the absence of contraindications promotes earlier activation of intestinal motility, which is the prevention of the development of intestinal insufficiency syndrome, improves the immune status of patients, reduces the risk of septic postoperative complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.