Оценка нутритивного статуса пациентов с раком желудка перед радикальным хирургическим лечением
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценка параметров нутритивного статуса и степени НН у пациентов с операбельным раком желудка 0–III стадий в предоперационном периоде.
Материал и методы. В исследование включены 102 пациента с раком желудка 0–III стадий, перенесших радикальное хирургическое лечение, из них 64 (62,7%) мужчины, 38 (37,3%) женщин, в возрасте от 31 до 77 лет (средний возраст – 60,2 ± 11,2 года). Проведена оценка нутритивного риска по системе Nutritional Risk Screening (NRS-2002), определение общего белка крови, альбумина, трансфферина, абсолютного числа лимфоцитов, применен расчет индекса нутритивного риска (Nutritional Risk Index, NRI).
Результаты и их обсуждение. У 70,6% больных выявлена та или иная степень НН: у 52% – менее
3 баллов, у 18,6% – 3 и более баллов по шкале NRS-2002. Потенциальными факторами риска развития НН оказались локализация опухоли в кардиальном отделе желудка, III стадия опухолевого процесса, поражение лимфоузлов. Среди 63 пациентов с повышенным индексом массы тела (≥ 25,0) 50% относились к группам нутритивного риска. Исследование лабораторных показателей выявило, что уровни общего белка и альбумина не являются статистически значимыми показателями НН. Лабораторными маркерами НН у пациентов с операбельным раком желудка оказались уровень трансферрина плазмы и значение NRI.
Заключение. Всем пациентам с раком желудка, которым планируется радикальное хирургическое лечение, необходимо проводить динамический скрининг нутритивного статуса с использованием специальных инструментов (NRS-2002, NRI). Пациентам, находящимся в группе риска по питанию, при планировании радикальной операции необходимо рассматривать пред- и послеоперационную нутритивную поддержку для уменьшения рисков, связанных с НН.
Цель исследования – оценка параметров нутритивного статуса и степени НН у пациентов с операбельным раком желудка 0–III стадий в предоперационном периоде.
Материал и методы. В исследование включены 102 пациента с раком желудка 0–III стадий, перенесших радикальное хирургическое лечение, из них 64 (62,7%) мужчины, 38 (37,3%) женщин, в возрасте от 31 до 77 лет (средний возраст – 60,2 ± 11,2 года). Проведена оценка нутритивного риска по системе Nutritional Risk Screening (NRS-2002), определение общего белка крови, альбумина, трансфферина, абсолютного числа лимфоцитов, применен расчет индекса нутритивного риска (Nutritional Risk Index, NRI).
Результаты и их обсуждение. У 70,6% больных выявлена та или иная степень НН: у 52% – менее
3 баллов, у 18,6% – 3 и более баллов по шкале NRS-2002. Потенциальными факторами риска развития НН оказались локализация опухоли в кардиальном отделе желудка, III стадия опухолевого процесса, поражение лимфоузлов. Среди 63 пациентов с повышенным индексом массы тела (≥ 25,0) 50% относились к группам нутритивного риска. Исследование лабораторных показателей выявило, что уровни общего белка и альбумина не являются статистически значимыми показателями НН. Лабораторными маркерами НН у пациентов с операбельным раком желудка оказались уровень трансферрина плазмы и значение NRI.
Заключение. Всем пациентам с раком желудка, которым планируется радикальное хирургическое лечение, необходимо проводить динамический скрининг нутритивного статуса с использованием специальных инструментов (NRS-2002, NRI). Пациентам, находящимся в группе риска по питанию, при планировании радикальной операции необходимо рассматривать пред- и послеоперационную нутритивную поддержку для уменьшения рисков, связанных с НН.

Введение
Среди всех онкологических заболеваний рак желудка (РЖ) исходно сопровождается наиболее высоким риском развития нутритивной недостаточности (НН) [1–5], что может быть вызвано механической обструкцией пищеварительного тракта опухолями или синдромом анорексии – кахексии у онкологических больных [6–8]. До 70% пациентов, госпитализированных для проведения планового оперативного лечения новообразований и желудка (резекции желудка, гастрэктомии), имеют высокий риск развития НН и нуждаются в лечебном питании в периоперационном периоде, при этом, несмотря на объективные причины необходимости выявления и коррекции НН у этой группы пациентов, в 70–80% случаев НН остается недиагностированной и не принимается никаких мер для ее коррекции [9]. Установлено, что показатели нутритивного статуса, такие как баллы по шкале CONUT и предоперационный индекс нутритивного риска (Nutritional Risk Index, NRI), влияют на непосредственные результаты при хирургическом лечении РЖ, являясь фактором независимого прогноза развития послеоперационных осложнений при радикальных операциях [10, 11]. После радикального хирургического лечения у пациентов с РЖ явления НН могут еще более усугубляться, развиваться потеря веса, мальабсорбция, дефицит безжировой массы тела, пресаркопения и саркопения, дефицит жировой ткани, анемия, недостаток витаминов и микроэлементов [12–16]. Таким образом, оценка параметров нутритивного статуса и индикаторов мышечной массы у пациентов с РЖ как в пред-, так и в послеоперационном периоде имеет большое значение для улучшения как качества жизни, так и непосредственных и отдаленных результатов лечения.
Цель исследования – оценка параметров нутритивного статуса и степени НН у пациентов с операбельным раком желудка 0–III стадий в предоперационном периоде.
Материал и методы
Отбор в исследование осуществлялся среди пациентов с раком желудка 0–III стадий, перенесших радикальное хирургическое лечение в отделении абдоминальной онкологии Краснодарского клинического онкологического диспансера № 1 за период 2020–2022 гг.
Критерии включения: возраст пациентов старше 18 лет, вне зависимости от пола, перенесенная в период госпитализации радикальная операция по поводу первичного РЖ 0–III стадий.
Проводили оценку нутритивного риска по системе Nutritional Risk Screening (NRS-2002) [17], которая рекомендована для использования у онкологических пациентов [18]. Шкала NRS представлена в табл. 1.
Индекс массы тела (ИМТ) рассчитывали по формуле: ИМТ = m/h2, где m – вес в кг, h – рост в метрах. Показатель ИМТ интерпретировали в соответствии с рекомендациями Всемирной организации здравоохранения с учетом возраста [19].
При оценке нутритивного статуса использовали следующие лабораторные показатели: общий белок крови, альбумин плазмы, трансферрин, абсолютное число лимфоцитов. Применяли расчет индекса нутритивного риска (Nutritional Risk Index, NRI, 1991) [20] по формуле: NRI = 1,519 × альбумин плазмы (г/л) + 0,417 × (масса тела 1 (кг)) / (масса тела 2 (кг) × 100), где масса тела 1 – масса тела на момент обследования, масса тела 2 – обычная масса тела.
Статистическую обработку данных осуществляли при помощи анализа четырехпольных и многопольных произвольных таблиц сопряженности с использованием критерия хи-квадрат (χ2) Пирсона, однофакторного дисперсионного анализа (ANOVA). Пороговым критерием статистической значимости принято значение p < 0,05. Для статистического анализа использовали программный пакет IBM® SPSS Statistics 23.0 для Windows (IBM, США).
Исследование выполнено в рамках комплексной темы НИР «Совершенствование методов реконструкции пищеварительного тракта после гастрэктомии и резекции желудка, оптимизация профилактики и хирургической коррекции послеоперационных гнойно-септических осложнений», одобренной независимым этическим комитетом Кубанского государственного медицинского университета (протокол № 107 от 28.01.2022).
Результаты и их обсуждение
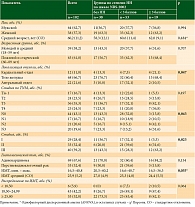
В исследование включены 102 пациента, из них 64 (62,7%) мужчины и 38 (37,3%) женщин, в возрасте от 31 до 77 лет (средний возраст – 60,2 ± 11,2 года), 61,8% составили пациенты пожилого и старческого возраста. Распределение пациентов по локализации опухоли, стадии, гистологическому типу, а также по ИМТ представлено в табл. 2.
При оценке по шкале NRS-2002 выявлено, что только у 30 (29,4%) пациентов не имелось НН, а у остальных 72 (70,6%) пациентов выявлена та или иная степень НН: у 53 пациентов (52%) – менее 3 баллов, у 19 (18,6%) – 3 балла и более. Для дальнейшего анализа пациенты разделены на три группы по показателям NRS-2002.
При анализе групп установлено, что степень НН не зависела от пола и возраста пациентов. Выявлена статистически значимая зависимость от локализации опухоли: более высокая доля пациентов с показателем ≥ 3 баллов отмечена среди больных с раком кардиального отдела. Отмечена также ассоциация степени НН со стадией процесса (преобладание тяжелой НН при III стадии), причем эта связь прослеживается с поражением лимфоузлов (преобладание тяжелой НН при N2 и N3), при этом статистически значимой зависимости от глубины инвазии опухоли не отмечено. Гистологический тип также не оказывал влияния на степень НН. В группах по степени НН по шкале NRS-2002 выявлена статистически значимая разница ИМТ. При этом в группе высокого нутритивного риска (≥ 3 баллов) только 10,5% пациентов имели дефицит массы тела (ИМТ < 18,5), а 42,1% больных имели ИМТ ≥ 25,00. Различия в распределении ИМТ между группами по степени НН по шкале NRS-2002 оказались статистически не значимы. Среди 63 пациентов с ИМТ ≥ 25,0 практически половина (31 пациент) относились к группам нутритивного риска.
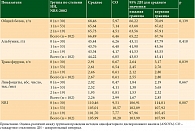
Оценка лабораторных показателей нутритивного статуса в зависимости от степени нутритивных нарушений по шкале NRS-2002 не выявила статистически значимых различий в уровнях общего белка и альбумина плазмы крови между группами, при этом зарегистрированы статистические значимые различия в уровне трансферрина, абсолютном уровне лимфоцитов и показателе индекса нутритивного риска (NRI) (табл. 3).
Проблеме НН у онкологических больных в настоящее время уделяется пристальное внимание. Наиболее остро она проявляется у пациентов с опухолями гастроинтестинальной локализации – клинически значимая НН встречается у 15–80% больных с опухолями пищевода и желудка, что составляет наибольшую частоту среди всех онкологических пациентов [7, 8, 21]. Показано, что наличие исходной НН значимо ухудшает результаты всех видов лечения больных с РЖ, в том числе повышает частоту хирургических осложнений [11, 22–24], негативно влияет на пятилетнюю общую и канцерспецифическую выживаемость [25–28]. При хирургическом лечении у большинства пациентов за время нахождения в стационаре отмечается усугубление степени НН, что диктует необходимость тщательного скрининга нутритивного статуса у пациентов с РЖ перед радикальным хирургическим лечением [9].
В нашем исследовании при проведении скрининга НН по системе NRS-2002 среди пациентов с операбельным РЖ 0–III стадий, госпитализированных для планового хирургического лечения, у 70,6% выявлена та или иная степень НН: у 52% – менее 3 баллов, у 18,6% – 3 балла и более. Потенциальными факторами риска развития НН оказались локализация опухоли в кардиальном отделе желудка, III стадия опухолевого процесса, поражение лимфоузлов. Результаты наблюдений подтвердили также, что ИМТ не является основополагающим в оценке нутритивного статуса [9]: среди 63 пациентов с повышенным ИМТ (≥ 25,0) практически 50% относились к группам нутритивного риска. Исследование лабораторных показателей выявило, что уровни общего белка и альбумина не являются статистически значимыми показателями НН. Лабораторными маркерами НН у больных операбельным РЖ оказались уровень трансферрина и значение NRI.
Заключение
У 70,6% пациентов с операбельным РЖ 0–III стадий в предоперационном периоде отмечается та или иная степень НН. Всем пациентам с РЖ, которым планируется радикальное хирургическое лечение, необходимо проводить динамический скрининг нутритивного статуса с использованием специальных инструментов (NRS-2002, NRI), так как НН часто остается невыявленной при рутинном клиническом обследовании. Пациентам, находящимся в группе риска по питанию, при планировании радикальной операции необходимо рассматривать пред- и послеоперационную нутритивную поддержку для уменьшения связанных с НН рисков.
O.M. Asipovich, I.B. Uvarov, PhD, S.N. Derbenev, A.V. Yaschenko, V.A. Porkhanov, PhD, A.M. Manuilov, PhD
Kuban State Medical University
Krasnodar Clinical Oncological Dispensary No. 1
Krasnodar Scientific Research Institute – S.V. Ochapovsky Regional Clinical Hospital No 1.
Contact person: Ivan B. Uvarov, uvarovivan@yandex.ru
Patients with gastric cancer are characterized by a high risk of nutritional deficiency, which may adversely affect the course of the postoperative period after radical resections.
The purpose of the study was to assess the parameters of the nutritional status and the degree of nutritional deficiency in patients with resectable gastric cancer of 0–III stages in the preoperative period.
Material and methods. The study included 102 patients with stage 0–III gastric cancer who underwent radical surgical treatment; 64 men (62.7%), 38 women (37.3%), age from 31 to 77 (mean 60.2 ± 11.2) years. The nutritional risk was assessed using the Nutritional Risk Screening system (NRS-2002), the determination of total blood protein, albumin, transferrin, the absolute number of lymphocytes, and the calculation of the Nutritional Risk Index (NRI).
Results. In 70.6% of patients, one or another degree of nutritional deficiency was detected: in 52% – less than 3 points, in 18.6% – 3 or more points according to the NRS-2002 scale. Potential risk factors for the development of nutritional deficiency were the localization of the tumor in the cardia of the stomach, stage III, and lymph node damage. Among 63 patients with elevated вody mass index (≥ 25.0), 50% belonged to nutritional risk groups. The study of laboratory parameters revealed that the level of total protein and albumin are not statistically significant indicators of nutritional deficiency, laboratory markers of nutritional deficiency in patients with operable gastric cancer were the level of plasma transferrin and the value of NRI.
Conclusion. All gastric cancer patients who are planned for radical surgical treatment should be dynamically screened for nutritional status using special tools (NRS-2002, NRI). In patients at nutritional risk, pre- and post-operative nutritional support should be considered when planning radical surgery to reduce related risks.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.