Биоинформационный анализ молекулярно-генетических процессов при взаимодействии В1- и гамма-дельта-Т-лимфоцитов
- Аннотация
- Статья
- Ссылки
- English
В1-лимфоциты локализуются преимущественно в серозных полостях (брюшной и плевральной) и лимфоидной ткани слизистых оболочек. В слизистой оболочке кишечника В1-клетки вырабатывают значительную часть иммуноглобулина (Ig) А.
Для переключения изотипов иммуноглобулинов требуются сигналы от Т-лимфоцитов, однако в тонкой кишке переключение изотипа с IgM на IgA происходит в TН-В1-клетках, не получающих помощи Т-клеток. Предполагается, что в этом процессе могут участвовать гамма-дельта-Т-лимфоциты, которые, так же как B1-лимфоциты, в онтогенезе появляются раньше других Т-клеток и имеют сходную с В1-клетками локализацию в организме. Установление механизмов взаимодействия В1- и гамма-дельта-Т-лимфоцитов при иммунном ответе на ТН-2-антигены является актуальной задачей. Для прогнозирования возможных путей такого взаимодействия применяли биоинформационный анализ.
Проведенное исследование позволило получить данные о клеточных маркерах и ключевых сигнальных путях, которые могут быть вовлечены в это взаимодействие, а также о регуляторных внутриклеточных структурах – малых РНК, которые способны влиять на отдельные компоненты сигнальных путей.
В1-лимфоциты локализуются преимущественно в серозных полостях (брюшной и плевральной) и лимфоидной ткани слизистых оболочек. В слизистой оболочке кишечника В1-клетки вырабатывают значительную часть иммуноглобулина (Ig) А.
Для переключения изотипов иммуноглобулинов требуются сигналы от Т-лимфоцитов, однако в тонкой кишке переключение изотипа с IgM на IgA происходит в TН-В1-клетках, не получающих помощи Т-клеток. Предполагается, что в этом процессе могут участвовать гамма-дельта-Т-лимфоциты, которые, так же как B1-лимфоциты, в онтогенезе появляются раньше других Т-клеток и имеют сходную с В1-клетками локализацию в организме. Установление механизмов взаимодействия В1- и гамма-дельта-Т-лимфоцитов при иммунном ответе на ТН-2-антигены является актуальной задачей. Для прогнозирования возможных путей такого взаимодействия применяли биоинформационный анализ.
Проведенное исследование позволило получить данные о клеточных маркерах и ключевых сигнальных путях, которые могут быть вовлечены в это взаимодействие, а также о регуляторных внутриклеточных структурах – малых РНК, которые способны влиять на отдельные компоненты сигнальных путей.
Введение
В1-клетки – отдельная субпопуляция B-лимфоцитов в организме человека и мышей.
В отличие от B2-клеток, представленных преимущественно в селезенке, лимфоузлах и костном мозге, В1-лимфоциты локализуются в серозных полостях (перитонеальной и брюшной), а также в лимфоидной ткани слизистых оболочек, в частности в слизистой оболочке кишечника.
В онтогенезе В1-клетки появляются раньше В2-лимфоцитов. Предшественники В1-клеток мигрируют из фетальной печени в серозные полости. Считается, что они могут сохраняться в течение всей жизни. Это подтверждается зародышевой организацией генов иммуноглобулинов (Ig) В1-клеток. Однако получены данные о том, что по крайней мере часть В1-клеток взрослого организма может образовываться в костном мозге.
В1-лимфоциты отвечают преимущественно на Т-независимые (ТН) антигены 1-го и 2-го типов.
ТН-1-агенты в достаточно высоких концентрациях способны индуцировать поликлональную активацию B-лимфоцитов (зрелых и незрелых) и продукцию Ig. Классическим примером ТН-1-антигена служит липополисахарид.
ТН-2-агенты имеют преимущественно небелковую природу, большой размер молекул и регулярно повторяющиеся эпитопы, вследствие чего способны вызывать кластеризацию иммуноглобулиновых рецепторов на поверхности В-клеток. В результате формирующийся сигнал достигает силы, достаточной для активации лимфоцита, и второго сигнала от Т-клетки не требуется (это определяет Т-независимость ответа). ТН-2-агенты в отличие от ТН-1-агентов способны активировать В-клетки только специфически, поэтому на них отвечают преимущественно B1-лимфоциты, способные к ТН-ответу [1].
IgA – основной изотип иммуноглобулинов в слизистых оболочках, играющий ключевую роль в нормальном функционировании организма. В частности, IgA препятствует проникновению патогенов в организм через слизистые оболочки. S. Wolbank и соавт. установили, что антитела 2F5IgA, 2F5IgM и 2G12IgM эффективно ингибируют первые стадии проникновения ВИЧ через слизистые оболочки [2].
Большая часть IgA вырабатывается в слизистой оболочке кишечника, преимущественно B1-клетками. Образование В1-лимфоцитами IgA в тонкой кишке свидетельствует о том, что в ТН-В1-клетках происходит переключение изотипа с IgM на изотип IgA [3]. При ответе на Т-зависимые (ТЗ) антигены для переключения изотипов В2-лимфоцит должен получить второй сигнал от Т-клетки. Чем в отсутствие классической помощи Т-клеток обеспечивается переключение классов иммуноглобулинов в В1-клетках и как оно осуществляется, в настоящее время не известно. Предполагается, что в этом процессе могут участвовать гамма-дельта-Т-клетки [4–6].
Гамма-дельта-Т-лимфоциты стали активно изучаться недавно. На данный момент выявлена их способность распознавать некоторые антигены и выступать в роли антигенпрезентирующих клеток (АПК). Кроме того, они обладают цитотоксическими свойствами, поэтому рассматриваются как потенциальные терапевтические мишени [7].
Гамма-дельта-Т-лимфоциты, так же как B1-лимфоциты, образуются в онтогенезе раньше других Т-лимфоцитов. Они локализуются преимущественно на коже и слизистых оболочках, в том числе в лимфоидной ткани, ассоциирующейся со слизистой оболочкой кишечника.
Недостаточность популяции интраэпителиальных гамма-дельта-Т-клеток может обусловить развитие некротических энтероколитов [8], что свидетельствует о регуляторных свойствах этих клеток.
Способность гамма-дельта-Т-клеток влиять на образование антител В1-клетками прямой экспериментальной проверке не подвергалась, и вопрос об их роли в переключении синтеза с IgM на IgA в В1-клетках кишечника по-прежнему остается открытым. Однако имеется достаточное количество сообщений о влиянии некоторых субпопуляций гамма-дельта-Т-клеток на уровень нормальных иммуноглобулинов в организме [9].
Изучение особенностей переключения на IgA B1-клеток кишечника позволит разработать новые терапевтические подходы к лечению заболеваний кишечника инфекционной и неинфекционной природы. Учитывая высокую затратность экспериментальных исследований, представлялось необходимым сузить круг задач и использовать биоинформационные методы анализа.
Целью данной работы стало проведение биоинформационного анализа для выявления возможных путей взаимодействия B1-лимфоцитов с гамма-дельта-Т-клетками, которые могут иметь отношение к гуморальному иммунному ответу на ТН-2-агенты, а также роли малых РНК (miRNA) в продукции антител, активации и пролиферации B1-клеток.
Материал и методы
В биоинформационном исследовании использована программа Pathway Studio® и реферативная база данных ResNet® компании Ariadne Genomics (США).
Объектами изучения стали аннотации биологических объектов (в частности, белков, клеточных процессов и болезней), а также функциональные связи между ними, сформированные в результате обработки текстового массива полнотекстовых статей и абстрактов, индексированных в MEDLINE.
В качестве модели случайного пересечения множеств использовалось гипергеометрическое распределение. Распределение процессов по приоритетам проводилось программой. Чем меньше значение p, тем больше вероятность, что гены, попавшие в конкретный процесс, отнесены к нему не случайно. Результат считался значимым при p = 0,01. С увеличением генеральной совокупности значение p уменьшается, то есть вероятность того, что в произвольной выборке количество отмеченных объектов не случайно, возрастает.
Результаты и их обсуждение
Нами проанализирован список генов (база данных ResNet®), имеющих отношение к В1- и гамма-дельта-Т-клеткам, транскрипция которых достоверно регулируется внутриклеточными сигнальными каскадами, описанными в литературе.
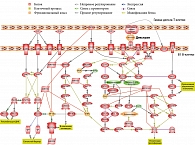
Результаты проведенной работы подтвердили, что гамма-дельта-Т-клетки участвуют в функционировании В1-лимфоцитов. На рисунке 1 представлены возможные пути взаимодействия этих субпопуляций.
Один из таких сигнальных путей приводит к продукции IgM. Как было отмечено ранее, B1-клеткам для ответа на антиген и синтеза/секреции антител не требуется помощь классических Т-клеток. ТН-2-антиген альфа (1→3) декстран благодаря своей структуре с регулярно повторяющимися одинаковыми эпитопами вызывает перекрестное связывание (кластеризацию) нескольких комплексов BCR и таким образом обеспечивает сигнал, достаточный для активации В1-лимфоцитов. Первыми образуются IgM-антитела.
Важную функцию в переключении изотипов иммуноглобулинов В-клетками с IgM на другие классы выполняет индуцированная активацией цитидин дезаминаза (AID). AID участвует в соматическом гипермутировании (SHM), конверсии генов и рекомбинации при переключении изотипов иммуноглобулинов в B-клетках иммунной системы. В настоящее время AID признана основным ферментом, обеспечивающим разнообразие изотипов иммуноглобулинов.
У мышей с врожденным дефицитом AID количество непатогенных анаэробных бактерий в тонкой кишке увеличено. Кроме того, у них образуется много лимфоидных фолликулярных структур, выстилающих тонкую кишку. У пациентов с иммунодефицитом изменена кишечная микрофлора. Дисбаланс микрофлоры кишечника и других слизистых оболочек связан с блокировкой AID-опосредованной рекомбинации при переключении изотипа (для получения IgA) в В-лимфоцитах [10].
Механизм действия AID заключается в замене цитидина на уридин в молекуле ДНК, что приводит к точечным мутациям и рекомбинации генов иммуноглобулинов.
Результаты проведенного биоинформационного анализа продемонстрировали, что AID играет большую роль в функционировании В1-клеток.
Нами установлено, что транскрипционный фактор каппа-би (NF-κB) способствует индукции AID в В1-клетках, а также интерлейкинов (IL) 2 и 4 Т-лимфоцитами. IL-2 влияет на дифференцировку и пролиферацию Т-лимфоцитов, вырабатывается Т-клетками в ответ на антигенную и митогенную стимуляцию. Для образования IL-2 гамма-дельта-Т-клетками требуется стимуляция через CD28 [11]. Другой цитокин, вырабатываемый Т-клетками, – IL-4. Он регулирует рост и дифференцировку В-лимфоцитов, а также процессы биосинтеза и секреции антител. Установлено, что его могут вырабатывать гамма-дельта-Т-лимфоциты, в частности, при контактных дерматитах, вызванных стероидами [12].
Таким образом, данные, полученные с помощью биоинформационного анализа, позволяют спрогнозировать влияние гамма-дельта-Т-клеток на B1-лимфоциты посредством выработки IL-2 и -4.
Был выявлен также ряд маркеров, вовлеченных в функциональную активность В1-лимфоцитов. Распознавание IL-2 рецепторами (IL-2RG и IL-2RB) приводит к активации тирозинкиназ JAK1 и JAK3. Активация JAK1 происходит также при активации рецептора IL-4 (IL-4R). JAK1 и JAK3 обеспечивают фосфорилирование STAT6 и STAT5A, за счет чего происходит активация AID и RAG-полимеразы (RAG1 и RAG2) (RAG – ген, активирующий рекомбинацию).
Таким образом, воздействие IL-2 и -4 на B1-клетки должно вызывать рекомбинацию V-генов иммуноглобулинов. Ранее было показано, что STAT6 и NF-kB ассоциированы с индукцией ряда генов [13–15] и между этими факторами транскрипции существует взаимодействие [16]. Синергический эффект STAT6 и NF-kB, по-видимому, лежит в основе связи между распознаванием IL-4 и CD40 и индукцией экспрессии гена AID [17].
Еще один фактор, который был выявлен в результате биоинформационного анализа, – рецептор CD40. Последний при взаимодействии с CD40L (CD154) способен вызывать активацию и пролиферацию B-клеток. Следует отметить, что лиганд CD40 – CD40L является характерным маркером для CD4+-Т-клеток и нетипичным – для гамма-дельта-Т-клеток. Однако в литературе упоминается о CD4+-гамма-дельта-Т-лимфоцитах [18] и об экспрессии CD40L на активированных гамма-дельта-Т-лимфоцитах [19].
Гамма-дельта-Т-клетки могут выступать как АПК для CD4+-T-лимфоцитов [20], что позволяет предположить косвенное их влияние на иммунный ответ.
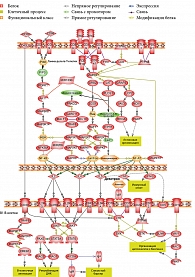
По мере старения B1-клетки мыши перестают экспрессировать в больших количествах костимулирующую молекулу CD86 и становятся мощными активаторами CD8+-T-клеток [21], а так как часть гамма-дельта-Т-лимфоцитов в кишечнике являются CD8+, нельзя исключать возможность прямого взаимодействия B1-клеток с гамма-дельта-Т-клетками (рис. 2).
В разных источниках встречаются данные о том, что В1-клетки могут быть и ТЗ. B B1-клетках отсутствуют существенные дефекты, которые не позволяли бы отвечать на Т-клеточные стимулы, включая CD40L, IL-4 и -5 [22]. IL-5 также способен стимулировать пролиферацию B1-клеток в отсутствие CD40 – CD40L взаимодействия [23].
Опираясь на анализ литературы и результаты, полученные с использованием биоинформационного анализа, можно предположить, что подобное взаимодействие между В1- и гамма-дельта-Т-клетками возможно.
Установлено, что регуляция на уровне miRNA и др. критична для развития и нормального функционирования иммунной системы. Позднее был выявлен ряд miRNA, которые могут участвовать на разных стадиях гемопоэза [24] и вносить вклад в окончательную дифференцировку взрослых лимфоцитов [25].
В большинстве случаев miRNA выступают в роли ингибиторов внутриклеточных процессов. Так, проведенный нами анализ позволил получить данные о влиянии miRNA155 и miRNA146a на AID, приводящем к ее угнетению как напрямую, так и опосредованно через подавление NF-kB [26]. Рецептор Notch, регулирующий клеточную дифференциацию, является типичной мишенью для miRNA326 [27]. В дифференциации B-клеток немаловажную роль играет miRNA181A [27].
Используемый нами метод позволил проанализировать несколько видов miRNA, а также установить возможные точки их воздействия на основные внутриклеточные процессы.
Оценка вклада некоторых miRNA в эти процессы может служить альтернативным подходом для анализа взаимодействия B1- и гамма-дельта-Т-лимфоцитов.
Данное научное направление представляет интерес не только в области фундаментальной иммунологии. Известно, что B1- и гамма-дельта-Т-клетки участвуют в развитии ряда заболеваний. Так, В1-лимфоциты задействованы в развитии Th2-опосредованного колита [28], а гамма-дельта-Т-клетки могут играть протективную роль для эпителиальных клеток и содействовать развитию воспалительных процессов [29]. Исследование механизмов активации или супрессии воспаления в кишечнике позволит в перспективе выявить мишени для терапевтического воздействия и реализовать персонализированный подход.
Полученные в исследовании данные свидетельствуют, что B1- и гамма-дельта-Т-клетки могут выступать в качестве новых терапевтических мишеней.
Терапия многих заболеваний (в частности, воспалительных и инфекционных) тесно связана с молекулярными технологиями. Подходы к miRNA-опосредованной регуляции активности клеток занимают в ней не последнее место. Они потенциально могут быть использованы для регуляции воспалительных процессов в кишечнике.
Однако остается ряд вопросов: создание комплексного препарата или монопрепаратов, которые будут менять ряд клеток или будут направлены только на определенный эффект, а также доставку нуклеиновых кислот (регуляторных РНК).
Заключение
Биоинформационный подход, используемый нами для прогнозирования путей взаимодействия B1- и гамма-дельта-Т-лимфоцитов, позволил определить наиболее вероятные из них и основные сигнальные каскады, участвующие в таком взаимодействии. Кроме того, метод дал возможность спрогнозировать участие некоторых видов miRNA в этих процессах.
Дальнейшее изучение связи между B1- и гамма-дельта-Т-лимфоцитами позволит по-новому взглянуть на патогенез ряда заболеваний, в которых участвуют субпопуляции этих клеток.
O.A. Svitich, N.A. Snegireva, V.V. Sobolev, I.N. Dyakov, I.M. Korsunskaya, V.V. Zverev
I.I. Mechnikov Research Institute of Vaccines and Sera
Center for Theoretical Problems of Physicochemical Pharmacology
Contact person: Oksana Anatolyevna Svitich, svitichoa@yandex.ru
B-1 lymphocytes represent a separate subpopulation of B cells in the human body and mice, and participate in the first line of defense against infection. They are able to respond to T-independent type 2 antigens (without the involvement of T cells). It is known that B-1 lymphocytes are localized primarily in the serous cavities (abdominal and pleural) and in the lymphoid tissue of the mucous membranes. In the intestinal mucosa B-1 cells produce a significant portion of IgA. Usually, signals from T lymphocytes are required to switch immunoglobulin isotypes; however, it is known that the isotype is switched from IgM to IgA in T-independent B-1 cells which do not receive classical Th-aid in the small intestine. It is assumed that γδТ cells can participate in this process, which, like B-1 lymphocytes, appear earlier than other T cells in ontogenesis and have the localization in the body similar to B-1 cells. The identification of the mechanisms of B-1 and γδT lymphocytes interaction in the process of immune response to TI-2 antigens is an urgent task. To predict possible ways of such interaction bioinformatics analysis was used. As a result, data about cell markers and key signaling pathways that can participate in this interaction were obtained. Also, data have been obtained about miRNA, regulatory intracellular structures, which can affect individual components of the signaling pathways.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.