Болевая диабетическая невропатия: клинические аспекты
- Аннотация
- Статья
- Ссылки
- English


В мире около 400 млн человек страдает сахарным диабетом, что составляет приблизительно 8–9% взрослого населения. Сахарный диабет связан с рядом тяжелых осложнений. Практически у каждого второго больного развивается клинически значимое поражение периферической нервной системы, ассоциированное с негативным прогнозом диабета [1]. Распространенность болевого синдрома колеблется от 10 до 20% среди больных сахарным диабетом и от 40 до 50% среди пациентов с диабетической невропатией (ДН) [2]. Болевая ДН ассоциирована с повышенным дистрессом и низким качеством жизни по сравнению с ДН без болевого компонента. Боль может стать причиной нарушения профессиональной деятельности, нарушения сна, развития депрессии.
Фенотипические варианты болевой диабетической невропатии
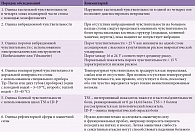
Фенотипы ДН различаются по месту сосредоточения боли. Для диффузных форм типична диффузная вовлеченность болевого синдрома. Фокальные формы могут сопровождаться локализованной болью, но они встречаются редко – с частотой от 1 до 5% среди больных диабетом (табл. 1).
Классификация диффузных форм ДН связана с временным фактором, позволяющим выделить два наиболее распространенных типа ДН, ассоциированных с болью: острую сенсорную невропатию и хроническую дистальную сенсомоторную полиневропатию (ДСПН). Острая сенсорная невропатия характеризуется изолированным болевым синдромом без каких-либо других неврологических признаков. Обычно это остро возникшие жгучие боли, которые локализуются в подошвах стоп («как будто ходишь по горячему песку») и усиливаются ночью. Прикосновения к кожным покровам стоп одежды или обуви причиняют дискомфорт, который можно объективизировать как гиперсенситивность к тактильным (аллодинию) и болевым (гипералгезию) стимулам. Началу острой сенсорной невропатии предшествует стремительная и значительная потеря веса как ответ на адекватный гликемический контроль. Обычно болевой синдром теряет интенсивность в течение нескольких месяцев и не рецидивирует. Исторически для описания синдрома острой сенсорной невропатии использовались термины «диабетическая невропатическая кахексия» и «инсулиновый неврит». Последний термин применялся к случаям развития болевого синдрома в течение нескольких недель после начала терапии инсулином. Стремительная интенсификация гликемического контроля от выраженной гипергликемии до эугликемии – важный фактор риска развития острой сенсорной невропатии. Но, как правило (до 90%), боль сопутствует самой распространенной (около 75% от всех ДН) симметричной восходящей ДСПН. Именно болевому синдрому, связанному с ДСПН, – самому частому осложнению диабета и посвящен настоящий обзор.
Патогенетические механизмы
Боль – один из основных и нарушающих качество жизни симптомов ДН, но ее физиологические основы до конца не известны. Несмотря на целостное понимание патофизиологических механизмов, приводящих к развитию ДН, правдоподобной гипотезы, почему у одних индивидуумов развиваются болевые формы заболевания, а у других нет, на сегодняшний день не существует.
Эпидемиологические исследования свидетельствуют, что болевая ДН ассоциируется с избыточной массой тела (ожирением), заболеванием периферических артерий и низким уровнем физической активности [3]. Механизмы, лежащие в основе болевой ДН, аналогичны другим невропатическим болевым расстройствам, при которых формируется периферическая и центральная сенсибилизация. Обычно боль рассматривается как один из сенсорных симптомов манифестации невропатии, в основе которых лежит прямое повреждение нервного волокна, в частности слабомиелинизированных А-дельта-волокон и немиелинизированных С-волокон. Но интенсивность боли не зависит от тяжести невропатии, и боль может возникать даже в отсутствие повреждения периферических нервов [4]. Разнообразные проявления невропатической боли при диабете и различные ответы на стандартное лечение заставляют предполагать участие всевозможных механизмов в формировании боли. В недавних исследованиях патофизиологии болевой ДН были установлены дезадаптивные изменения на уровне как периферической, так и центральной нервной системы.
Большое значение в формировании боли имеет повреждение нервных окончаний. Поврежденные нервные окончания продуцируют возбуждающие потенциалы действия, которые интерпретируются центральной нервной системой как боль или дизестезия (спонтанные болевые ощущения). Прямым результатом повреждения нервного волокна становится изменение экспрессии ионных каналов, приводящее к периферической гипервозбудимости [5], что непосредственно связано с невропатической болью. Как показали генетические исследования, пациенты с особенностями вольтаж-зависимых натриевых каналов могут быть более подвержены риску развития невропатической боли в присутствии такого триггера, как диабет [6]. Современные исследования in vitro демонстрируют прямую связь между уровнем глюкозы и биофизиологическими изменениями натриевых каналов [7]. Для пациентов с болевой ДН характерен повышенный ток Na+ по сравнению с пациентами с безболевой невропатией, что может усиливать возбудимость периферических нервов. Регуляция кальциевых каналов также нарушается в связи с диабетом, в результате увеличивается приток кальция в сенсорные нейроны [8], что сопровождается быстрым выбросом субстанции Р и высвобождением глутамата. Это в конечном итоге приводит к сенситизации нейронов. Экспериментальные исследования на преклинических моделях диабета демонстрируют, что дегликолизация ингибирует кальциевый ток в ноцицепторах и селективно редуцирует гипералгезию [9].
Болевая ДН может быть результатом изменений, касающихся не только периферического, но и центрального отдела нервной системы. Аллодиния, будучи типичным симптомом болевой ДН, служит аргументом в пользу вовлеченности центральной нервной системы в процессы формирования и поддержания боли [10]. Среди факторов, которые могут становиться причиной гиперактивности спинальных нейронов при ДН, важнейшим является повышение выброса глутамата при первичной афферентной трансмиссии в спинном мозге. Функциональные изменения в зонах центральной нервной системы, обеспечивающих болевую трансмиссию за пределами спинного мозга, хорошо описаны и у пациентов с сахарным диабетом, и на экспериментальных моделях [11]. Функциональные нейровизуализационные исследования демонстрируют чрезмерную активность различных зон мозга, включая медиальные ядра таламуса, после раздражения стоп термальными стимулами у больных диабетом [12]. Кроме того, у пациентов с болевой ДН уровень N-ацетил-аспартата в таламусе выраженно меньше, чем у пациентов без болевого синдрома [13]. Необходимо отметить, что при неврологических заболеваниях, ассоциированных с утратой нейронов или их дисфункцией, наблюдается последовательное снижение концентрации N-ацетил-аспартата в мозге. Это позволяет рассматривать болевую составляющую ДН с позиции нейродегенерации.
Изменения в эндогенной системе ингибирования боли также были описаны в доклинических и клинических исследованиях ДН. Многие из них касались уровней основных нейротрансмиттеров эндогенного контроля боли в различных зонах центральной нервной системы на животных моделях диабета, но они продемонстрировали противоречивые результаты, особенно на уровне спинного мозга. Были получены доказательства сниженного уровня норэпинефрина в стволе мозга и таламусе, но более высокая его концентрация в коре головного мозга животных с диабетом [14]. Кроме того, было показано нарушение индуцированного опиоидами спинального выброса серотонина, что, возможно, объясняет низкий ответ на опиоиды, характерный для экспериментальных моделей ДН [15]. Для пациентов с диабетом и позитивными симптомами невропатии свойствен дисбаланс между ингибиторными и возбуждающими нейротрансмиттерами. Например, уровень гамма-аминомасляной кислоты был значительно ниже, а уровень глутамата значительно выше в задней части островка, а также коэффициент глутамата/гамма-аминомасляной кислоты был выше в таламусе у пациентов с диабетом [16]. Эти изменения могут вносить значимый вклад в формирование болевой ДН, но необходимы дальнейшие исследования для точного определения их клинического значения.
Клиническая манифестация
ДСПН возникает у каждого второго больного сахарным диабетом, а у около 20% (почти каждого пятого) развиваются невропатические боли (болевые ДСПН) [17]. Спектр ощущений индивидуален и чрезвычайно широк: от умеренной до нестерпимой боли. Вместе с тем некоторые пациенты с выраженной невропатией могут не испытывать боли даже при изъязвлении стопы. Выраженность боли не коррелирует с тяжестью сенсомоторного дефицита и осложнениями ДН.
Современные исследования опровергают бытовавшие представления об улучшении болезненных симптомов по мере ухудшения тяжести невропатии. Так, обсервационное исследование с применением стандартных инструментов оценки тяжести невропатии (Шкалы невропатического симптоматического счета (Neuropathy Symptomatic Score – NSS) и Шкалы невропатического дисфункционального счета (Neuropathy Dysability Score – NDS)), включавшее широкомасштабную когорту больных диабетом (n = 15 692), показало сопоставимую распространенность болезненных симптомов у пациентов с легкой и более тяжелой ДН [18]. Болевой синдром выявлялся у 21% больных с умеренно выраженной (NSS ≥ 5 баллов и NDS > 3 баллов) и 60% пациентов с тяжелой невропатией (NDS > 8 баллов). В то же время болевые симптомы наблюдались в 26% случаев без признаков невропатии.
Следует отметить, что распространенность болевой ДН зависит от типа диабета – риск развития болевой ДН удваивается при диабете второго типа. Кроме того, у женщин риск болевой ДН на 50% выше, чем у мужчин.
Типичный признак болевой ДН – жалобы на боль и гипералгезию в ногах, которые обычно усиливаются ночью и ослабевают во время ходьбы. Боль может быть постоянной или эпизодической и возникает преимущественно в ногах. По данным клинического исследования, изучавшего локализацию боли у пациентов с болевой ДСПН (n = 105), чаще всего боль затрагивает стопы (96%), подушечки стоп (69%), большой палец стопы (67%), дорзальную поверхность стоп (54%) и значительно реже кисти (39%), плантарную поверхность стоп (37%), голени (37%), область пяток (32%) [19]. При описании неприятных ощущений пациенты, как правило, отмечают жжение, покалывание, стреляющие или ноющие боли, онемение в ногах. Эти ощущения могут появляться или усиливаться при соприкосновении кожных покровов ног с одеждой, постельным бельем (аллодиния). Иногда пациенты, описывая боль, используют более яркие сравнения: горит, бьет электрическим током, колет, мозжит. Интенсивность болезненных ощущений может колебаться от слабых симптомов в одном пальце ноги до тягостных симптомов в обеих ногах [20]. В среднем интенсивность боли умеренная – 5,75 балла по десятибалльной шкале (минимальная боль – 3,6 балла, а максимальная – 6,9 балла) [19]. Характеристики (дескрипторы) и тяжесть боли могут меняться по мере развития ДН. Естественное течение болевой ДН флуктуирующее, и большинство пациентов со временем испытывает самопроизвольное улучшение и даже полное разрешение боли. Однако, по данным небольшого проспективного исследования (n = 56), у 77% больных болезненные симптомы не ослабевали после пятилетнего периода наблюдения [21].
Диагностика
Следует особенно подчеркнуть, что необходимо расспрашивать о болевых симптомах всех пациентов с сахарным диабетом, а не только тех, кто имеет клинические проявления невропатии. Это обусловлено тем, что почти у трети пациентов боль – единственный симптом невропатии. Диагноз болевой невропатии базируется на описании пациентом боли и типичных проявлениях периферической невропатии, в частности нарушениях со стороны сенсорной сферы и отсутствии/снижении ахилловых и коленных рефлексов. Важно исключать возможные недиабетические причины боли, например боли, связанные с артритами, сосудистыми заболеваниями нижних конечностей, злокачественными новообразованиями, стенозом позвоночного канала и другими (недиабетическими) невропатиями. К поиску иных причин (злоупотребление алкоголем, уремия, гипотиреоз, дефицит витамина В12) невропатии и более детальному неврологическому обследованию клинициста должны побуждать следующие клинические факторы:
- выраженная асимметрия неврологического дефицита;
- преобладание моторных нарушений над сенсорными, мононевропатия, поражение черепно-мозговых нервов;
- быстрое развитие или прогрессирование невропатических нарушений;
- прогрессирование невропатии, несмотря на оптимальный гликемический контроль;
- развитие симптомов невропатии только в верхних конечностях;
- семейный анамнез недиабетической невропатии.
Диагноз невропатии не может устанавливаться по клиническому обследованию.
Три ключевых симптома отличают невропатическую диабетическую боль от ноцицептивной: колющая боль, онемение, усиление боли при прикосновении. И все они входят в перечень характеристик шкалы NSS.
Значительно облегчают работу клинициста специально разработанные Общая шкала оценки неврологических симптомов (Total Symptoms Score – TSS) и Анкета для определения боли (Identification Pain Questionnaire – ID-P). Для клинического подтверждения ДСПН наиболее надежны два скрининговых теста: оценка тактильной чувствительности на стопе с помощью монофиламента и вибрационной чувствительности большого пальца ноги [12]. Алгоритм расширенного исследования представлен в табл. 2 [22].
Дополнительно оценивается скорость проведения возбуждения по моторным и сенсорным волокнам для выявления субклинического поражения быстропроводящих (толстых) волокон. Однако болевой синдром может быть клиническим маркером поражения тонких немиелинизированных волокон. В случае изолированного повреждения тонких волокон скорость проведения возбуждения будет нормальной. В такой ситуации рекомендуется провести обследование, направленное на обнаружение возможного поражения вегетативных волокон. Для ранней диагностики автономной невропатии выполняют тестирование кардиоваскулярных рефлексов (это наиболее простая, неинвазивная, высокочувствительная и воспроизводимая методика). Оно включает оценку частоты сердечных сокращений в покое (паталогическое значение более 100 уд/мин), вариабельности сердечного ритма (лежа, при глубоком дыхании и при ортопробе), подъема артериального давления при проведении пробы Вальсальвы, частоты сердечных сокращений и систолического давления через две минуты после перехода из горизонтального в вертикальное положение, диастолического давления на изометрическое усилие и расчет нормированного QT-интервала. Патологические результаты двух или более тестов подтверждают поражение тонких вегетативных волокон, иннервирующих сосуды и сердце. Альтернативными методами диагностики автономной невропатии могут служить частотные показатели кардиоинтервалографии и 24-часовой мониторинг вариабельности сердечного ритма. Последний метод более чувствителен, чем стандартные кардиальные тесты, и может верифицировать вегетативные нарушения на ранних стадиях болезни.
Наконец, в диагностически сложных случаях может помочь метод кожной биопсии. Его преимущество заключается в том, что он позволяет одновременно оценить состояние миелинизированных и немиелинизированных волокон.
Лечение
Несмотря на яркость симптома, по тем или иным причинам 13% пациентов с болевой ДН не жалуются на боль и более трети (39%) пациентов не получают никакого лечения по поводу боли [23]. Но даже пациенты, которым проводится терапия, в большинстве случаев не удовлетворены ее результатами. К сожалению, из-за ограниченного понимания механизмов, приводящих к болевой ДСПН, текущие методы лечения остаются неадекватными. Еще одним фактором, который затрудняет ведение пациентов с невропатической болью, является разнообразный ответ на различные методы лечения. Только комплексная терапия, включающая патогенетические и симптоматические средства, способна обеспечить полноценное улучшение состояния пациента.
Патогенетическое лечение
На процессы, лежащие в основе невропатии, патогенетические препараты потенциально оказывают более благоприятное влияние, чем симптоматические средства, купирующие боль. Важность контроля глюкозы крови (на уровне HbA1c < 7%) признается всеми экспертами. Но поскольку в обозримом будущем достижение нормогликемии у большинства пациентов не представляется возможным, особое значение приобретает лечение, направленное на редукцию патогенных эффектов гликемии, в частности окислительного стресса. Опосредованный свободными радикалами окислительный стресс индуцирует нейроваскулярную дисфункцию, в результате которой формируется эндоневральная гипоксия и происходит последующее повреждение нервных волокон. Редукция окислительного стресса с помощью альфа-липоевой кислоты на моделях экспериментального диабета демонстрирует превентивный эффект в отношении нервного волокна и дает рациональное обоснование ее использования у больных диабетом.
На протяжении свыше 40 лет препараты альфа-липоевой кислоты применяются для лечения ДН. Согласно метаанализу (n = 1258), инфузии альфа-липоевой кислоты (600 мг/сут в/в) в течение трех недель купировали невропатические симптомы и редуцировали неврологический дефицит [24]. Более того, ставшее классическим исследование SYDNEY показало, что пятинедельная терапия альфа-липоевой кислотой (600 мг перорально) приводила к выраженному улучшению состояния больных ДН, влияя на боль, парестезии и онемение [25]. Интерес представляет многоцентровое рандомизированное четырехлетнее клиническое исследование NATHAN 1, в которое вошли 460 пациентов с ДН. После четырех лет наблюдения в группе, получавшей плацебо, имело место значимое прогрессирование неврологического дефицита. Напротив, в группе, леченной альфа-липоевой кислотой, симптомы невропатии регрессировали, причем терапия хорошо переносилась [26]. Клиническое использование и постмаркетинговые наблюдательные исследования также подтвердили благоприятный профиль безопасности альфа-липоевой кислоты.
Эспа-Липон® – препарат альфа-липоевой кислоты отличается наиболее хорошо изученным спектром переносимости различных форм. В крупном клиническом исследовании Espalipon II были показаны эффективность и хорошая переносимость препарата в лечении ДН. Больные с ДН (n = 3509) получали Эспа-Липон® в дозе 600 мг/сут. Целью исследования стала оценка эффективности и переносимости различных форм препарата – растворов для внутривенных инфузий и таблеток. Эффективность препарата как очень хорошую и хорошую оценили 83% лечащих врачей и 80% пациентов. В 95% случаев лечащие врачи и в 95% случаев пациенты таким же образом охарактеризовали его переносимость [27].
В исследовании Л.В. Недосуговой (2007) специально уделялось внимание редукции боли под влиянием Эспа-Липона. Препарат в течение трех недель вводили внутривенно в виде инфузий (по 600 мг/сут), а затем назначали перорально (по 600 мг/сут) на три – шесть месяцев. Болевую чувствительность определяли в баллах по шкале Mc Greii на обеих нижних конечностях, где 0 баллов – полное отсутствие боли, 20 баллов – очень сильная боль. Через три недели лечения интенсивность боли снизилась почти на 50% (с 15,7 ± 1,19 до 8,4 ± 1,02 балла), а через три месяца – на 80% (до 3,4 ± 1,49 балла) [28].
Нами обобщен клинический опыт использования Эспа-Липона в качестве патогенетической терапии болевой ДСПН. В открытое исследование было включено 22 пациента, распределенных на две группы: с длительностью болевого синдрома менее двух месяцев (n = 10) и более двух месяцев (n = 12). Диагноз ДСПН устанавливался на основании клинической картины – нарушения тактильной и вибрационной чувствительности в стопах согласно протоколу (см. табл. 2) и наличия сахарного диабета согласно Диагностическим критериям сахарного диабета и других нарушений гликемии (ВОЗ, 1999–2013). Средний возраст больных – 62,8 ± 6,3 года. Уровень HbA1c в крови пациентов – от 7,6 до 9,2%. Для верификации невропатической боли применялся опросник DN4. Критерий включения пациентов – сумма баллов по шкале DN4 4 балла и более. Средний балл по шкале DN4 составил 6,2 ± 1,1. Между анализируемыми группами не было значимых различий по полу, возрасту, тяжести сахарного диабета. Всем пациентам выполнялись инфузии препаратом Эспа-Липон® (по 600 мг/сут, курс – 15 введений) с дальнейшим переходом на таблетированную форму (по 600 мг/сут) в течение трех месяцев. Для оценки эффективности использовалась 100-миллиметровая Визуальная аналоговая шкала (ВАШ), выраженность болевого синдрома колебалась от 50 до 90 мм (в среднем 71 мм).
К концу терапевтического курса Эспа-Липона интенсивность боли достоверно снизилась в обеих группах (табл. 3). Однако в первый месяц применения Эспа-Липона редукция отмечалась только в группе с меньшей длительностью болевого синдрома. Уже через четыре недели лечения у пациентов первой группы зафиксированы достоверные позитивные изменения в интенсивности боли. Через три месяца терапии наблюдалась полная редукция боли у 40% больных первой группы и только у 8,3% пациентов второй группы. В последующем симптоматическая терапия потребовалась 20% пациентов в первой группе и 41,7% во второй. Таким образом, Эспа-Липон® начал действовать раньше и продемонстрировал более высокую эффективность в группе с меньшей длительностью болевого синдрома.
В ходе исследования отмечена хорошая переносимость Эспа-Липона. Важно, что обобщенный клинический опыт свидетельствует в пользу целесообразности возможно более раннего назначения Эспа-Липона после развития болевого невропатического синдрома у больных сахарным диабетом.
Накопленные к настоящему времени данные позволяют рассматривать Эспа-Липон® как весьма перспективный препарат для патогенетического воздействия на болевую ДН.
Симптоматическое лечение
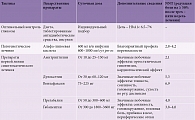
Симптоматическое лечение может вызывать серьезные затруднения. Залог эффективного лечения боли – баланс между достаточным купированием боли и вероятными побочными эффектами проводимой терапии. В отличие от лекарств патогенетической направленности симптоматические препараты модулируют боль без значимого влияния на невропатию. Нестероидные противовоспалительные препараты и простые анальгетики не способны контролировать боль, ассоциированную с ДН. Обычно пациентам поэтапно назначаются препараты, зарегистрированные для лечения невропатической боли. Для оценки анальгетических возможностей того или иного средства в клинической практике можно использовать простой инструмент – среднее число пациентов, которых необходимо пролечить, чтобы достичь определенного благоприятного исхода (Number Needed to Treat – NNT). Этот показатель помогает практическому врачу индивидуально подобрать анальгетическую терапию. Величины NNT для препаратов, наиболее часто назначаемых при болевой ДСПН, приведены в табл. 4 [29].
Психотропные препараты, в частности трициклические антидепрессанты. Эти препараты наиболее хорошо изучены и применяются уже более 30 лет для лечения хронических болевых синдромов. Их основной механизм обезболивания – активация системы центрального нисходящего контроля, что опосредованно нивелирует гипералгезию и аллодинию. Имипрамин, амитриптилин и кломипрамин сбалансированно ингибируют обратный захват норэпинефрина и серотонина. Среди 100 пациентов с диабетической невропатической болью, которые лечатся антидепрессантами, у трети боль редуцирует на 50%. Чаще в свободной клинической практике используется амитриптилин. Чтобы минимизировать побочные эффекты, его следует титровать. Инициальная доза – 25 мг (или 10 мг для особенно чувствительных пациентов) принимается один раз в вечернее время (за один час до сна), затем она постепенно наращивается. Средняя терапевтическая доза составляет 75 мг/сут, максимальная доза – 150 мг/сут. Анальгетический эффект амитриптилина реализуется быстрее (не позднее чем через две недели), чем антидепрессивный. В качестве альтернативных средств с меньшим седативным и антихолинергическим эффектом могут рассматриваться дезипрамин или препараты двойного действия (дулоксетин и венлафаксин). Длительность лечения – от 12 недель до шести месяцев.
Модуляторы кальциевых каналов (альфа-2-дельта-лиганды). Важный представитель этой группы – габапентин относится к классу противосудорожных препаратов, используемых для лечения болевой ДСПН. Габапентин структурно связан с гамма-аминомасляной кислотой и играет значимую роль в передаче и модуляции боли. Прегабалин – более специфический альфа-2-дельта-лиганд, имеющий более (в шесть раз выше) выраженное сродство к рецепторам, чем габапентин. При приеме прегабалина в дозе 600 мг/сут снижение боли на 50% наблюдалось у 47% больных (NNT – 4,0). Блокаторы натриевых каналов (карбамазепин, окскарбазепин, ламотриджин) довольно часто используются для купирования невропатической боли, но не зарегистрированы для лечения болевой ДСПН. В клинической практике вышеописанные препараты разных классов, как правило, комбинируют, но исследовательских работ, демонстрирующих наиболее удачные комбинации, практически нет.
O.V. Vorob’eva, DM, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Olga Vladimirovna Vorob’eva, ovvorobeva@mail.ru
Over a quarter of diabetic neuropathy (DN) patients suffer from pain. Painful DN is associated with increased distress and low quality of life in contrast to the DN without a painful component. The article discusses the pathogenetic aspects and clinical manifestation, as well as the diagnostic algorithm as well as pathogenetic and symptomatic treatment of pain DN. Noted that the preparation of alpha-lipoic acid Espa-Lipon® can be successfully used as the basis of pathogenetic treatment of pain DN. Summarized the clinical experience of using Espa-Lipon® in monotherapy for the treatment of pain DN in 22 patients. The analysis indicates in favor of the reasonability of the earliest possible appointment of Espa-Lipon® after the development of pain neuropathic syndrome in patients with diabetes mellitus.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.