Тиоктовая кислота в патогенетической терапии диабетической полиневропатии
- Аннотация
- Статья
- Ссылки
- English

Диабетическая полиневропатия (ДПН) представляет собой наиболее частый вариант периферической невропатии в мире. Это связано с тем, что число больных сахарным диабетом (СД) неуклонно растет и давно приобрело, по определению Всемирной организации здравоохранения, характер эпидемии неинфекционного заболевания. В 2021 г. число больных СД в мире достигло 537 млн. Согласно прогнозу, этот показатель в 2045 г. составит 783 млн (IDF Diabetes Atlas, 2021). В мире насчитывается 541 млн человек с нарушением толерантности к глюкозе, что определяет высокий риск развития у них СД 2-го типа. Скорее всего к 2045 г. число больных СД будет значительно выше, чем предполагают эксперты IDF.
В настоящее время каждый десятый человек в мире страдает СД. По данным регистра больных СД, в России на 1 января 2021 г. на диспансерном наблюдении находилось 4 799 552 человека, что составляет 3,23% населения, причем у 92,5% больных выявлен СД 2-го типа [1]. Учитывая данные о распространенности СД в мире, можно предположить, что большое число россиян имеют недиагностированный СД. Подобная ситуация типична для многих стран мира.
Современные возможности контроля гипергликемии с помощью сахароснижающих препаратов (инсулинов, бигуанидов, ингибиторов альфа-глюкозидаз, инкретинов и др.) позволяют добиваться у большинства больных целевых значений гликемии натощак и после еды, целевого уровня гликогемоглобина. Вместе с тем хроническое нарушение углеводного метаболизма приводит к развитию типичных осложнений СД: диабетическому поражению почек, сетчатки и периферической нервной системы, которые в настоящее время выходят на первый план в качестве причины инвалидизации и смерти больных СД.
Поражение периферической нервной системы у больных СД многообразно: генерализованные поражения периферических нервов, мононевропатии, туннельные невропатии, множественные мононевропатии, радикулопатии, плексопатии. Генерализованные поражения (полиневропатии) могут быть сенсорно-моторными (самый частый вариант), селективно тонковолоконными (редкие формы) и селективно толстоволоконными (крайне редкие формы). Наибольшие медико-социальные и медико-экономические проблемы связаны с дистальной симметричной сенсорно-моторной ДПН [2]. Следует отметить, что сенсорные волокна поражаются при ДПН в первую очередь. Тонковолоконные невропатии чаще связаны с нарушением углеводного обмена [3].
ДПН в зависимости от клинической картины подразделяют на четыре стадии:
- стадия 0 – отсутствие невропатической симптоматики и невропатических знаков и нормальная электромиография (ЭМГ);
- стадия 1 – отсутствие жалоб, возможен минимальный неврологический дефицит, но при ЭМГ выявляется поражение по крайней мере двух нервов ног, одним из которых является сенсорный икроножный нерв (субклиническая, или бессимптомная, полиневропатия);
- стадия 2 – наличие жалоб и неврологического дефицита (симптомная полиневропатия):
- 2а (без двигательного дефицита);
- 2б (больной плохо стоит и ходит на пятках или не может этого делать);
- стадия 3 – нарушение из-за полиневропатии социальной и трудовой адаптации (диабетическая стопа, стопа Шарко, тяжелый болевой синдром и т.д.) [4].
Под ДПН понимают наличие симптомов и неврологических знаков (неврологического дефицита) поражения периферических нервов у больных СД при исключении других причин такого заболевания [5]. В основе клинической картины ДПН лежит прогрессирующая гибель нервных волокон (рис. 1) [6], причем причиной развития ДПН является гипергликемия. В связи с этим важно оценивать влияние контроля углеводного обмена на риск развития и прогрессирования ДПН. Согласно Кокрейновскому обзору, при СД 1-го и 2-го типов на фоне состояния, близкого к нормогликемии, риск развития ДПН достоверно и значительно уменьшается только при СД 1-го типа [7]. Кроме того, исследование ACCORD показало увеличение смертности при интенсивной сахароснижающей терапии у больных СД 2-го типа и отсутствие достоверного влияния на риск развития микрососудистых нарушений, что послужило поводом для прекращения исследования [8].
Хороший контроль СД крайне важен в целях профилактики развития ДПН, но необходимо также патогенетическое лечение ДПН препаратами, воздействующими на основные известные молекулярные и сосудистые механизмы, определяющие гибель волокон периферических нервов.
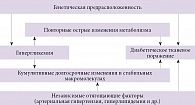
В основе патогенеза ДПН лежат окислительный стресс, воспалительные процессы и нарушение функции сосудов микроциркуляторного русла, а запускает каскад метаболических и сосудистых нарушений гипергликемия [9, 10]. Окислительный стресс, развитие которого при СД объясняется образованием большого числа свободных радикалов на фоне недостаточной активности собственных антиоксидантных ферментов, считается основной причиной клеточной патологии. Рассматривая факторы риска развития диабетической клеточной патологии, важно обращать внимание на длительные метаболические нарушения [11] (рис. 2), роль которых подтверждается уменьшением амплитуды двигательного и сенсорного потенциалов по мере увеличения длительности течения СД [12]. Не случайно для патогенетического лечения ДПН используют прежде всего лекарственные средства с антиоксидантным эффектом. Наиболее полно доказана эффективность лечения ДПН альфа-липоевой кислотой (АЛК), синтезированной в 1951 г. [13] и клинически вначале использовавшейся при отравлении грибами (в основном бледной поганкой) и патологии печени. АЛК является мощным естественным липофильным антиоксидантом, что определяет возможность ее терапевтического применения, и представляет собой рацемическую смесь R(+)- и S(–)-изомеров. При введении АЛК восстанавливается до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты, в том числе антиоксидантный. Дигидролипоевая кислота не применяется как фармакологический препарат из-за быстрого окисления при хранении.
В экспериментах на крысах показано, что АЛК уменьшает окислительный стресс, улучшает эндоневральный кровоток, электромиографические характеристики, увеличивает утилизацию глюкозы, предотвращает поражение гломерулярного аппарата почек [14, 15]. У больных с СД и ДПН при использовании АЛК отмечаются уменьшение окислительного стресса, улучшение микроциркуляции и эндотелий-зависимых реакций сосудистой стенки, нормализация содержания оксида азота и стресс-белков, снижение транскрипции NF-kB, улучшение состояния почек и углеводного обмена [16, 17].
В российской аптечной сети представлен ряд препаратов АЛК, производимых в Германии и России и выпускаемых в виде раствора для внутривенных капельных инфузий и таблетированной форме. Самым продаваемым в мире, в том числе в России, препаратом АЛК является Берлитион (компания «Берлин Хеми»). Поэтому у практических врачей имеется огромный опыт применения именно этого препарата.
АЛК при ДПН применяется в Германии с 1950-х гг. Поскольку использовались дозы от 50 до 300 мг, результаты исследований были противоречивыми. Первым рандомизированным контролируемым исследованием (РКИ), выполненным с соблюдением требований доказательной медицины, можно считать проведенное в Германии исследование Alpha-Lipoic Acid in Diabetic Neuropathy (ALADIN), которое показало высокую эффективность внутривенного введения АЛК [18]. 328 амбулаторных пациентов с СД 2-го типа были разделены на три группы АЛК в зависимости от дозы – 100, 600, 1200 мг и группу плацебо (14 инфузий в течение трех недель). Критерием оценки выраженности позитивной невропатической симптоматики при ДПН служила шкала TSS (Total Symptom Score, Общая шкала симптомов), по которой оценивали интенсивность и частоту типичных симптомов ДПН (стреляющая боль, жжение, онемение и парестезии) в течение последних 24 часов. Сумма баллов по отдельным симптомам позволяла количественно оценивать позитивную невропатическую симптоматику. Баллы по шкале TSS при использовании АЛК в дозах 600 и 1200 мг достоверно снижались через три недели по сравнению с группой пациентов, получавших 100 мг препарата или плацебо. Разницы в эффективности АЛК в дозе 600 и 1200 мг не отмечалось. В РКИ ALADIN были доказаны эффективность и высокая безопасность лечения ДПН внутривенным введением АЛК, а также показано, что оптимальным является внутривенное введение дозы 600 мг.
В дальнейшем в Германии было проведено исследование ALADIN III, в котором у больных СД 2-го типа двух амбулаторных групп (167 и 174 пациента соответственно) применялось внутривенное введение 600 мг АЛК или плацебо в течение трех недель [19]. Исследование ALADIN III подтвердило уменьшение позитивной невропатической симптоматики и показало возможность снижения неврологического дефицита (по шкале NIS LL, Neuropathy Impairment Score Lower Limb, Счет невропатического дефицита в ногах) у больных СД 2-го типа с ДПН при внутривенном введении АЛК.
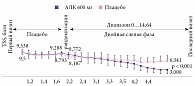
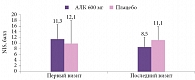
Первое РКИ эффективности АЛК при ДПН в России было проведено в 1999 г. Оно показало достоверное уменьшение баллов по шкале TSS при внутривенном введении АЛК в дозе 600 мг в течение трех недель по сравнению с плацебо [20]. Впоследствии в России было проведено рандомизированное двойное слепое контролируемое исследование SYDNEY 1 с тем же дизайном, что и исследование ALADIN [21]. Были обследованы до, во время и после лечения 120 больных СД 1-го и 2-го типов с симптомной ДПН, получавших внутривенно АЛК в дозе 600 мг или плацебо в течение трех недель, с использованием шкал TSS (ежедневная оценка) и NIS LL (оценка проводилась до и после лечения). Показана достоверная эффективность АЛК при внутривенном введении в отношении позитивной и, что крайне важно, негативной невропатической симптоматики (рис. 3 и 4). Преимуществом РКИ стало стационарное проведение с жестким контролем диеты, гликемии и физической активности.
Эффективность трехнедельного внутривенного введения АЛК больным СД (n = 241) по сравнению с плацебо (n = 236) в амбулаторных условиях с контролем по шкалам TSS и NIS в 33 диабетологических центрах США, Канады и Европы показана в исследовании NATHAN II Study (Neurological Assessment of Thioctic Acid II) [22].
Проведено несколько метаанализов эффективности АЛК при внутривенном введении у больных СД с ДПН в течение трех недель [23, 24]. Продемонстрирован достоверно лучший эффект АЛК на оценку позитивной неврологической симптоматики (TSS) по сравнению с плацебо, в том числе по отдельно взятым симптомам. Метаанализ подтвердил, что на фоне внутривенного введения АЛК (14–15 инфузий) при ДПН значительно уменьшается негативная неврологическая симптоматика.
В исследовании, проведенном после РКИ SYDNEY, продолжительность эффекта внутривенного введения 600 мг АЛК сохранялась около шести месяцев [25]. В данном аспекте представляет интерес исследование, проведенное в 2020–2021 гг., в котором 31 пациенту с СД 2-го типа с ДПН проводили курсы лечения внутривенным введением АЛК в дозе 600 мг. После первого курса следовал шестимесячный перерыв, а затем повторный десятидневный курс введения АЛК 600 мг. Показатели по шкалам TSS и NIS LL снизились после первого курса лечения и еще больше – после второго. Подобный эффект ассоциируется с повышением уровня антиоксидантных ферментов после курса лечения АЛК. Интересно, что после лечения АЛК отмечалось достоверное улучшение некоторых ЭМГ-показателей: амплитуды М-ответа большеберцового нерва, скорости проведения возбуждения по большеберцовому (двигательному) и икроножному (чувствительному) нервам [26].
В РКИ Oral Pilot Study (ORPIL) сравнивали эффективность применения таблеток АЛК 1800 мг (три приема в день) в течение трех недель и эффективность плацебо. В группе АЛК достоверно уменьшились симптомы и неврологический дефицит по сравнению с группой плацебо [27].
В РКИ, проведенном в 1999 г. в Германии, прием 1800 мг АЛК в виде таблеток вызывал достоверно большее уменьшение позитивной невропатической симптоматики (по шкале TSS), чем прием таблетированного плацебо [28].
В многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании SYDNEY 2, проведенном в России, 181 пациент получал АЛК 600 мг один раз в день (n = 45), 1200 мг (n = 47) и 1800 мг (n = 46) или плацебо (n = 43) в течение пяти недель [29]. Проведен анализ динамики по шкалам TSS, NSC (Neuropathy Symptoms and Changes, Шкала невропатических симптомов и изменений) и NIS LL. Общая сумма баллов по шкале TSS уменьшилась на 4,9 (51%) балла в первой группе, на 4,5 (48%) во второй и на 4,7 (52%) балла в третьей группе. В группе плацебо сумма баллов снизилась на 2,9 (32%) балла, что достоверно меньше (р < 0,05) по отношению ко всем группам лечения. Полученные данные свидетельствуют о том, что доза 600 мг таблетированной формы АЛК в день оптимальна.
Целесообразность длительного приема таблеток АЛК с целью лечения и замедления прогрессирования ДПН изучали в исследовании ALADIN II [30]. Больные СД 1-го и 2-го типов получали таблетки АЛК в дозе 1200, 600 мг или плацебо. В обеих группах, в которых пациенты получали АЛК, улучшались ЭМГ-показатели по двигательным и сенсорным нервам, но не в группе плацебо.
В РКИ Deutsche Kardiale Autonome Neuropathie (DEKAN) у больных СД 2-го типа с нарушением вариабельности сердечного ритма при лечении АЛК в таблетках (суммарная доза 800 мг) или плацебо в течение четырех месяцев выявлено достоверное увеличение вариабельности сердечного ритма в группе АЛК по сравнению с группой плацебо [31].
В открытом рандомизированном исследовании, проведенном в Мексике в 2015 г., прием таблеток АЛК 600 мг в течение четырех недель ассоциировался с достоверным снижением баллов по TSS (первая фаза исследования). Для проведения второй фазы все больные были разделены на две группы. В первую вошли пациенты со снижением баллов по TSS на три и более балла, во вторую – больные со снижением баллов по TSS менее трех. Больные первой группы продолжили прием АЛК в дозе 600 мг в таблетках, пациенты второй группы прекратили прием АЛК. Выяснилось, что продолжение приема АЛК сопровождалось еще более значительным снижением баллов по TSS, а отмена АЛК привела к ухудшению состояния пациентов и увеличению дозы используемых обезболивающих препаратов [32].
Метаанализ РКИ, в которых использовались таблетированные препараты АЛК, подтвердил эффективность таблеток АЛК при анализе показателей как по TSS, так и по NIS LL [33].
Возможность АЛК замедлять прогрессирование ДПН при длительном применении изучали в РКИ NATAN I у пациентов с СД 1-го и 2-го типов и ДПН. Использовался прием оптимальной дозы АЛК 600 мг или плацебо в течение четырех лет [34]. Показано достоверное различие между группой АЛК и группой плацебо в отношении неврологического дефицита.
Многочисленные РКИ и метаанализы продемонстрировали высокую эффективность внутривенного капельного введения и перорального приема АЛК у больных с ДПН. В обзоре Э. Болтона и соавт. 2013 г. отмечалось, что антиоксидантная терапия АЛК используется для лечения ДПН более 40 лет. Метаанализ с использованием данных о 1258 пациентах показал, что внутривенное введение АЛК в течение трех недель значительно уменьшает симптомы невропатии и неврологический дефицит. Это подтверждено в недавнем Кохрейновском обзоре, подтвердившем эффективность перорального лечения в течение пяти недель [34].
Результаты проведенных клинических исследований позволили сформировать алгоритм лечения больных СД с ДПН препаратами АЛК. Лечение начинают с внутривенного введения АЛК в разовой дозе 600 мг в течение 14–15 дней (если внутривенное введение препарата по какой-либо причине невозможно, лечение начинают сразу с таблеток АЛК). В стационаре или амбулаторно АЛК обычно вводится в вену пять дней подряд, затем следуют два дня перерыва (всего три недели). Применение более коротких курсов внутривенного введения АЛК (до десяти инфузий) не позволяет в подавляющем большинстве случаев добиваться быстрого достоверного улучшения состояния больных.
Обоснованно предложение о приеме по окончании курса инфузий в течение двух-трех месяцев таблеток АЛК в дозе 600 мг в день. Рекомендуется оптимальная доза АЛК (600 мг) в таблетках, поскольку результаты исследования SYDNEY II показали, что дозы 1200 и 1800 мг не имеют преимущества перед дозой 600 мг.
В 2010 г. были опубликованы результаты совещания ведущих мировых экспертов по ДПН. В эту группу входят наиболее известные ученые и врачи из разных стран, которые занимаются изучением ДПН. В публикации проанализированы и приведены экспертные заключения по всем проблемам ДПН. В отношении патогенетической терапии авторы статьи пришли к выводу, что АЛК – единственное патогенетическое средство лечения ДПН с эффективностью, доказанной в девяти РКИ с уровнем доказательности класса А [4].
Остается открытым вопрос о целесообразности назначения АЛК в виде инфузий или приема таблеток больными с недостаточной или плохой компенсацией СД. Сравнительных исследований эффективности АЛК в зависимости от степени компенсации СД немного, и выводы неоднозначны. Можно сказать, что исследования более ранних лет, когда использовались другие целевые значения гликемии, определяющие компенсацию СД, проводились при верхней границе HbA1с, позволявшей включать больных в исследование, до 10% (например, исследование SYDNEY I). При этом в исследованиях отмечалась высокая эффективность АЛК.
В 2013 г. сравнили эффективность применения АЛК в течение четырех месяцев у 20 больных СД 2-го типа с манифестной ДПН в двух группах [25]. В первой группе HbA1с был < 7%, во второй > 7%. Авторы пришли к заключению, что АЛК эффективна в обеих группах, однако эффективность статистически более выражена в группе хорошего контроля гликемии. Будущие более масштабные исследования позволят точнее ответить на этот вопрос. С нашей точки зрения, начинать лечение ДПН АЛК следует, не дожидаясь полной компенсации СД.
В 2018 г. были опубликованы результаты проведенного в больнице общего профиля Лайко в Афинах (Греция) исследования влияния АЛК на симптомы и качество жизни лиц с симптомной ДПН [35]. 72 участника исследования получали 600 мг АПК в таблетированной форме в течение 40 дней. По истечении этого срока отмечались статистически значимое снижение симптомов невропатии и общее улучшение качества жизни. Свыше 50% пациентов оценили состояние здоровья как «улучшившееся» или «заметно улучшившееся». Снижение неврологических симптомов наблюдалось при оценке по NSS (Neuropathy Symptom Score, Шкала балльной оценки симптомов невропатии), опросникам DN4 (Douleur Neuropathique 4 questions, Диагностический опросник невропатической боли) и SPNSQ (Subjective Peripheral Neuropathy Screen Questionnaire, Скрининговый опросник периферической невропатии). Авторы предположили, что результаты их исследования позволяют думать о рутинном назначении АЛК пациентам с СД и периферической невропатией.
Разработка патогенетической терапии ДНП остается в центре внимания ученых и клиницистов. За последние годы проведены многочисленные РКИ по оценке эффективности при лечении ДПН для таких лекарственных препаратов, как Актовегин, ацетил-L-карнитин, ингибиторы альдозоредуктазы (ранирестат, эпалрестат), Трайкор. Вместе с тем эффективность АЛК при ДНП остается наиболее доказанной, что делает препараты АЛК ключевыми при лечении ДПН в стационаре (инфузии) и амбулаторно (таблетки). Крайне важен вопрос о целесообразности назначения тиоктовой кислоты в зависимости от стадии и формы ДПН. Алгоритм, предложенный в 2021 г. D. Ziegler и соавт., предусматривает применение АЛК при бессимптомной, симптомной безболевой и болевой ДПН [34].
I.A. Strokov, M.I. Strokova
N.V. Sklifosovskiy Institute of Clinical Medicine
I.M. Sechenov First Moscow State Medical University
Contact person: Igor A. Strokov, strigoral@mail.ru
Alpha lipoic (thioctic) acid is a widely used pharmacological treatment for diabetic polyneuropathy. The article focuses on numerous randomized clinical trials and meta-analyses aimed at studying the effectiveness of the drug in patients with symptomatic diabetic polyneuropathy. The administration of alpha lipoic acid has an effect on pathogenetic mechanisms of diabetic polyneuropathy with clinically proved effectiveness. Treatment schemes of treating diabetic patients with polyneuropathy with infusions of alpha lipoic acid or with taking the substance in a tableted form.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.