Современные возможности диагностики и лечения диабетической полиневропатии
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются современные методы диагностики и оценки степени тяжести диабетических полиневропатий, определяющие алгоритм лечения таких больных.
В статье рассматриваются современные методы диагностики и оценки степени тяжести диабетических полиневропатий, определяющие алгоритм лечения таких больных.

Введение
Диабетическая полиневропатия (ДПН) – заболевание, характеризующееся нарушением функции сенсорных, моторных и вегетативных периферических нервов в дистальных отделах конечностей и висцеральных сплетениях у лиц, страдающих сахарным диабетом (СД), при исключении других причин полиневропатии.
Несмотря на то что дистальная симметричная сенсомоторная полиневропатия признана самым частым осложнением сахарного диабета (СД), ее симптомы проявляются менее чем у половины больных. ДПН развивается в среднем через пять лет от начала СД 1 типа. При диагностировании СД 2 типа патология встречается в 10–15% случаев. Через 20 лет после постановки диагноза СД 1 типа распространенность ДПН возрастает как минимум до 20%, через 10 лет после постановки диагноза СД 2 типа – до 50% [1]. Болевая диабетическая полиневропатия наблюдается не менее чем у 25% пациентов.
Болевые и безболевые полиневропатии могут развиваться уже на стадии метаболического синдрома (рисунок) [2]. Так, поражение периферической нервной системы выявляется у 11% лиц с нарушением толерантности к глюкозе [2]. У 25–62% пациентов с идиопатической полиневропатией отмечается нарушение толерантности к глюкозе [3]. Поражение вегетативной нервной системы диагностируют у 20% больных СД. При длительности заболевания более 15 лет количество случаев возрастает до 60%. Поражение вегетативных нервных волокон нередко обнаруживают уже при дисметаболическом синдроме: у 5,9% пациентов с нарушением толерантности к глюкозе, у 8,1% – с изолированным повышением гликемии натощак. 11,4% популяции с дисметаболическим синдромом имеют признаки автономной невропатии, в то время как в популяции 55–74 лет с нормальной толерантностью к глюкозе снижение вариабельности сердечного ритма встречается только в 4,5% случаев [2].
Необходимо отметить, что поражение вегетативной нервной системы при СД ассоциируется с многократным повышением риска сердечно-сосудистой смерти [1, 4].
Диабетическая полиневропатия включает в себя достаточно гетерогенные варианты, которые различаются клиническими проявлениями, течением и патогенезом [5].
Генерализованные диабетические полиневропатии можно классифицировать следующим образом:
А. Дистальные симметричные сенсомоторные диабетические полиневропатии:
- с преимущественным поражением тонких нервных волокон;
- преимущественным поражением толстых нервных волокон;
- поражением как тонких, так и толстых нервных волокон (смешанные полиневропатии);
Б. Автономные (вегетативные) невропатии:
- кардиоваскулярная; гастроинтестинальная;
- урогенитальная;
- нарушение потоотделения;
- зрачковые нарушения.
В зависимости от типа пораженных нервных волокон клинические симптомы могут существенно варьироваться. Так, у больных ДПН с преимущественным поражением толстых нервных волокон наблюдаются нарушение чувствительности в дистальных отделах конечностей, сенситивная атаксия, снижение или отсутствие ахилловых рефлексов. В тяжелых случаях может отмечаться слабость в мышцах-разгибателях стоп, однако мышечная слабость является нехарактерным симптомом ДПН.
Патологический процесс зависит от длины нервного волокна. Первые симптомы появляются в стопах, постепенно распространяются на голень и только потом на кисти рук. Поэтому до развития сенсорных изменений в руках (симптом перчаток) существует резерв – разница между длиной рук и ног.
Диагностика
Диагностика ДПН основана на анализе:
- субъективных проявлений (жалоб больных);
- клинических нарушений (симптомов);
- результатов инструментальных методов обследования.
Субъективными признаками ДПН чаще всего являются боль, онемение, парестезии, жжение, преимущественно в нижних отделах конечностей, однако они весьма вариабельны, непостоянны (зависят от психологического состояния) и у большинства больных отсутствуют. В то же время именно они становятся причиной обращения за специализированной медицинской помощью на ранних стадиях нейродегенеративного процесса, когда болезнь-модифицирующее лечение особенно эффективно. При безболевых формах ДПН риск развития осложнений выше из-за гиподиагностики.
У пациентов с СД для правильного назначения терапии следует дифференцировать характер болевого синдрома, определить преобладающие механизмы его возникновения. В настоящее время наибольшее распространение получила биопсихосоциальная модель, согласно которой существует биологический источник ноцицептивной импульсации, при этом нарушаются механизмы ноцицепции и антиноцицепции. Значительное влияние на хронизацию боли оказывают психическое состояние, социальное окружение и статус пациента. В силу поражения при ДПН в первую очередь тонких волокон доминирующим симптомом является боль невропатического характера. Высокая интенсивность и частота психотравм у пациентов, страдающих сахарным диабетом, обусловливает развитие психопластических процессов, запускающих механизмы центральной сенситизации, дезингибиции и трансформации невропатического болевого синдрома в ноципластический.
Для измерения интенсивности боли у взрослых наиболее удобным инструментом считается визуальная аналоговая шкала (ВАШ). Она представляет собой десятисантиметровую линию, на которой пациент ставит отметку, соответствующую интенсивности испытываемой в данный момент боли. Расстояние от начала шкалы «Нет боли» до отметки измеряют в сантиметрах и переводят в баллы. Один сантиметр ВАШ соответствует одному баллу.
При ДПН боль носит режущий, прокалывающий, а также распирающий или ноющий характер. Как правило, она усиливается в ночное время и может сопровождаться жжением и онемением в стопах, покалыванием в голенях и стопах, ощущением отсиженной ноги.
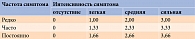
Для количественной характеристики симптомов ДПН и контроля их динамики на фоне лечения применяют разные шкалы, основанные на субъективных признаках и клинических проявлениях болезни. Наибольшее распространение в клинических исследованиях и повседневной практике получила шкала общей оценки симптомов (Total Symptom Score – TSS), предложенная D. Ziegler и соавт. (табл. 1) [6].
TSS позволяет оценить такие субъективные симптомы, как:
- стреляющая (по типу прострелов или прохождения электрического тока) боль;
- жжение (чувство жара, как будто печет или горит, желание остудить кожу);
- онемение (в том числе чувство одеревенения, отсиженности и т.п.);
- парестезии (покалывание, чувство ползания мурашек и других насекомых по коже или под кожей, пузырьков газировки и т.п.).
Анализируется не только интенсивность, но и частота возникновения этих признаков ДПН. Сочетание различной интенсивности и частоты выражается в числовом значении – от нуля до 3,66 балла. Баллы, полученные по каждому симптому в отдельности, суммируются. Таким образом, общая оценка по TSS может составлять от нуля до 14,64 балла. Необходимо отметить, что иногда пациенты неправильно трактуют свои ощущения, описывая жжение, онемение или парестезии как боль. Чтобы получить правильную оценку по TSS, важно разъяснить больному понятия «онемение» и «парестезии». Подсчет баллов по TSS проводится с учетом симптомов, которые наблюдаются у больного в течение последних 24 часов. Важными преимуществами данного диагностического инструмента являются возможность количественной оценки выраженности ДПН и простота использования, недостатком – субъективность. Поэтому для уточнения состояния периферической сенсомоторной и вегетативной нервной системы требуется объективизация – клинический осмотр.
Клинический осмотр при подозрении на ДПН включает:
- выявление расстройства чувствительности;
- изменения рефлексов и степени мышечной слабости;
- вегетативных нарушений.
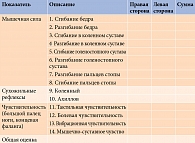
Для объективной оценки сенсомоторной дефицитарной симптоматики при ДПН используется счет невропатических нарушений в нижних конечностях (Neuropathy Impairment Score Lower Limb – NIS-LL) (табл. 2), прежнее название – Neuropathy Disabilithy Score (NDS). NIS-LL позволяет дать количественную характеристику симптомов при периферических невропатиях [7]: мышечной слабости, изменения рефлексов и нарушения чувствительности. Мышечная сила оценивается следующим образом: ноль баллов – норма, один – снижение на 25%, два – снижение на 50%, три – снижение на 75% (3,25 – движение с развитием усилия, 3,50 – движение без развития усилия, 3,75 – сокращение мышц без движения), четыре балла – паралич. Сохранность рефлексов определяют в диапазоне от нуля до двух баллов. Ноль означает норму, один – снижение рефлекса, два – его отсутствие. Для пациентов 50 лет и старше снижение ахиллова рефлекса оценивается как ноль, отсутствие – как один балл.
Определение порога тактильной, болевой и вибрационной чувствительности проводится в стандартных местах: дорсальная поверхность у основания ногтевого ложа терминальной фаланги указательного (рука) и большого (нога) пальцев, мышечно-суставного чувства – на терминальной фаланге указательного (рука) и большого (нога) пальцев. Чувствительность градуируется следующим образом: ноль баллов – норма, один – снижение, два балла – отсутствие.
Самым частым клиническим признаком ДПН признано нарушение чувствительности, которое может варьироваться от легкого онемения пальцев ног до глубокой анестезии с нейропатическими язвами и артропатией. Расстройства чувствительности, как правило, представлены в виде «перчаток» и «носков». При преимущественном нарушении функции толстых нервных волокон снижается вибрационная и проприоцептивная чувствительность. В случае поражения тонких нервных волокон отмечается нарушение болевой и температурной чувствительности, а также вегетативной функции. Тонкие нервные волокна, проводящие температурную чувствительность, поражаются раньше, чем толстые. Можно выявить изолированное нарушение температурной чувствительности (поражение тонких нервных волокон) без нарушения вибрационной, однако нарушение вибрационной чувствительности (поражение толстых нервных волокон) почти всегда сопровождается снижением порога температурной чувствительности.
Двигательные нарушения чаще представлены снижением или отсутствием рефлексов в ногах, в первую очередь ахилловых, что служит одним из основных показателей ДПН. Слабость в дистальных отделах ног (обычно в разгибателях стопы) и атрофия мышц стопы наблюдаются редко и свидетельствуют о тяжелой стадии ДПН. Для генерализованной ДПН нехарактерны выраженная мышечная слабость, генерализованная арефлексия, слабость дыхательной мускулатуры, поражение черепных нервов, выраженная асимметрия чувствительных и двигательных нарушений, острое начало и быстрое прогрессирование неврологических расстройств, преобладание неврологических симптомов в верхних конечностях, преобладание в клинической картине сенситивной атаксии при относительно сохранной функции проводников болевой и температурной чувствительности. Если подобные симптомы наблюдаются у пациентов с СД и исключены другие причины поражения периферических нервов, следует диагностировать атипичную форму ДПН или заболевание нервной системы другой этиологии.
Выраженная демиелинизация по данным электронейромиографии является поводом для проведения дополнительных исследований с целью выявить недиабетические полиневропатии. Правильная и своевременная постановка диагноза позволит провести эффективное патогенетическое лечение сопутствующих курабельных невропатий.
На протяжении нескольких десятилетий электронейромиография является основным инструментальным методом диагностики ДПН. Она признана объективным, чувствительным, воспроизводимым и стандартизированным методом. При ДПН необходимо исследовать двигательные и чувствительные нервные волокна на руках и ногах (например, икроножный, малоберцовый и большеберцовый нервы на ногах и срединный нерв на руках). При симметричной ДПН достаточно исследования нервов с одной стороны. Наиболее ранним электронейромиографическим признаком ДПН является аксональное поражение икроножного нерва с последующим снижением скорости проведения возбуждения. При электронейромиографическом исследовании тоннельных невропатий выявляются признаки локального поражения нервов в виде увеличения дистальной (резидуальной) латенции или локального снижения скорости проведения возбуждения. В ходе проведения ультразвукового исследования обнаруживают увеличение площади поперечного сечения и нарушение кабельного строения нерва как в местах, типичных для компрессии, так и в других местах, даже в отсутствие клинических симптомов. Полученные результаты подтверждают наличие у пациентов с СД морфологических изменений в периферических нервах, что делает их чувствительными к компрессии [8].
К недостаткам электронейромиографии можно отнести способность оценивать функцию только толстых, миелинизированных нервных волокон Аα и Аβ. Поэтому при преимущественном поражении тонких нервных волокон ее показатели будут в пределах нормы. В таких случаях следует использовать методики, разработанные специально для диагностики невропатий тонких нервных волокон: количественное сенсорное тестирование, биопсию кожи, конфокальную микроскопию роговицы.
Количественное сенсорное тестирование основано на определении пороговых величин тепловой (С-волокна) и холодовой (Аδ-волокна) чувствительности, а также тепловой и холодовой боли (C-волокна). Данный метод исследования является чувствительным и неинвазивным. Кроме того, он позволяет получить информацию о функции как тонких, так и толстых нервных волокон. В то же время количественное сенсорное тестирование является нестандартизированным методом, зависящим от внимания и настроя пациента, его готовности к сотрудничеству, антропометрических данных, и отличается вариабельностью результатов.
При биопсии кожи исследуется участок диаметром 3 мм на латеральной части голени ближе к дистальному отделу и проводится оценка плотности внутриэпидермальных нервных волокон. У пациентов с ДПН отмечается достоверное снижение плотности внутриэпидермальных нервных волокон. При этом на ранних стадиях болевой ДПН показатели ниже, чем при безболевой ДПН, что свидетельствует о большей вовлеченности в патологический процесс тонких нервных волокон. В диагностике невропатий тонких нервных волокон биопсия кожи имеет уровень доказательности А. Однако данный метод является инвазивным и в России используется преимущественно в научных работах, а не в рутинной практике.
Перспективным методом диагностики невропатии тонких нервных волокон представляется конфокальная микроскопия роговицы. Это быстрый и неинвазивный метод, характеризующийся высокой чувствительностью. С его помощью можно установить длину и плотность нервных волокон роговицы, которые у пациентов с ДПН достоверно ниже, чем в здоровой популяции. К сожалению, конфокальная микроскопия роговицы недостаточно внедрена в клиническую практику. Вместе с тем сопоставление данных конфокальной микроскопии роговицы, тестирования и электронейромиографии свидетельствует об определенном параллелизме результатов [8, 9].
В большинстве случаев поражение тонких нервных волокон сочетается с поражением вегетативных нервных волокон.
При автономной диабетической полиневропатии могут поражаться разные органы и системы, в частности сердечно-сосудистая, гастроинтестинальная, мочеполовая. Самым частым и серьезным проявлением автономной ДПН является кардиальная автономная невропатия. Признаками кардиальной автономной невропатии являются тахикардия покоя, фиксированный пульс, ортостатическая гипотензия, ангидроз, безболевая ишемия и инфаркт миокарда, аритмия, внезапная остановка сердца во время оперативного вмешательства, апноэ. Следует отметить, что кардиальная автономная невропатия длительное время может протекать бессимптомно, при этом увеличивается риск внезапной смерти, развития инфаркта и инсульта [4]. Поэтому так важно регулярно проводить скрининг частоты сердечных сокращений и артериального давления с помощью теста Эвинга, тем более что использование пульсоксиметрии значительно упрощает исследование дыхательной вариабельности сердечного ритма, проведение пробы Вальсальвы и ортостатической пробы «30:15» [10].
Важно подчеркнуть, что без применения стандартных общепризнанных тестов и шкал с оценкой адекватных характеристик ДПН и подсчетом ее выраженности точно определить тяжесть ДПН невозможно.
Существует несколько причин, по которым выявление и количественная оценка ДПН имеют большое значение в клинической практике. Во-первых, это позволяет как врачам, так и пациентам контролировать течение заболевания и своевременно принимать терапевтические меры. Во-вторых, эффективность лечения в первую очередь зависит от своевременного назначения препаратов. Наиболее эффективно лечение на начальных стадиях, поэтому раннее выявление заболевания и назначение терапии снижают затраты на лечение. Однако наличие у пациента тяжелой стадии ДПН не должно быть поводом для терапевтического нигилизма. Назначение патогенетической нейротропной терапии не только улучшает качество жизни таких больных, но и снижает риск смерти. В-третьих, объективная оценка тяжести ДПН позволяет подобрать адекватную симптоматическую и патогенетическую терапию. Не следует также забывать, что появление симптомов ДПН может свидетельствовать о декомпенсации сахарного диабета и служить основанием для изменения тактики сахароснижающей терапии: зуд может быть связан с гипергликемией, а крампи – с гипогликемией. В-четвертых, количественное тестирование симптомов ДПН с помощью разных шкал может быть применено для экспертной оценки степени ее тяжести, в том числе для оценки эффективности проводимой терапии.
Лечение
Существует весьма спорное мнение о так называемой точке невозврата при ДПН, которая в отсутствие контроля гликемии и адекватной патогенетической терапии представляет собой неуклонно прогрессирующее заболевание [11]. Ряд авторов полагают, что рано или поздно пациент проходит точку невозврата в развитии ДПН, за которой органические изменения настолько велики, что патогенетическое лечение (нейротропные препараты) не имеет смысла, и рассматривают его как нецелевое, например при тяжелом сенсорном дефиците или острой болевой невропатии Элленберга. Приверженцы теории точки невозврата считают нецелесообразной патогенетическую терапию в отделениях гнойной хирургии или дневных стационарах у пациентов с синдромом диабетической стопы, то есть с некурабельной, по их мнению, полиневропатией.
Данная точка зрения, на наш взгляд, является несостоятельной: даже при необратимом повреждении периферических нервов на одной стопе, например при гангрене, изменения периферических нервов в других конечностях, а также в автономной нервной системе остаются обратимыми. Поэтому данную концепцию следует рассматривать как противоречащую принципам гуманности. Это лишает больного надежды и служит поводом для отказа в специализированной медицинской помощи при тяжелых стадиях ДПН, когда патогенетическая терапия жизненно необходима. Терапевтический нигилизм можно рассматривать как проявление маладаптивной социопластичности, приводящей к дегуманизации общества и снижению доверия к официальной медицине. Помимо возражений гуманистического толка можно привести экономическое обоснование необходимости патогенетического лечения у пациентов с кардиальной автономной невропатией. Такая терапия предотвращает тяжелую инвалидизацию вследствие сердечно-сосудистых осложнений, а также уменьшает затраты на уход и реабилитацию больных после инфаркта и острого нарушения мозгового кровообращения. Поэтому нейротропное лечение ДПН, на наш взгляд, необходимо проводить на любой стадии процесса, особенно интенсивно и парентерально – при тяжелых формах ДПН и в отделениях гнойной хирургии.
Лечение ДПН помимо контроля гликемии предполагает коррекцию модифицируемых факторов риска (отказ от курения, снижение избыточной массы тела, борьба с гиподинамией (лечебная ходьба и кинезиотерапия)), применение нейротропных препаратов для стимуляции репаративных процессов в периферических нервах, а также симптоматическую терапию болевого синдрома и вегетативных нарушений [12].
Согласно результатам проспективных исследований, компенсация нарушений углеводного обмена у пациентов с СД имеет первоочередное значение. Это замедляет развитие всех осложнений диабета, включая невропатии, а также снижает резистентность к фармакотерапии, вызванную неферментативным гликированием белков-рецепторов с изменением их третичной пространственной конфигурации и способности связываться с активным центром действующего вещества препарата. В то же время установлено, что оптимизация контроля гликемии позволяет предотвратить или замедлить прогрессирование ДПН только при СД 1 типа, но не при СД 2 типа.
Гипергликемия запускает каскад метаболических и сосудистых нарушений, приводящих к ДПН. Окислительный стресс, усиленное образование конечных продуктов гликирования, активация перекисного окисления липидов, индуцибельной NO-синтазы приводят к избыточному образованию свободных радикалов – молекул, обладающих повышенной реагентной способностью. Свободные радикалы нарушают целостность клеточных структур, в первую очередь эндотелия, вызывая эндоневральную гипоксию и, как следствие, развитие невропатии. Активность антиоксидантной системы (в частности, супероксиддисмутазы, каталазы, глютатиона) у пациентов с ДПН снижена. Для преодоления окислительного стресса необходимо применение экзогенных антиоксидантов. Первое место среди антиоксидантов и препаратов, используемых для патогенетического лечения ДПН, занимает альфа-липоевая (тиоктовая) кислота, эффективность которой доказана в нескольких контролируемых клинических исследованиях (ALADIN, ALADIN III, SYDNEY 1, SYDNEY 2, NATHAN II), объединенных в одном метаанализе [6, 13, 14]. При назначении тиоктовой кислоты у пациентов с ДПН отмечено улучшение как позитивной невропатической симптоматики (боль, жжение, онемение и парестезии), оцениваемой по TSS, так и негативной (снижение чувствительности, рефлексов на ногах и силы мышц стоп). Кроме того, зафиксирована положительная динамика при проведении электронейромиографии. При средневыраженных и тяжелых формах ДПН в начале лечения оптимальным считается внутривенное капельное введение тиоктовой кислоты. Берлитион® (тиоктовая кислота) применяется в дозе 600 мг в виде концентрата для инфузионной терапии в течение 15 дней с последующим приемом 600 мг препарата в виде таблеток один раз в день (утром) за 30–40 минут до еды от двух до 12 месяцев в зависимости от тяжести ДПН. При легкой форме ДПН (TSS – от нуля до двух баллов, NIS-LL – ноль баллов) и легкой интенсивности болевого синдрома (ВАШ – не более 30 мм) возможно лечение таблетированными препаратами тиоктовой кислоты и нейротропными комплексами витаминов группы В без парентерального введения.
Витамины группы В применяют в качестве патогенетической терапии как диабетических, так и недиабетических невропатий. Использование нейротропных (способствующих регенерации нерва) комплексов витаминов группы В улучшает скорость проведения нервного импульса, ускоряет репаративные процессы в периферическом нерве, стимулирует нейропластичность и снижает выраженность болевого синдрома. Одновременное применение тиамина (В1), пиридоксина (В6) и цианокобаламина (В12) стимулирует аксоплазматическую часть транспорта структурных элементов мембраны или миелиновой оболочки, например холина. Тиамин способствует ремиелинизации через активацию фосфолипазы A. В результате усиливается гидролиз эфиров жирных кислот. Кроме того, посредством усиления энергообеспечения (аденозинтрифосфат) поддерживается аксоплазматический транспорт, что особенно важно для восстановления трофической функции нерва у пожилых пациентов. Пиридоксин участвует в синтезе транспортных белков и сфингозина – структурного элемента мембраны нервного волокна и нейромедиаторов антиноцицептивной системы (серотонина, норадреналина). Цианокобаламин обеспечивает доставку жирных кислот в клеточную мембрану и миелиновую оболочку. Применение витамина В12 способствует не только ремиелинизации (за счет активации трансметилирования, обеспечивающей синтез фосфатидилхолина – важного компонента мембраны нервных клеток), но и снижению интенсивности болевого синдрома (за счет собственного антиноцицептивного действия). Отмечается усиление активности антидепрессантов при длительной адъювантной терапии витаминами группы В [15].
Назначение нейротропных комплексов, содержащих цианокобаламин, наиболее оправданно у пациентов с дефицитом витамина В12, длительно принимавших метформин. Однако длительное (более десяти инъекций или двух месяцев перорально) введение цианокобаламина нецелесообразно в связи с его способностью депонироваться в тканях печени и селезенки. Поэтому для длительного перорального приема лучше назначать нейротропные комплексы, которые содержат бенфотиамин, продемонстрировавший высокую эффективность в лечении ДПН [16]. Бенфотиамин после всасывания превращается в биологически активный кофермент, который незаменим в углеводном обмене и обеспечивает энергоснабжение в нервных клетках. Известно, что при СД 1 и 2 типов уровень тиамина в плазме снижается. Производные тиамина активируют транскетолазу, блокирующую процессы неферментативного гликирования белков аксональных мембран с образованием конечных продуктов гликирования, приводящих к изменению третичной структуры белков-рецепторов и ионных каналов, тем самым нарушая их функцию в нервном волокне. Помимо этого бенфотиамин уменьшает индуцированную конечными продуктами гликирования сосудистую эндотелиальную дисфункцию, что также снижает токсические эффекты гипергликемии. Недостаточная эффективность применявшихся ранее традиционных препаратов тиамина можно объяснять тем, что тиамин – водорастворимое соединение, поэтому усваивается примерно 10% принятой дозы. Бенфотиамин – это жирорастворимый предшественник тиамина с более высокой биодоступностью в отличие от водорастворимых форм витамина B1, он в десять раз быстрее накапливается в тканях, практически 100% дозы переходит в активную форму. Это дает большое преимущество.
В двойном слепом рандомизированном плацебоконтролируемом исследовании BENDIP продемонстрирована зависимость эффективности бенфотиамина как от принимаемой дозы (не менее 300 мг/сут), так и от продолжительности приема (не менее шести недель) [16].
При выраженной болевой ДПН (TSS – от четырех до шести баллов, ВАШ – от 60 до 100 мм, NIS-LL – от одного до 12 баллов) и на поздних стадиях ДПН (TSS – от нуля до 3,66 балла, NIS-LL – более шести баллов вне зависимости от ВАШ) парентеральное введение препарата Берлитион® (№ 15 внутривенно капельно) назначается раз в полгода с последующим переходом на пероральный прием в дозе 600 мг утром за полчаса до еды не менее двух месяцев. В наиболее тяжелых случаях Берлитион® должен приниматься постоянно до достижения значимого регресса дефицитарных невропатических расстройств. При легкой форме ДПН (TSS – от нуля до двух баллов, NIS-LL – ноль баллов) и легкой интенсивности болевого синдрома (ВАШ – не более 30 мм) возможно использование препарата Берлитион® в форме таблеток в дозе 600 мг/сут в течение восьми недель, без парентерального введения.
Лечение невропатической боли при ДПН рекомендуют начинать при ее интенсивности более 40 мм по ВАШ. Таким образом, при легкой степени выраженности проявлений ДПН (TSS – от нуля до двух баллов, NIS-LL – ноль баллов) и легкой интенсивности болевого синдрома (ВАШ – не более 30 мм) можно использовать только нейротропную терапию препаратом Берлитион® без добавления болеутоляющих средств. Аналогичной тактике следует придерживаться и на поздних стадиях ДПН (TSS – от нуля до 3,66 балла, NIS-LL – более шести баллов) в отсутствие или при малой интенсивности болевого синдрома. В ряде случаев у пациентов с тяжелыми формами ДПН болевой синдром развивается или усиливается на фоне патогенетической терапии нейротропными препаратами. Это может объясняться стимуляцией нейропластических процессов, возвращающих утраченную чувствительность соматосенсорной нервной системы.
Рационально-разъяснительная психотерапия, формирующая положительное отношение больных к сенсорным феноменам, появляющимся на фоне нейротропной терапии препаратом Берлитион®, способна направить нейропластические процессы в центральной нервной системе в адаптивное русло, избежать катастрофизации и социальной дезадаптации, трансформации боли в ноципластическую. При развитии дезадаптирующего болевого синдрома на любом этапе терапии у данной категории больных возможно добавление в схему лечения антиконвульсантов (габапентиноидов) для быстрого купирования невропатического болевого синдрома.
Включение прегабалина в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету согласно приказу Минздрава России от 10.09.2015 № 634Н «О внесении некоторых изменений в некоторые приказы Министерства здравоохранения и социального развития РФ и Министерства здравоохранения РФ», привело к сложностям административного характера при их назначении. Габапентин не вызывает лекарственной зависимости и не входит в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету, поэтому в настоящий момент его назначение для лечения невропатической боли при ДПН является оптимальным. При выраженной болевой форме ДПН (TSS – от четырех до шести баллов, ВАШ – от 60 до 100 мм, NIS-LL – от одного до 12 баллов) начальная рекомендованная доза габапентина составляет 300 мг в первый день, 600 мг (в два приема) во второй и 900 мг (в три приема) в третий день. Дальнейшее увеличение суточной дозы осуществляется последовательным прибавлением 300 мг до достижения оптимальной дозы 1800 мг/сут. Для достижения максимального эффекта с 15-го дня применения суточную дозу можно увеличить до 2400 мг при нормальной переносимости, начиная с 21-го дня – до 3600 мг. В рандомизированных клинических исследованиях продемонстрировано, что комбинация габапентина с витаминами группы В позволяет использовать меньшие дозы габапентина [17].
В лечении хронической невропатической боли у пациентов с ДПН традиционно используют ингибиторы обратного захвата моноаминов, которые повышают концентрацию медиаторов в синапсах антиноцицептивной системы, активируют антиноцицептивную систему и подавляют проведение боли. Наименее селективные трициклические антидепрессанты – амитриптилин и имипрамин, обладающие максимальной анальгетической способностью при хронической боли, – имеют широкий спектр побочных эффектов, что не позволяет назначать их больным с автономной невропатией. Антидепрессанты двойного действия – селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН), в частности венлафаксин и дулоксетин, – показали высокую анальгетическую активность при нейропатических болях различной этиологии, сопоставимую с таковой трициклических антидепрессантов. При этом спектр побочных эффектов СИОЗСиН значительно меньше, чем у трициклических антидепрессантов, из-за отсутствия антихолинергического действия. Поэтому СИОЗСиН могут применяться при невропатической боли у пациентов с ортостатической гипотензией [5, 10, 12]. Данная группа препаратов обладает кумулятивным эффектом – обезболивающее действие развивается через две – четыре недели, требует длительного (в среднем три месяца) приема с постепенной отменой. Третьей линией терапии невропатической боли при ДПН считаются опиоиды, трамадол, трансдермальные системы с 5%-ным лидокаином, а также ботулотоксин А для внутрикожных инъекций.
Однако у ряда пациентов стандартное лечение антиконвульсантами, антидепрессантами и даже опиоидными анальгетиками не приводит к уменьшению невропатического болевого синдрома даже на 50%. Нередко боли из стоп, кистей распространяются в смежные анатомические области (голень, бедро, предплечье), а также в отдаленные анатомические структуры (лицо, шею, грудь, живот). Эти признаки центральной сенситизации дают основания предполагать, что нейропатическая боль трансформировалась в ноципластическую.
Согласно определению Международной ассоциации по изучению боли, ноципластическая боль – боль, возникающая в связи с измененной ноцицепцией в отсутствие четких признаков существующего или возможного повреждения ткани, вызывающего активацию периферических ноцицепторов, а также признаков заболевания или повреждения соматосенсорной нервной системы, способных вызвать эту боль [18]. Под измененной ноцицепцией подразумеваются неадаптивные (или маладаптивные) пластические процессы в психике (эндогенные процессы можно определить как психопластичность, экзогенные – социопластичность), а также в нервной (нейропластичность), мышечной (миопластичность), хрящевой (хондропластичность), костной (остеопластичность) и других системах. Вклад каждого из вышеперечисленных компонентов в формирование ноципластической боли различается у разных пациентов, что обусловливает ответ на проводимую терапию.
При включении психопластических механизмов ноципластической боли подсознание пациента, не желая встречи сознательного с негативной эмоцией, имеющей начало в психотравме в прошлом, вызывает восприятие боли на телесном уровне, а сознательное, сталкиваясь только с негативным аффектом без знания о предшествующей психотравме, через свойственную сознательному рационализацию, формирует страх боли от любого движения – кинезиофобию (боязнь расширения и поддержания привычного объема двигательной активности). Этому способствуют такие преморбидные особенности, как тревожность, нерешительность, алекситимия и другие нарушения социальной коммуникации, которые иногда могут закладываться в моменты психотравм в детстве и даже во внутриутробном периоде. Одним из наиболее ярких проявлений нарушений социальной коммуникации при болевых синдромах можно считать катастрофизацию боли – психопатологический процесс, который характеризуется дезадаптивной, негативной оценкой определенных симптомов и повышенным вниманием к ним. Иногда такая оценка следует из диссоциированных в подсознании психотравм, внутри которых имеются триггеры, активирующие эти психотравмы, вытесняя их в сознание пациента и вызывая поведение, мысли, психические или вегетативные реакции, которые могут быть классифицированы как психосоматические болезни. В катастрофизации выделяют три компонента:
постоянное размышление (rumination) – пациент постоянно думает о каком-то симптоме. Такие мысли – следствие активированной через триггеры психотравмы, они приводят к принудительному мышлению, например в виде часто повторяющихся негативных мыслей, зацикленности на них;
безнадежность (helplessness) – пациент считает, что его состояние ужасно и сложившаяся ситуация непреодолима. Безнадежность может быть следствием множественных психотравм, в которых человек многократно убеждался в своей беспомощности. В ее основе всегда будет конкретная ситуация – ядро чувствительности, в которой заложен сильный страх. Он будет потенцироваться терапевтическим нигилизмом врача, придерживающегося мнения о наличии точки невозврата;
преувеличение (magnification) – пациент ожидает чего-то плохого, преувеличивая тяжесть заболевания. Переживаемые в данный момент времени негативные аффекты с помощью триггеров могут активировать сходные предшествующие диссоциированные в подсознании аффекты (неразрешенные конфликты, ситуации из прошлого), тем самым вызывая симптомы, мысли и образы, заложенные в нейрональных сетях в момент психотравм.
Триггер работает, когда любой якорь VAKOG (каналы восприятия: V – visual, А – audial, K – kinesthetic, О – olfactory, G – gustatory), запрограммированный в момент психотравмы, активирует ее со всеми негативными аффектами, поведением, мыслями. Однако триггером может быть и сама боль. Так, боль активирует другой инцидент из прошлого, в котором также была пережита негативная эмоция (например, при аналогичной симптоматике при проведении магнитно-резонансной томографии обнаружена грыжа межпозвоночного диска и дана категоричная рекомендация о проведении оперативного лечения с угрожающими установками: «Откажут ноги, ходить будешь только под себя, вечный памперс»). В результате через сложение отрицательно окрашенных эмоций боли и страха болевые ощущения кажутся чрезмерными. При этом дезактуализация предшествующей психотравмы, например разъяснение о доброкачественной природе изменений в позвоночнике, приведет к уменьшению боли.
Именно триггеры обеспечивают так называемый психосоматический компонент, который есть у любого заболевания. Если нет психотравмы, то нет и триггеров, ведущих к ее развитию. Если нет триггеров, скорее всего, нет психотравмы или она является латентной. Возрастная регрессия возможна по любым триггерам, включая негативный аффект и боль. Посредством гипноанализа возможно выявление этих триггеров – первичных психотравмирующих событий, приведших к формированию патологических ноциогенных нейрональных сетей, активируемых отрицательными эмоциональными переживаниями больного. Для этого в гипнотическом состоянии необходимо дать инструкцию пациенту согласно одной из техник возрастной регрессии школы гипноза OMNI [11]. Например, предложить сконцентрироваться на ощущениях от негативного аффекта, следовать по негативному аффекту к самой ранней ситуации, когда пациент почувствовал эту эмоцию впервые, далее расспросить о ситуации, в которой пациент находится в регрессии, подробнее, а после ревивификации психотравмирующей ситуации разрешить ее (перепрожить с использованием накопленного жизненного опыта), решив внутренние и внешние конфликты. Для этого можно использовать разные психотерапевтические техники, в частности гештальт-терапию или технику OMNI [19].
По мнению целого ряда авторов, в том числе M.J.L. Sullivan (1990), катастрофизация является самостоятельным, отдельным в первую очередь от депрессии феноменом. Установлено, что уровень катастрофизации является предиктором боли и не всегда связан с выраженностью аффективных расстройств. Считается, что катастрофизация – связующее звено между депрессией и болью. Она опосредует влияние боли на аффективную сферу и наоборот. Наличие вышеописанного психопластического компонента, связанного с формированием патологических (маладаптивных) ноциогенных нейрональных сетей, активируемых отрицательными эмоциональными переживаниями больного, нивелирует эффективность проводимой обезболивающей фармакотерапии.
Лечение ноципластической боли при ДПН, направленное на маладаптивный нейропластический компонент, помимо антиконвульсантов (каналомодуляторов), антидепрессантов (стимуляторов активности антиноцицептивной системы) должно включать кратковременные психологические интервенции (рационально-разъяснительная психотерапия, когнитивно-поведенческая терапия, биологическая обратная связь и т.д.). Наиболее сложные случаи могут быть решены с использованием гипноаналитических техник OMNI [19], которые включают в себя ревивификацию и перепроживание диссоциированных в подсознании пациента психотравм.
Заключение
Диабетическая полиневропатия представляет собой сложную, но решаемую медико-социальную проблему. Для сохранения нормального качества жизни больных СД требуется регулярное (раз в год) неврологическое обследование и исследование вариабельности сердечного ритма, а при выявлении поражения нервной системы – как можно более раннее назначение патогенетической терапии препаратами альфа-липоевой кислоты (например, препаратом Берлитион®). Тяжелые стадии ДПН не являются поводом для отказа больному в проведении патогенетической нейротропной терапии, так как точки невозврата при ДПН не существует и следует бороться за выживание пациента. Основой успешной персонифицированной терапии боли при ДПН является адекватная диагностика как нейропластических, так и психопластических изменений с установлением преобладающих механизмов ее хронизации.
A.N. Barinov, PhD, A.V. Yefremov
I.M. Sechenov First Moscow State Medical University
International Social and Humanitarian Institute
Contact person: Аlexey N. Barinov, mmom-mc@mail.ru
Polyneuropathy in patients with diabetes mellitus is characterized by damage of the peripheral sensorimotor and autonomic nervous system, which can be accompanied by severe pain syndrome. Chronic pain syndrome in the feet in the situation of diabetes is mixed. In its development there are involved maladaptive, neuroplastic, chondroplastic and psychoplastic mechanisms leading to the formation of nociplastic pain. The understanding of the prevailing mechanisms of pain chronization in each case allows to implement complex personalized approach to treatment and to choose the most safe and cost-effective methods of prevention and rehabilitation.
The article deals with modern methods of diagnosis and assessment of the diabetic polyneuropathy severity, which determine the algorithm of such patients treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


