Боцепревир в тройной терапии: от науки к практике. 5-я Международная конференция «Белые ночи гепатологии – 2013»
- Аннотация
- Статья
- Ссылки







Промежуточные результатыэффективности и безопасности боцепревира в России
Сателлитный симпозиум начался с выступления Василия Андреевича ИСАКОВА, д.м.н., профессора, руководителя отделения гастроэнтерологии и гепатологии НИИ питания РАМН. Он рассказал о промежуточных результатах исследования эффективности и безопасности тройной терапии гепатита С. Помимо интерферона-альфа и рибавирина, уже давно признанных «золотым стандартом» в лечении хронического гепатита С (ХГС), в рамках тройной терапии пациенты принимали ингибитор вирусной протеазы – боцепревир.
В рандомизированном плацебоконтролируемом многоцентровом двойном слепом исследовании пациенты получали боцепревир в комбинации с ПегИнтроном и рибавирином. В исследовании участвовали 237 больных ХГС, инфицированных 1 генотипом вируса. Среди пациентов были те, кто ранее не лечился от ХГС, а также те, кто имел неудачный опыт терапии.
Все пациенты были рандомизированы в пропорции 2:1 и распределены в экспериментальную и контрольную группы. Стратификация участников исследования проводилась по двум показателям – генотипу IL28B (СС-аллель и не СС-аллель соответственно) и наличию предыдущей терапии.
Первичная конечная точка эффективности была определена как достижение устойчивого вирусологического ответа (УВО) через 24 недели после окончания терапии.
Промежуточный анализ данных был проведен, когда все пациенты завершили по крайней мере 8-недельную терапию или прекратили лечение в этот период. 8-недельный период был выбран не случайно: именно УВО после 8 недель терапии служит хорошим предиктором УВО после 24 недель терапии.
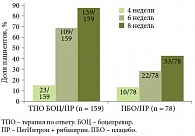
Все пациенты стали получать ПегИнтрон в дозе 1,5 мкг/кг 1 р/нед и рибавирин в дозе 800–1400 мг/сут за 4 недели до начала курса боцепревира или плацебо. Продолжительность лечения в экспериментальной группе определялась дизайном исследования и зависела от двух факторов – наличия у пациентов неудачного опыта предыдущей терапии и достижения УВО после 8 недель лечения (рис. 1).
Если вирусная нагрузка определялась после 12 недель (у пациентов, ранее получавших терапию) или 24 недель (у пациентов, в отношении которых терапия не проводилась), лечение прекращалось. Такое правило действовало в экспериментальной группе. Сказанное распространялось и на контрольную группу, но пациенты, не достигшие УВО на 12-й или 24-й неделе, переходили в так называемую перекрестную группу и получали тройную терапию согласно дизайну исследования (рис. 2).
В ходе исследования был проведен однократный промежуточный анализ данных, когда все пациенты либо завершили первые 8 недель лечения, либо перестали участвовать в исследовании. Для промежуточного анализа были выбраны следующие точки:
- доля пациентов с неопределяемой РНК HCV через 8 недель лечения;
- доля пациентов с неопределяемой РНК HCV через 4 и
6 недель лечения; - снижение log10 вирусной нагрузки через 4, 6 и 8 недель лечения;
- безопасность терапии.
Демографические параметры и характеристики заболевания пациентов, включенных в российское исследование, существенно отличались от аналогичных показателей зарубежных регистрационных исследований боцепревира SPRINT-2 и RESPOND-2. Например, среди российских пациентов доля инфицирования вирусом генотипа 1b составила 98,3%, а среди зарубежных – только 34,9%. Разумеется, различия между российской и зарубежной выборками внесли свой вклад в результаты работы российских исследователей (табл. 1).
Интерес вызывает различие частоты раннего вирусологического ответа в экспериментальной и контрольной группах. На рис. 3 видно, что после 4 недель терапии различие недостоверно, но по мере продолжения лечения тройная терапия становилась значительно эффективнее.
Тем не менее, как показал последующий анализ данных, частота вирусологического ответа зависела не только от того, какие препараты назначались, но и от генотипа IL28B, а также от опыта предыдущего лечения. Так, пациенты с СС-аллелью, не получавшие ранее терапии, отвечали на лечение в 100% случаев в обеих группах, а пациенты с отличным от СС генотипом IL28B достигали вирусологического ответа на 8-й неделе в 85,4% случаев в экспериментальной группе и только в 32,8% случаев – в контрольной. Важно и то, что у пациентов с отличным от СС генотипом, не получавших ранее терапии, ответ на применение боцепревира в сочетании с ПегИнтроном и рибавирином наблюдался в 88,3% случаев, а у больных, уже имевших неудачный опыт терапии, – в 81,7% случаев (в группе плацебо данные показатели составили 32,4 и 33,3% соответственно).
Кроме того, для промежуточного анализа были отобраны данные по частоте развития некоторых нежелательных явлений (НЯ). Российские показатели значительно отличались от зарубежных как в положительную, так и в отрицательную сторону. Частота развития лейкопении у российских пациентов из экспериментальной группы составила 31,4%. Аналогичный показатель в комбинированных результатах SPRINT-2 и RESPOND-2 составил всего 8,7%. Диарея, напротив, у российских больных развивалась значительно реже, чем у зарубежных, и была зарегистрирована в 9,4 и 24,5% случаев соответственно. Российским пациентам сравнительно редко назначался Эритропоэтин: в экспериментальной группе на момент проведения промежуточного анализа – в 8,2% случаев, в контрольной – в 6,4% (в исследовании SPRINT-2 этот показатель составил 43 и 24% соответственно).
Как показали результаты промежуточного анализа, НЯ, связанные с терапией, наблюдались часто как у пациентов, получавших тройную терапию (95,6% случаев), так и у больных, принимавших ПегИнтрон, рибавирин и плацебо (84,6%). Частота НЯ, приведшая к отмене терапии, составила 3,1% в экспериментальной и 1,3% в контрольной группе, а частота НЯ, приведшая к модификации терапии, – 45,9 и 16,7% случаев соответственно. Впрочем, отмена терапии не всегда была связана с препаратом, поскольку причиной прекращения лечения могла стать транзиторная ишемическая атака или протрузия межпозвоночного диска. Летальных случаев в ходе исследования зарегистрировано не было.
В целом результаты промежуточного анализа российского исследования эффективности и безопасности боцепревира показали, что частота ответа в группе, принимавшей боцепревир, после 8 недель терапии была достоверно выше, чем в группе плацебо (87,4% против 42,3%, p < 0,001). Выявленные различия между данными российского исследования и данными исследований III фазы объясняются разницей в демографических параметрах и характеристиках заболевания. Однако разница в эффективности между группами терапии во всех исследованиях одинакова. Что касается профиля безопасности пациентов в российском исследовании, он схож с таковым в предыдущих зарубежных исследованиях.
Практический контроль побочных явлений при использовании тройной терапии с боцепревиром
Как отметил профессор Майкл МАННС (департамент гастроэнтерологии, гепатологии и эндокринологии, Медицинская школа Ганновера, Германия), создание новых препаратов для лечения хронического гепатита С, ингибиторов вирусной протеазы, открыло новую эру в лечении заболевания. Включение препаратов прямого действия в стандартные схемы лечения позволило увеличить частоту УВО и снизить число резистентных мутаций вируса. В то же время использование новых схем лечения нередко сопровождается ростом НЯ, что негативно сказывается на приверженности больных терапии. Доказано, что пациенты, получавшие 80% и более рекомендованного количества боцепревира, достигали УВО в 69,8% случаев. Если порог 80% перешагнуть не удавалось, УВО регистрировался лишь в 49,6% случаев [1]. Нетрудно предположить, что последствия НЯ и снижения комплаентности в конечном итоге влияют на жизненный прогноз больных, что ставит задачу коррекции НЯ в разряд первостепенных.
НЯ, развивающиеся на фоне применения тройной терапии ХГС, можно разделить на две группы:
- хорошо знакомые инфекционистам побочные эффекты от использования интерферона и рибавирина;
- специфические НЯ, вызванные приемом ингибиторов вирусной протеазы.
К первой группе можно отнести гриппоподобные симптомы, депрессию и подавление функции костного мозга. Что касается второй группы, это, как правило, такие явления, как тошнота, диарея, нейтропения, анемия и увеличение риска развития инфекционных заболеваний. Существуют и специфические НЯ, относящиеся к конкретному препарату. Так, на фоне применения телапревира нередко появляются сыпь и аноректальный дискомфорт, а использование боцепревира приводит к извращению вкуса.
Одно из самых серьезных НЯ, связанных с приемом ингибиторов вирусной протеазы, – анемия. В исследованиях III фазы она развивалась у 49% пациентов, получавших тройную терапию, что в 1,7 раза больше, чем у пациентов, принимавших только интерферон и рибавирин. У 3% пациентов наблюдалась анемия 3-й стадии, 1% больных прекратили лечение ингибиторами протеазы в связи с анемией, 2% понадобилось переливание крови.
Как показали результаты исследований, в реальной клинической практике анемия развивалась достаточно часто: у 22,6% больных, получавших тройную терапию с боцепревиром, наблюдалась анемия 2-й степени, а у 10,1% – 3–4-й степени. Потребность в Эритропоэтине возникала у 66% больных, гемотрансфузии проводились 10,7% пациентов [2].
Основные подходы к коррекции анемии сводятся либо к элиминации триггерных факторов (в частности, к уменьшению дозы препарата, вызывающего анемию), либо к возмещению гемоглобина с помощью Эритропоэтина и гемотрансфузий. Однако эффективность применения гемотрансфузий ограничена рядом факторов. Во-первых, переливание крови сопряжено с рисками передачи трансмиссионных заболеваний. Во-вторых, в определенных ситуациях пациентов приходится госпитализировать. И наконец, в-третьих, не следует забывать, что переливание крови дает лишь временный эффект. Прибегать к данной процедуре целесообразно только в случае выраженной анемии (уровень гемоглобина < 8,5 г/дл) или тяжелой симптоматики.
Использование Эритропоэтина также сопряжено с рядом сложностей. Сообщения о тяжелых НЯ при терапии ХГС отсутствуют. Однако известно, что Эритропоэтин способен вызывать артериальную гипертензию, тромбоэмболию, выработку антител к эндогенному Эритропоэтину и снижать процент выживаемости онкологических больных. Кроме того, Эритропоэтин – весьма дорогостоящий препарат.
Снизить дозу ингибиторов вирусной протеазы невозможно, но можно уменьшить дозу рибавирина. Сопряжено ли последнее с сокращением частоты достижения УВО? Ответ на этот вопрос удалось получить благодаря международному открытому исследованию сравнения снижения дозы рибавирина с применением Эритропоэтина [3]. Как показали результаты исследования, обе стратегии борьбы с анемией сопоставимо эффективны в плане достижения УВО. На фоне применения Эритропоэтина процент УВО был несколько выше, но его использование сопровождалось НЯ и дополнительным повышением стоимости лечения. Пациенты, страдавшие от анемии во время терапии, достигали УВО достоверно реже. Именно поэтому борьба с анемией, развивающейся на фоне лечения ХГС, – чрезвычайно важная задача.
Не следует забывать, что интерферон, третий препарат, входящий в «золотой стандарт» лечения ХГС, также способен спровоцировать развитие анемии. Однако оптимальная доза интерферона для тройной терапии пока не определена. В то же время имеются данные, согласно которым сокращение дозы интерферона незначительно уменьшает частоту УВО, но достоверно снижает риск развития анемии4, что подтверждает целесообразность его применения в сложных случаях (рис. 4).
В общем виде стратегия управления анемией выглядит так: при уровне гемоглобина < 10 г/дл или его быстром снижении в начале лечения необходимо задуматься о сокращении дозы рибавирина. В более сложных ситуациях можно уменьшить дозу интерферона или назначить Эритропоэтин. Отмена рибавирина (или ингибитора вирусной протеазы) и переливание крови назначаются только тем больным, у которых уровень гемоглобина < 8,5 г/дл.
Нейтропения развивается на фоне лечения ХГС. Так, в исследовании CUPIC нейтропения 3-й степени (500–1000 нейтрофилов на 1 мкл крови) наблюдалась у 4,4% пациентов, получавших боцепревир, а нейтропения 4-й степени (< 500 нейтрофилов на 1 мкл крови) – у 0,6%. Инфекции отмечались у 2,5% пациентов, причем связи между нейтропенией и развитием инфекций установлено не было.
Если количество нейтрофилов меньше 750 на 1 мкл крови, необходимо снизить дозу интерферонов. Когда этот показатель снижается до 500, интерфероны отменяют. В определенных ситуациях пациентам назначают курс G-CSF (гранулоцитарный колониестимулирующий фактор).
37% пациентов, получавших боцепревир, жаловались на извращение вкуса. Специфического решения данной проблемы пока не существует, но известно, что подобные НЯ полностью обратимы: наиболее длительный период извращения вкуса составил всего 44 недели.
Еще одна проблема, возникающая при использовании новых противовирусных препаратов, заключается в том, что оба ингибитора протеазы метаболизируются через систему цитохрома Р450 3А [4], что иногда приводит к нежелательным лекарственным взаимодействиям [5] с антиретровирусными и иммуносупрессивными препаратами, а также с некоторыми растениями, широко используемыми в народной медицине.
Завершая выступление, профессор М. Маннc еще раз подчеркнул, что приверженность пациентов терапии – важный прогностический фактор достижения УВО. Но достичь хорошего комплаенса можно только при тщательном наблюдении и грамотной коррекции возникающих НЯ. Особое внимание необходимо уделять тем пациентам, которые начинают терапию, поскольку анемия возникает в первые 4 недели приема препаратов.
Применение боцепревира: от исследований к реальной клинической практике
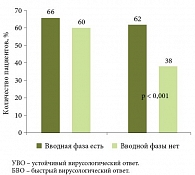
По словам Константина Валерьевича ЖДАНОВА, д.м.н., профессора, заведующего кафедрой инфекционных болезней Военно-медицинской академии им. С.М. Кирова, эффективность и безопасность боцепревира оценивалась во многих клинических исследованиях, в частности в исследованиях III фазы (SPRINT-2, RESPOND-2, PEG2a, PROVIDE, Anemia Management Study). В ходе этих исследований был собран огромный объем информации по таким важным вопросам, как вероятность достижения УВО в зависимости от генотипа IL28B и стадии фиброза, а также эффективность терапии в зависимости от наличия вводной фазы лечения – периода, когда пациент получает комбинированную терапию пегилированным интерфероном и рибавирином. Было установлено, что вводная фаза повышает вероятность достижения быстрого вирусологического ответа (БВО), который в свою очередь является достоверным предиктором УВО (рис. 5).
Более того, предиктором УВО может служить выраженность ответа на лечение в конце вводной фазы: пациенты, у которых снижение уровня вирусной РНК превышало log10, достигали УВО значительно чаще. Важно, что это утверждение справедливо для пациентов с различными генотипами IL28В [6].
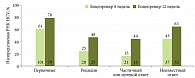
Эффективность нового подхода к лечению ХГС у тяжелых больных была наглядно продемонстрирована в исследовании RESPOND-2: УВО достигли 87% пациентов с циррозом печени из тех, кто показал выраженный ответ (снижение уровня вирусной РНК > log10) на терапию в конце вводной фазы терапии. И напротив: снижение РНК < 3 log на 8-й неделе двойной терапии можно рассматривать как неблагоприятный прогностический признак. В исследованиях RESPOND-2 и SPRINT-2 пациентов, достигших УВО после добавления боцепревира, не было.
В исследованиях, посвященных изучению эффективности и безопасности боцепревира, особое внимание уделялось наиболее сложной группе больных – пациентам, инфицированным вирусом 1 генотипа, у которых уже развился цирроз печени. Даже у таких больных с фиброзом F4 по шкале METAVIR УВО на фоне приема боцепревира был зарегистрирован в 55% случаев (в группе, получавшей только интерферон и рибавирин, УВО наблюдался лишь в 17% случаев). Пациентам с циррозом печени и степенью фиброза 0–2 УВО благодаря применению боцепревира удавалось достичь в 66% случаев (в группе плацебо этот показатель составлял 28%).
В ходе исследований изучалась не только эффективность, но и безопасность боцепревира. В частности, анализировалась частота развития НЯ. Даже у больных с циррозом печени серьезные НЯ встречались относительно редко – в 12–18% случаев. Наблюдались изменение дозы вследствие НЯ или анемии, инфекции, снижение уровня гемоглобина < 10 г/дл, наличие 2–3-й степени тромбоцитопении, 3–4-й степени нейтропени [7] (табл. 2).
Хотя регистрационные исследования эффективности и безопасности боцепревира позволили собрать большой объем информации, особый интерес для врачей представляют данные, касающиеся применения препарата на практике. Эти данные уже доступны. Например, был проведен промежуточный анализ результатов длительного наблюдательного исследования последовательно включавшихся в него пациентов в академических и общественных медицинских центрах Северной Америки [8]. Работа еще не завершена, но промежуточные показатели свидетельствуют о том, что эффективность боцепревира в реальной жизни сравнима с результатами регистрационного исследования только у первичных пациентов (рис. 6). Что касается безопасности препарата, она оценивается достаточно высоко: серьезные НЯ были зарегистрированы лишь у 8% пациентов.
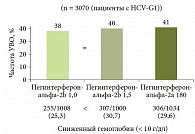
Значимые результаты были получены и в ходе французского исследования CUPIC, в котором изучались эффективность и безопасность тройной терапии с использованием телапревира или боцепревира у 485 пациентов с циррозом печени и неудачной предыдущей двойной терапией. В исследование были включены сложные пациенты. Средний возраст участников исследования составил 57 лет, около 90% пациентов были инфицированы вирусом 1 генотипа, более чем у 60% больных уровень РНК-вируса в крови превышал 800 000 МЕ/мл.
В среднем УВО12 удалось достичь 41% пациентов, получавших боцепревир. В группе пациентов с рецидивом в анамнезе этот показатель составил 51%, среди тех, кто продемонстрировал частичный ответ на терапию, – 40%, а в группе с нулевым ответом в анамнезе – 11%. Эти показатели несколько ниже тех, которые были достигнуты в ходе клинических исследований.
Кроме того, была проанализирована вероятность достижения УВО12 в зависимости от таких факторов, как генотип вируса, исходный уровень виремии, снижение уровня вирусной РНК после 4 недель терапии и БВО на 4-й неделе.
Полученные данные позволяют говорить о персонализации терапии, в частности об изменении продолжительности и структуры курса лечения в зависимости от индивидуальных характеристик пациента – ответа на лечение после 4-й и 8-й недели терапии. Инструкцией к применению препарата определены еще 2 контрольные точки – после 12-й и 24-й недели лечения. Сохранение высокого уровня вирусной РНК после 12 недель лечения и положительный результат качественного теста после 24 недель служат основанием для прекращения курса лечения в связи с неэффективностью.
Пока не разработаны однозначные алгоритмы ведения пациентов с циррозом печени, инфицированных 1 генотипом вируса, при снижении уровня вирусной РНК < 1 log после 4 недель вводной фазы в сочетании с определяемой (но менее 100 МЕ/мл) РНК на 8-й неделе после добавления боцепревира. В целом ожидаемый эффект от тройной терапии с боцепревиром должен быть соотнесен с риском тяжелых НЯ у пациентов с циррозом печени, особенно при нулевом ответе на предыдущую терапию и снижении уровня вирусной РНК < 1 log после вводной фазы [9].
Заключение
Использование боцепревира позволило существенно увеличить процент пациентов с ХГС, достигших УВО. В регистрационных исследованиях препарат многократно демонстрировал эффективность даже у трудных пациентов
(с циррозом печени и 3–4-й степенью фиброза, инфицированных вирусом 1 генотипа, с аллелью IL28B, отличной от СС, и т.д.).
Для успешного использования боцепревира в реальной клинической практике необходимо соблюдать ряд условий, в частности своевременно корректировать НЯ, развивающиеся на фоне тройной терапии, и постоянно анализировать прогностические факторы, указывающие на оптимальную длительность терапии и целесообразность ее продолжения.
Выполнение всех перечисленных условий позволяет добиваться УВО даже у пациентов, ранее не ответивших на терапию интерфероном и рибавирином или ответивших на нее частично.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.