Реактивация хронического гепатита В у пациентки с ревматоидным артритом
- Аннотация
- Статья
- Ссылки
- English
В статье представлен случай реактивации HBV-инфекции у пациентки, получавшей упадацитиниб и энтекавир в профилактических целях. Кроме того, суммированы последние данные о механизмах реактивации HBV и сравнительной частоте этого явления при применении разных антиревматических препаратов.
В статье представлен случай реактивации HBV-инфекции у пациентки, получавшей упадацитиниб и энтекавир в профилактических целях. Кроме того, суммированы последние данные о механизмах реактивации HBV и сравнительной частоте этого явления при применении разных антиревматических препаратов.

Введение
В связи с широким применением мощных иммуносупрессивных препаратов проблема реактивации вируса гепатита В (HBV-р) у больных иммуновоспалительными ревматическими заболеваниями (ИВРЗ) представляется весьма актуальной.
HBV-р диагностируют при повышении репликации HBV не менее чем на 1 десятичный логарифм копий в миллилитре или повторном выявлении ДНК HBV у лиц без виремии до начала приема иммунодепрессантов или генно-инженерных биологических препаратов (ГИБП) [1]. В настоящее время принята следующая градация вирусной нагрузки (ВН):
- не обнаружено – ДНК HBV не обнаружена или ее значение ниже предела чувствительности метода, то есть менее 200 копий/мл (90 МЕ/мл);
- низкая – < 7,5 × 102 копий/мл (< 3,6 × 102 МЕ/мл);
- умеренная – < 105 копий/мл (2 × 104 МЕ/мл), в этом случае решение о терапии зависит от биохимических показателей функции печени, результатов биопсии печени;
- высокая – > 105 копий/мл (2 × 104 МЕ/мл), что свидетельствует об активном инфекционном процессе и необходимости проведения противовирусной терапии;
- ДНК вируса выше линейного диапазона концентраций – > 1,0 × 108 копий/мл (> 4,8 × 107 МЕ/мл).
Клинический случай
Пациентка 1985 г.р. наблюдается в ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой» (НИИР им. В.А. Насоновой).
Диагноз: серонегативный ревматоидный артрит (РА) с ювенильным началом, ревматоидный фактор и антитела к цитруллинированному цитоплазматическому пептиду отрицательные, поздняя клиническая стадия, вторая рентгенологическая стадия (эрозивный), активность умеренная (DAS 28 – 4,83 балла), второй функциональный класс, увеит слева, осложненный катарактой, глаукомой, афакией, остеонекроз эпифизов бедренных и большеберцовых костей.
Пациентка больна с шести лет. Дебют с артрита коленных суставов. Установлен диагноз РА. Получала терапию нестероидными противовоспалительными препаратами. В возрасте 8–9 лет обнаружены увеит, катаракта слева, афакия, потеря зрения на левый глаз c последующей атрофией зрительного нерва. В 1992 г. удален хрусталик левого глаза. С 2011 г. (с 26 лет) отмечались частые обострения, проводилось стационарное лечение с введением глюкокортикоидов (ГК) парентерально и локально. Назначались метотрексат (МТ) с последующей отменой в связи с развитием нежелательных реакций и сульфасалазин (ССЗ) также с последующей отменой из-за недостаточной эффективности. С 2017 г. появились зудящие высыпания на коже ладоней и нижних конечностей. Дерматологом поставлен диагноз «хроническая экзема, атопический дерматит, ксероз кожи». По поводу увеита ежегодно наблюдалась офтальмологом. В феврале 2018 г. – DS-эметропия OS – вторичная терминальная декомпенсированная по внутриглазному давлению увеальная глаукома, афакия, дистрофия роговицы, хронический увеит.
В августе 2019 г. обратилась в НИИР им. В.А. Насоновой. В связи с недостаточным эффектом проводимой терапии рекомендована госпитализация. В ходе обследования впервые выявлен положительный ответ на HBsAg, ДНК+, а также значительное повышение антител к двуспиральной ДНК (анти-дсДНК) (> 200 МЕ/мл), наиболее вероятно из-за перекрестного реагирования с анти-HBV. Уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) сохранялись в пределах нормы. Во время госпитализации проведена локальная инъекционная терапия ГК, антиревматическая терапия не корректировалась.
После выписки консультирована инфекционистом, подтвержден диагноз HBV-инфекции, назначен энтекавир в дозе 0,5 мг/сут.
Через месяц от начала противовирусной терапии назначен лефлуномид (ЛЕФ) в дозе 10 мг/сут под контролем эффективности и безопасности.
С ноября 2019 г. доза ЛЕФ повышена до 20 мг/сут с выраженным положительным эффектом в виде уменьшения утренней скованности, увеличения силы сжатия кистей, уменьшения болевого синдрома.
По результатам консультации инфекциониста, проведенной 18 марта 2020 г., установлен хронический гепатит В без D-агента, фаза репликации, ВН – 240 МЕ/мл, анти-HBе+, биохимически неактивный. Противопоказания к терапии синтетическими и генно-инженерными биологическими препаратами отсутствовали.
С января 2020 г. отмечено обострение суставного синдрома, боль в крестце, суставах кистей и стоп, коленных суставах, скованность.
В марте 2020 г. госпитализация в дневной стационар по месту жительства, где была проведена пульс-терапия ГК (дозы не указаны). Однако существенного улучшения состояния не наблюдалось. Магнитно-резонансная томография крестцово-подвздошных суставов в режиме STIR показала наличие правостороннего сакроилиита третьей степени.
В апреле 2020 г. госпитализирована в НИИР им. В.А. Насоновой. В иммунологическом анализе крови выявлено умеренное повышение антинуклеарного фактора и анти-дсДНК. После снижения активности вирусного гепатита B анти-дсДНК более не определялись. ВН составила 2 × 103 копий/мл (900 МЕ/мл), что соответствовало умеренной виремии и стало препятствием для назначения ГИБП, несмотря на потребность в усилении терапии РА. Рекомендовано продолжить прием ЛЕФ в дозе 20 мг/сут, гидроксихлорохина (ГХ) в дозе 200 мг/сут. Кроме того, проведено локальное введение ГК.
В мае 2020 г. в связи с выявленной лейкопенией гематологом по месту жительства установлен диагноз «вторичная лейкопения лекарственного генеза (0,5 тыс./мкл)». При дополнительном обследовании (трепанобиопсия) Т-клеточный лейкоз исключен. В связи с лейкопенией доза ЛЕФ снижена до 10 мг/сут, затем препарат был отменен. Как следствие, отмечена нормализация числа лейкоцитов в клиническом анализе крови. Проводилась монотерапия ГХ в дозе 200 мг/сут с недостаточным эффектом.
С октября 2020 г. обострение РА.
В декабре 2020 г. ВН составила менее 150 МЕ/мл. В связи с недостаточной эффективностью терапии ГХ 12 апреля 2021 г. инициирована терапия голимумабом (ГЛМ) в дозе 50 мг/мес с положительным эффектом, который сохранялся до апреля 2021 г. В дальнейшем наблюдалось постепенное уменьшение его эффекта.
В октябре 2021 г. при госпитализации в НИИР им. В.А. Насоновой препарат был заменен на этанерцепт, однако значимого эффекта не отмечено.
В декабре 2021 г. обострение увеита.
После консультации инфекциониста 27 декабря 2021 г. установлен следующий диагноз: хронический вирусный гепатит В без D-агента, фаза репликации (ВН < 150 МЕ/мл), биохимически неактивный. Фиброз печени отсутствует – стадия F0 по шкале METAVIR. Назначена терапия энтекавиром в дозе 0,5 мг/сут.
На 9 февраля 2022 г. ВН менее 150 МЕ/мл.
В связи с недостаточной эффективностью проводимой антиревматической терапии 1 марта 2022 г. назначен селективный ингибитор янус-киназы упадацитиниб (УПА). На фоне лечения состояние значительно улучшилось.
Тотальное эндопротезирование коленного сустава выполнено 10 июня 2022 г. По рекомендации оперирующего врача и с согласия ревматолога в периоперационном периоде УПА был отменен на три недели. В ходе операции переливания крови и ее компонентов не потребовалось. Послеоперационный период протекал без особенностей.
В начале сентября 2022 г. пациентка отметила нарастание общей слабости и недомогание. Осмотрена терапевтом. Данных в пользу острого респираторного заболевания не получено. Клинический анализ крови: лейкоциты – 9,6 тыс./мкл, лейкоцитарная формула без особенностей, остальные показатели в пределах нормы. Биохимический анализ крови: повышение глюкозы до 7,54 ммоль/л, остальные показатели, включая АЛТ, АСТ, креатинин, общий белок, билирубин, мочевую кислоту, в пределах нормы. ВН на 21 сентября 2022 г. составила 1,3 × 102 МЕ/мл, что соответствует критериям HBV-р (рост показателя более чем на 2 десятичных логарифма по сравнению с предыдущим измерением). С учетом неэффективности энтекавира, лечение которым с 2019 г. не прерывалось, назначен тенофовир. УПА временно отменен (решение лечащего врача совпало с перерывом в лечении по административным причинам).
В контрольных анализах от 3 декабря 2022 г.: ВН – ниже порога определения, анти-HBe+, HBеAg-, анти-HBsAg-, фиброэластометрия печени – cтадия F0 по шкале METAVIR. Терапия УПА и тенофовиром продолжена.
На момент сдачи настоящей статьи в печать имела место низкая активность РА.
Обсуждение
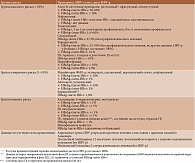
В ноябре 2022 г. экспертами Европейского альянса ассоциаций ревматологов были опубликованы рекомендации по скринингу и профилактике хронических и оппортунистических инфекций у взрослых пациентов с ИВРЗ [2], согласно которым все больные, которым планируется лечение стандартными базисными противовоспалительными препаратами (сБПВП) или таргетными синтетическими базисными противовоспалительными препаратами (тсБПВП), ГИБП, другими иммунодепрессантами и ГК (в зависимости от дозы и продолжительности), должны быть обследованы на наличие HBV. Показанием к проведению скрининга является и факт рискованного поведения («внутривенная» наркомания, множественные и беспорядочные половые контакты), а также ВИЧ-инфекция, HBV-инфицированные половые партнеры или домочадцы, потребность в гемодиализе, прибытие из регионов с высокой (2% и более) распространенностью HBV-инфекции [3]. Стандартный скрининг HBV-статуса включает определение HBsAg, анти-HBc и анти-HBs. Аналогичный объем исследований также считают целесообразным эксперты Американской ассоциации по изучению заболеваний печени [4] и Канадской ассоциации ревматологов [5], хотя последние рекомендуют скрининг только перед началом терапии ГИБП. Всех носителей HBsAg, включая тех, кто не принимает ГИБП, целесообразно направлять к гепатологу для рассмотрения вопроса о противовирусной профилактике [6]. Интерпретация данных скрининга на маркеры HBV представлена в табл. 1 [7].
Данные о вероятности HBV-р при лечении антиревматическими препаратами постоянно систематизируются и обновляются. Наиболее полными долгое время считались опубликованные в 2015 г. рекомендации Американской гастроэнтерологической ассоциации (American Gastroenterological Association – AGA) по профилактике и лечению HBV-р у больных онкологическими и системными воспалительными заболеваниями (включая ИВРЗ) [8], которые в модифицированном и дополненном виде представлены в табл. 2 [8–20].
В первую очередь причиной HBV-p считается усиление репликации вируса в условиях иммуносупрессии, а также повышенная продукция белковых антигенов, которые экспрессируются в том числе на поверхности гепатоцитов. После прекращения иммуносупрессивной терапии наблюдается восстановление иммунной системы (синдром иммунного рикошета), которая осуществляет массивный лизис гепатоцитов, инфицированных вирусом, что часто приводит к обострению гепатита [21]. В описанном выше случае, согласно существующим клиническим рекомендациям, УПА был отменен в течение трех недель в связи с проведением оперативного лечения (тотальное эндопротезирование коленного сустава) с целью снижения риска тромбообразования. Однако за все время наблюдения повышения АЛТ и АСТ не отмечено.
Еще одним фактором, способствующим HBV-p, является снижение, вплоть до потери, защитных антител к поверхностному антигену HBV (анти-HBs) [22–24]. Применение различных антиревматических препаратов (ГК, сБПВП, тсБПВП, ГИБП) требует дифференцированного подхода. ГК, назначаемые в высоких дозах, оказывают иммуносупрессивное воздействие за счет ингибирования цитотоксической функции T-клеток [25]. Геном HBV содержит ГК-чувствительные регуляторные элементы транскрипции, которые могут активироваться при лечении ГК [26]. Проблема HBV-р в первую очередь актуальна при назначении ГК в дозе 20 мг/сут и более [9, 27–32]. Однако прием этих препаратов сам по себе может быть фактором риска HBV-р. Так, согласно результатам многофакторного логистического регрессионного анализа, проведенного W.T. Lin и соавт., преднизолон в дозе более 5 мг/сут был независимым предиктором HBV-р у пациентов с системной красной волчанкой [17]. Необходимо отметить, что частота HBV-р при лечении ГК в низкой дозе у пациентов с другими ИВРЗ еще недостаточно изучена. Риск HBV-р при применении БПВП (МТ, ЛЕФ, ССЗ, ГХ и азатиоприна) считается низким. Однако недавно получены данные о том, что у HBsAg+-пациентов при лечении ЛЕФ риск HBV-р повышен [33].
В течение последних лет было показано, что, несмотря на прямое подавление фактором некроза опухоли α (ФНО-α) репликации HBV, риск HBV-р при применении ингибиторов ФНО-α является умеренным – в пять раз меньше, чем при лечении тоцилизумабом [34].
Продемонстрирована высокая частота HBV-р при лечении ритуксимабом (РТМ) и абатацептом (АБА). В течение 67 828 человеко-месяцев наблюдения у 27 (5,5%) пациентов на фоне лечения этими ГИБП имела место реконверсия HBsAg (ркHBsAg). В другой работе риск ркHBsAg был обратно пропорционален концентрации анти-HBs [35]. T.Y. Lan и соавт. подтвердили, что РТМ часто вызывает HBV-р даже у полностью серонегативных больных [36]. Недавно опубликована самая крупная на сегодняшний день серия случаев HBV-р, развившейся при применении АБА. Данные случаи демонстрируют, что терапия АБА связана не только с относительно высокой частотой HBV-р, но и нередко с риском серьезной или даже смертельной HBV-р [37].
Особым случаем является последовательное получение нескольких препаратов из групп высокого риска. Так, в работе P.S. Kim и соавт. представлены примеры HBV-р у пациентов, принимавших АБА, которые ранее получали ингибиторы ФНО-α [38]. В нашем случае имело место последовательное переключение с одного ингибитора ФНО-α (голимумаб) на второй (этанерцепт), а затем на УПА, причем перерыв в приеме препаратов второй линии составил четыре месяца. Несмотря на отсутствие данных о статусе HBsAg у нашей больной, факт переключения, вероятно, сыграл свою роль, так как у HBsAg+-пациентов терапия ингибиторами ФНО-α ассоциируется с умеренным риском HBV-р.
Данных о применении ингибиторов янус-киназ у HBsAg+-пациентов недостаточно.
Примечательно, что в описываемом нами случае пациентка постоянно получала противовирусное профилактическое лечение. Как известно, при наличии хронического вирусного гепатита В (повышение уровня АЛТ, ДНК HBV > 2000 МЕ/мл, воспалительно-некротические изменения в ткани печени) больному ИВРЗ показана противовирусная терапия, которая обычно проводится энтекавиром или тенофовиром. В большинстве опубликованных рекомендаций указано, что профилактику следует проводить всем кандидатам на иммуносупрессивную терапию, инфицированным HBV, за исключением пациентов, получающих терапию низкого риска, внутрисуставные ГК или пероральные ГК менее чем одну неделю [4, 6, 39, 40]. Противовирусную профилактику следует начинать за четыре недели до и продолжать через 6–12 месяцев после прекращения иммуносупрессивной терапии, а в случае применения препаратов высокого риска – через 12–18 месяцев. При перенесенной или разрешившейся инфекции (HBsAg-/анти-HBc+), согласно мнению совета экспертов AGA, применяющие анти-В-клеточную терапию, а также ингибиторы ФНО-α, другие антицитокиновые препараты или умеренные или высокие дозы ГК в течение четырех недель и более должны получать противовирусную профилактику. Рекомендованные дозы и спектр противовирусных препаратов не различаются для пациентов с HBsAg-/анти-HBc+ и пациентов с HBsAg+, если базовый уровень ДНК HBV в сыворотке положительный [41].
Регулярная оценка ВН и уровня АЛТ показана каждые 4–12 недель во время лечения антиревматическими препаратами. У лиц с HBsAg-/антиHBc+ при лечении РТМ необходим мониторинг титра анти-HBs. Снижение титра таких антител предваряет серореверсию (появление HBsAg) и HBV-р. Больным, ранее не контактировавшим c HBV-инфекцией (HBsAg-/анти-HBc-/анти-HBs-), рекомендуется вакцинация против гепатита В, особенно при наличии факторов риска, описанных выше [21].
Мониторинг титра анти-HBs целесообразен для определения степени защищенности пациента. Установлено, что HBV-р у пациентов с HBsAg-/антиHBc+ и титром анти-HBs > 100 МЕ/мл отсутствует. Кроме того, мониторинг позволяет своевременно регистрировать сероконверсию анти-HBs, которая с высокой долей вероятности является предиктором HBV-р [4].
Конфликт интересов
Статья подготовлена в рамках научно-исследовательской работы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7.
Исследование не имело спонсорской поддержки.
Конфликт интересов отсутствует.
G.I. Gridneva, PhD, B.S. Belov, MD, PhD, E.S. Aronova, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Galina I. Gridneva, gigridneva@mail.ru
The problem of hepatitis B reactivation in patients with rheumatology profile has been and remains relevant due to the widespread use of various immuno-suppressive drugs. As new drugs are introduced into practice, there is a need to clearly understand the likelihood of HBV reactivation and personalize the management of such patients.
A case of reactivation of HBV infection in a patient treated with upadacitinib and prophylactic with entecavir is presented. This review briefly summarizes the latest data on the mechanisms of HBV reactivation and the relative frequency of HBV reactivation, associated with various antirheumatic drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.