Структура сопутствующих заболеваний и лекарственных назначений у госпитализированных пациентов с различными формами фибрилляции предсердий
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить структуру сопутствующих заболеваний и характер лекарственных назначений у пациентов с различными формами ФП, получающих прямые оральные антикоагулянты (ПОАК).
Методы. Ретроспективно проанализированы данные пациентов с различными формами ФП, проходивших обследование и лечение в стационарах г. Москвы и принимавших ПОАК (n = 147; медиана возраста – 76 [68; 84] лет; мужчины – 37,4%, женщины – 62,6%).
Результаты. Пациенты были разделены на две группы. Первую составили пациенты с пароксизмальной ФП, вторую – пациенты с постоянной и персистирующей ФП. Во второй группе по сравнению с первой зарегистрировано статистически значимо большее количество сопутствующих заболеваний (5 [3; 6] и 6 [4; 8] соответственно; р = 0,002), большее число больных с индексом Чарлсон в диапазоне 7–10 баллов (13,8 и 30,2% соответственно; р = 0,017). В первой группе статистически значимо чаще встречался хронический гастрит неуточненной этиологии (18,1 и 0% соответственно; р = 0,001), реже – хроническая сердечная недостаточность (ХСН) в целом (63,8 и 94,3% соответственно; p < 0,001) и ХСН III или IV функционального класса по NYHA (17,1 и 49,1% соответственно; p < 0,001). Пациентам второй группы статистически значимо чаще назначались некардиоселективные бета-блокаторы (р = 0,026), антагонисты альдостерона (р < 0,001), петлевые диуретики (р = 0,002) и ингибиторы натрий-глюкозного котранспортера 2-го типа (p = 0,005). В первой группе статистически значимо чаще (р < 0,001) назначались антиаритмические препараты.
Выводы. Пациенты с разными формами ФП имеют различия в количестве и структуре сопутствующих заболеваний и характере лекарственных назначений. Полученные данные свидетельствуют о важности пациент-ориентированного подхода к ведению полиморбидных больных с ФП.
Цель – оценить структуру сопутствующих заболеваний и характер лекарственных назначений у пациентов с различными формами ФП, получающих прямые оральные антикоагулянты (ПОАК).
Методы. Ретроспективно проанализированы данные пациентов с различными формами ФП, проходивших обследование и лечение в стационарах г. Москвы и принимавших ПОАК (n = 147; медиана возраста – 76 [68; 84] лет; мужчины – 37,4%, женщины – 62,6%).
Результаты. Пациенты были разделены на две группы. Первую составили пациенты с пароксизмальной ФП, вторую – пациенты с постоянной и персистирующей ФП. Во второй группе по сравнению с первой зарегистрировано статистически значимо большее количество сопутствующих заболеваний (5 [3; 6] и 6 [4; 8] соответственно; р = 0,002), большее число больных с индексом Чарлсон в диапазоне 7–10 баллов (13,8 и 30,2% соответственно; р = 0,017). В первой группе статистически значимо чаще встречался хронический гастрит неуточненной этиологии (18,1 и 0% соответственно; р = 0,001), реже – хроническая сердечная недостаточность (ХСН) в целом (63,8 и 94,3% соответственно; p < 0,001) и ХСН III или IV функционального класса по NYHA (17,1 и 49,1% соответственно; p < 0,001). Пациентам второй группы статистически значимо чаще назначались некардиоселективные бета-блокаторы (р = 0,026), антагонисты альдостерона (р < 0,001), петлевые диуретики (р = 0,002) и ингибиторы натрий-глюкозного котранспортера 2-го типа (p = 0,005). В первой группе статистически значимо чаще (р < 0,001) назначались антиаритмические препараты.
Выводы. Пациенты с разными формами ФП имеют различия в количестве и структуре сопутствующих заболеваний и характере лекарственных назначений. Полученные данные свидетельствуют о важности пациент-ориентированного подхода к ведению полиморбидных больных с ФП.
Введение
В XXI в. заболеваемость фибрилляцией предсердий (ФП) достигла масштабов эпидемии в связи с увеличением средней продолжительности жизни, в том числе в условиях коморбидности [1–4]. В мире ФП страдают по меньшей мере 33,5 млн человек в возрасте старше 55 лет. По прогнозам, в ближайшие 50 лет количество пациентов с ФП удвоится [5].
Поскольку неклапанная ФП нередко сочетается с другими хроническими сопутствующими заболеваниями, в частности артериальной гипертензией (АГ), хронической сердечной недостаточностью (ХСН), ишемической болезнью сердца (ИБС), пациенты с ФП часто являются полиморбидными [6]. Так, в исследовании B.D. Jani и соавт. [7] (502 637 пациентов в возрасте 37–73 лет из базы данных UK Biobank) только у 19,6% пациентов с ФП отсутствовали сопутствующие заболевания, 69,3% больных имели от одного до трех коморбидных состояний, 11,1% – четыре и более (для сравнения: в группе пациентов без ФП, сопоставимых по полу и возрасту, аналогичные показатели составили 34,7, 60,2 и 11,1% соответственно) [7].
Полиморбидность у пациентов с ФП ассоциируется с неблагоприятным прогнозом, в частности с повышенным риском инсульта, худшими исходами после перенесенного острого нарушения мозгового кровообращения и меньшей выживаемостью по сравнению с пациентами без сопутствующих заболеваний [7, 8]. Кроме того, у пациентов с ФП сопутствующие заболевания связаны с повышенным риском развития кровотечений [9–13].
Помимо высокого риска развития инсульта и кровотечений у полиморбидных пациентов часто встречается полипрагмазия, создающая предпосылки для возникновения лекарственных взаимодействий, способных снижать эффективность лечения и приводить к развитию нежелательных явлений [14]. Однако нередко использование нескольких лекарственных препаратов жизненно необходимо. Поэтому, назначая прямые оральные антикоагулянты (ПОАК) пациенту с ФП и сопутствующими заболеваниями, необходимо тщательно оценивать потенциальный риск и ожидаемую пользу от фармакотерапии. В связи с этим пациентам, принимающим антикоагулянты, в том числе ПОАК, эксперты рекомендуют назначать сопутствующую гастропротективную терапию [15–17]. Подобная стратегия имеет особое значение для пациентов с желудочно-кишечными кровотечениями в анамнезе или язвенным поражением желудочно-кишечного тракта (ЖКТ).
Цель настоящего исследования – оценить структуру сопутствующих заболеваний и характер лекарственных назначений у пациентов с различными формами ФП, получавших ПОАК, в условиях реальной клинической практики.
Материал и методы
Ретроспективно были проанализированы данные пациентов, проходивших обследование и лечение в стационаре Москвы (на базе отделений терапевтического профиля ГБУЗ «Госпиталь для ветеранов войн № 2 ДЗМ», ГБУЗ «Городская клиническая больница им. Е.О. Мухина ДЗМ») в период с июня 2021 г. по март 2022 г. Таким образом, отбор в исследование осуществлялся на основании данных медицинской документации. Исследуемую популяцию составили пациенты, госпитализированные в стационар (изучалась история болезни пациента) в течение одного календарного месяца до момента включения в исследование, получавшие на этапе стационарного лечения ПОАК в соответствии с показаниями к их применению, а также пациенты, принимавшие ПОАК ранее и продолжавшие их прием в стационаре.
Критерии включения: пациенты любого пола в возрасте 18 лет и старше, принимавшие ПОАК (апиксабан, дабигатрана этексилат, ривароксабан) в соответствии с показаниями, установленными в инструкции по медицинскому применению.
Критерии невключения: возраст менее 18 лет, пациенты, не принимавшие ПОАК или получавшие ПОАК не в соответствии с показаниями, установленными в инструкции.
Период включения пациентов в исследование и общая длительность исследования составили шесть месяцев. Период наблюдения не предусматривался.
С учетом ретроспективных данных была сформирована группа больных, получавших ПОАК (n = 147). У них были проанализированы:
- анамнестические сведения;
- результаты физикального исследования, в том числе индекс массы тела, уровень артериального давления, частота сердечных сокращений;
- наличие сопутствующих заболеваний, в частности ЖКТ, анемии;
- данные лабораторного обследования, включавшего клинический и биохимический анализ крови;
- данные инструментального обследования, в том числе результаты эзофагогастродуоденоскопии (при наличии);
- фармакотерапия.
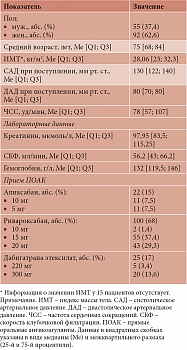
Характеристика участников исследования представлена в табл. 1.
Из 100 пациентов, получавших ривароксабан, 67 (67%) принимали препарат в дозе, установленной инструкцией по медицинскому применению, 19 (19%) – в дозе ниже, чем предусмотрено инструкцией, 1 (1%) – в дозе выше, чем требовалось. У 13 (13%) пациентов из-за отсутствия показателей клиренса креатинина оценить адекватность дозы препарата не представлялось возможным. Из 22 пациентов, принимавших апиксабан, 18 (81,8%) получали препарат в дозе, установленной в инструкции, 4 (18,2%) – в дозе меньше положенной. В отличие от пациентов, принимавших ривароксабан и апиксабан, в группе дабигатрана этексилата все 25 (100%) пациентов получали дозу в соответствии с инструкцией по медицинскому применению.
Статистический анализ проводили с использованием программного пакета SPSS v.23.0. Нулевую гипотезу о соответствии распределения нормальному закону проверяли с помощью критерия Колмогорова – Смирнова. При описании выборки для ненормально распределенных параметров проводили подсчет медианы (Ме) и интерквартильного размаха в виде 25-го и 75-го процентилей (С25 и С75), для нормально распределенных параметров определяли среднее значение (mean) со стандартным отклонением (standard deviation, SD). Качественные данные представлены в виде абсолютных чисел и относительных частот.
Результаты
Включенных в исследование пациентов (n = 147) разделили на две группы. В первую вошли 94 пациента с пароксизмальной формой ФП (33 (35,1%) мужчины, 61 (64,9%) женщина; средний возраст – 75 [66; 83] лет), во вторую – 53 пациента с постоянной и персистирующей формами ФП (22 (41,5%) мужчины, 31 (58,5%) женщина; средний возраст – 78 [71,5; 85,5] лет). Статистически значимые различия между группами по полу и возрасту отсутствовали.
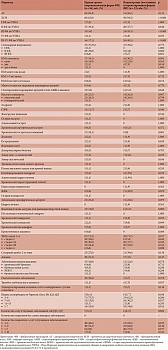
В группе пациентов с постоянной/персистирующей формой ФП сопутствующих заболеваний зарегистрировано статистически значимо больше (р = 0,002). В этой группе также было статистически значимо больше больных со значением индекса Чарлсон (специальный индекс, который используют для оценки коморбидности) от 7 до 10 (р = 0,017) (табл. 2).
При анализе структуры сопутствующих заболеваний обнаружено, что пациенты с ФП, принимавшие ПОАК, часто одновременно страдали АГ (91,8%), ХСН (74,8%), хронической болезнью почек (71,4%), стенокардией напряжения (38,1%), имели в анамнезе инфаркт миокарда (22,4%), а также сахарный диабет 2-го типа (18,4%). Подробная структура сопутствующих заболеваний представлена в табл. 2.
У пациентов с пароксизмальной формой ФП по сравнению с пациентами с постоянной и персистирующей формами статистически значимо чаще встречался хронический гастрит неуточненной этиологии (р = 0,001) и статистически значимо реже в целом ХСН (p < 0,001) и тяжелая ХСН (III или IV функциональный класс (ФК) по NYHA) (p < 0,001) (табл. 2).
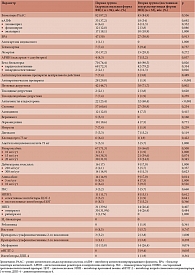
Кроме того, нами был проведен анализ фармакотерапии (табл. 3). Статистически значимое различие по частоте принимаемых препаратов между группами зарегистрировано для некардиоселективных бета-блокаторов (р = 0,026), антагонистов альдостерона (р < 0,001), петлевых диуретиков (р = 0,002) и ингибитора натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) (p = 0,005). Эти назначения чаще регистрировались у пациентов второй группы (табл. 3). Напротив, назначение антиаритмических средств статистически значимо чаще имело место у пациентов первой группы (р = 0,001). В группе пациентов с пароксизмальной формой ФП наиболее часто назначали амиодарон – 14 (15%) случаев, в частности в трех случаях с целью медикаментозной кардиоверсии. В этой же группе в качестве антиаритмической терапии 12 (12,7%) больных принимали соталол, 2 (2,1%) пациента – лаппакотина гидробромид. Во второй группе 1 (1,9%) пациент принимал пропафенон.
Обсуждение
Как известно, возраст служит одним из факторов увеличения количества сочетанных патологий. Учитывая это, а также постарение населения, приходится констатировать, что проблема полиморбидности приобретает особую актуальность. Медиана числа зарегистрированных у пациентов с ФП сопутствующих заболеваний нередко достигает 6 [8; 9]. Две трети пациентов базы Medicare (федеральная программа медицинского страхования для лиц в США в возрасте ≥ 65 лет, отдельных лиц с ограниченными возможностями в возрасте < 65 лет и лиц с терминальной стадией почечной недостаточности) характеризуются полиморбидностью, треть из них имеет четыре или более хронических сопутствующих заболевания одновременно, а более 50% – шесть или более хронических сопутствующих заболеваний. ФП занимает 11-ю позицию в структуре наиболее частых коморбидных патологий [8, 9].
Согласно полученным нами данным, среди пациентов с ФП пациентов без сопутствующих заболеваний не было, пять и более сопутствующих заболеваний имели 68% больных первой группы и 75,5% пациентов – второй (различия носили характер тенденции и не достигали статистической значимости; р = 0,197). Десять и более сопутствующих заболеваний зафиксировано у 5,3 и 9,4% пациентов первой и второй группы соответственно (без статистически значимых различий; р = 0,341). Значения индекса коморбидности Чарлсон у пациентов с перманентной/постоянной формой ФП были выше, чем у больных с пароксизмальной формой ФП (медиана 6 и 5 соответственно; р = 0,184; см. табл. 2). Кроме того, больных с 7–10 баллами во второй группе было статистически значимо (р = 0,017) больше, чем в первой (30,2 и 13,8% соответственно; см. табл. 2).
Сопутствующие заболевания ухудшают прогноз больных с ФП. Согласно данным B.D. Jani и соавт. [7], у пациентов с ФП и четырьмя и более сопутствующими заболеваниями риск смерти от всех причин почти в семь раз выше, чем у пациентов без сопутствующих заболеваний (относительный риск (ОР) с поправкой на возраст, пол, социально-экономический статус, статус курения, прием антикоагулянтной терапии – 6,80; 95% доверительный интервал (ДИ) 5,23–8,83; р < 0,001).
M. Proietti и соавт. [11] наблюдали за 24 040 пациентами с ФП в течение 12 лет. У пациентов с ФП и высоким (≥ 4 баллов) индексом коморбидности Чарлсон кумулятивная частота летального исхода от всех причин была статистически значимо выше, чем у больных со значениями данного индекса в интервале 0–3 балла (р < 0,001). Известно также, что, чем выше индекс коморбидности Чарлсон, тем выше риск развития инсульта: ОР 1,3 (95% ДИ 1,2–1,4; р < 0,001) [12]. Кроме того, в исследовании M. Proietti и соавт. [11] пациенты с ФП и высоким индексом коморбидности Чарлсон (≥ 4 балла) имели большую кумулятивную частоту инсульта (р < 0,001), чем больные со значениями данного индекса в интервале 0–3 балла.
По данным специального субанализа исследования Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE) [6], в котором сравнивали эффективность и безопасность апиксабана и варфарина, ОР развития ишемического инсульта и системных эмболий у пациентов с ФП и 3–5 сопутствующими заболеваниями составил 1,42 (95% ДИ 1,15–1,76), у пациентов с шестью и более сопутствующими заболеваниями – 1,64 (95% ДИ 1,20–2,23) по сравнению с пациентами с ФП с 0–2 сопутствующими заболеваниями (группа сравнения). ОР смерти от всех причин у пациентов с ФП и 3–5 сопутствующими заболеваниями составил 1,66 (95% ДИ 1,44–1,92), у пациентов с шестью и более сопутствующими заболеваниями – 3,56 (95% ДИ 2,99–4,23). В данный post-hoc-анализ были включены 16 800 пациентов в возрасте 55 лет и старше. Полиморбидность (в исследовании ARISTOTLE полиморбидность определяли как наличие трех и более сопутствующих заболеваний) имела место у 10 713 (64%) пациентов. При этом 8491 (51%) больной имел 3–5 сопутствующих заболеваний, 2222 (13%) – шесть и более, 6087 (36%) – 0–2. В отличие от пациентов с 0–2 сопутствующими заболеваниями полиморбидные пациенты с ФП были старше (74 против 69 лет), принимали одновременно в два раза больше препаратов (10 против 5) и имели более высокий средний балл по шкале CHA2DS2VASc (4,9 против 2,7) (во всех случаях р < 0,001). Примечательно, что эффективность и безопасность апиксабана соответствовали таковым варфарина во всех трех анализируемых группах (статистически значимые различия отсутствовали) [6].
Риск развития кровотечений у пациентов с ФП также ассоциируется с наличием сопутствующих заболеваний [10–12]. L. Fauchier и соавт. [10] в течение года и более (медиана периода наблюдения – 3,1 года) наблюдали за 1 372 567 пациентами с ФП. Частота кровотечений у полиморбидных пациентов с ФП превышала таковую у пациентов без сопутствующих заболеваний: 14,7 и 4,1% ежегодно соответственно (р < 0,001).
Согласно результатам исследования М. Proietti и соавт. [11], пациенты с ФП и высоким индексом коморбидности Чарлсон (≥ 4 балла) характеризуются более высокой кумулятивной частотой больших кровотечений (р < 0,001) по сравнению с теми, у кого данный индекс находится в пределах 0–3 балла.
Особого внимания заслуживает тот факт, что у пожилых пациентов c ФП индекс коморбидности Чарлсон является наиболее значимым предиктором развития больших кровотечений (показатель с-статистики 0,622) по сравнению со всеми четырьмя анализируемыми шкалами оценки риска кровотечений (показатели с-статистики 0,463, 0,473, 0,443, 0,445 соответственно для шкал HAS-BLED, ATRIA, ORBIT, HEMORR2HAGES) [10].
У пациентов с ФП и сопутствующими заболеваниями самым часто назначаемым антикоагулянтом оказался апиксабан [12]. Так, среди пациентов с ФП и 0–2 сопутствующими заболеваниями апиксабан назначался в 49,0% случаев, с 3–5 сопутствующими заболеваниями – в 43,5%, с шестью и более сопутствующими заболеваниями – в 41,8% случаев. Для сравнения: ривароксабан принимали 23,4, 20,0 и 16,0% пациентов, дабигатран – 4,3, 4,0, 3,7% пациентов соответственно [12].
В нашем исследовании из препаратов группы ПОАК пациенты чаще получали ривароксабан, что отмечалось как в целом в общей изучаемой популяции (68%), так и в группе пароксизмальной (71,3%) и персистирующей/постоянной ФП (66%).
Согласно результатам субанализа исследования ARISTOTLE [6], ОР развития больших кровотечений у пациентов с ФП и 3–5 сопутствующими заболеваниями составил 1,35 (95% ДИ 1,14–1,60), у пациентов с шестью и более сопутствующими заболеваниями – 1,89 (95% ДИ 1,51–2,37) (группу сравнения представляли пациенты с 0–2 сопутствующими заболеваниями).
В структуре сопутствующих заболеваний у обследованных нами пациентов по частоте встречаемости лидировали АГ и ХСН. При этом в отношении ХСН между группами выявлены статистически значимые различия. Так, ХСН имела место у 94,3% пациентов с персистирующей/постоянной ФП, в том числе тяжелая ХСН (III и IV ФК по NYHA) у 49,1%. В группе пароксизмальной ФП ХСН в целом зарегистрирована у 63,8% больных, а ХСН III и IV ФК по NYHA – у 17,1%.
ХСН и ФП за последние 20 лет стали двумя новыми эпидемиями сердечно-сосудистых заболеваний [4]. Помимо общих предрасполагающих факторов риска, таких как АГ, сахарный диабет, ИБС и клапанные пороки сердца, очевидно, что ФП и ХСН тесно взаимосвязаны, причем одно заболевание предрасполагает к развитию другого. При сочетании ФП и ХСН прогноз хуже, чем при каждом состоянии в отдельности, что продемонстрировано в ряде работ [18–21]. В частности, D.D. McManus и соавт. [19] изучали влияние сопутствующей ФП на прогноз у пациентов с ХСН с сохраненной и сниженной фракцией выброса. В исследование вошло 23 644 пациента с ХСН (средний возраст – 74,2 ± 12,1 года) из четырех центров, участвовавших в программе Cardiovascular Research Network, проводившейся под эгидой Национального института сердца, легких и крови США (National Heart Lung and Blood Institute). Анализировались сведения, содержавшиеся в виртуальном хранилище данных каждого центра, за период с 1 января 2005 г. по 31 декабря 2008 г. ФП была диагностирована у 11 429 (48,3%) участников исследования, причем 9081 из них имел аритмию изначально. У остальных 2348 пациентов она возникла во время исследования. По сравнению с пациентами без ФП у больных с ФП отмечался более высокий риск инсульта (ОР 2,47 для ФП, возникшей в период исследования, и ОР 1,57 для исходно существовавшей ФП), госпитализации по поводу сердечной недостаточности (ОР 2,00 и 1,22 соответственно), госпитализации по всем причинам (ОР 1,45 и 1,15 соответственно) и смерти от всех причин (ОР 1,67 и 1,13 соответственно). Неблагоприятная предиктивная значимость ФП по упомянутым конечным точкам была сходной у пациентов с ХСН как с сохраненной, так и сниженной фракцией выброса левого желудочка. Отличия наблюдались лишь в отношении инсульта: развившаяся в течение периода наблюдения ФП ассоциировалась с двухкратным увеличением частоты ишемического инсульта как у пациентов с сохраненной, так и у пациентов со сниженной фракцией выброса. В отличие от этого исходно имевшая место ФП повышала риск инсульта только у пациентов с сохраненной систолической функцией сердца (ОР 1,91).
Негативное влияние сопутствующей ФП на смертность пациентов с ХСН также подтверждено в ретроспективном анализе [20] данных программы Studies of Left Ventricular Dysfunction (SOLVD). Были проанализированы данные 419 пациентов с ФП и 6098 пациентов с синусовым ритмом (средний возраст – 60–63 года, фракция выброса левого желудочка – 26–27% в зависимости от группы). Все участники исследования имели ХСН. В среднем период наблюдения составил 33,4 ± 14,3 месяца. Авторы установили, что у пациентов с исходной ФП по сравнению с больными с синусовым ритмом статистически значимо выше показатели смертности от всех причин (34 против 23%; p < 0,001), смертности, связанной с недостаточностью систолической функции левого желудочка (16,7 против 9,4%; p < 0,001). У пациентов с исходной ФП статистически значимо чаще регистрировалась комбинированная конечная точка в виде смерти или госпитализации по поводу сердечной недостаточности (45 против 33%; p < 0,001). Вместе с тем между группами не отмечалось различий по частоте аритмогенных фатальных исходов.
По данным многофакторного анализа, ФП у пациентов с ХСН статистически значимо ассоциируется со смертностью от всех причин (ОР 1,34; 95% ДИ 1,12–1,62; p = 0,002), смертностью от прогрессирующей систолической дисфункции левого желудочка (ОР 1,42; 95% ДИ 1,09–1,85; p = 0,01) и комбинированной конечной точкой в виде сочетания смерти или госпитализации по поводу сердечной недостаточности (ОР 1,26; 95% ДИ 1,03–1,42; p = 0,02).
Сходные данные, свидетельствующие о статистически значимом повышении показателей смертности у пациентов с ФП и ХСН, получены в одном из анализов Фрамингемского исследования [18], проведенном в 1948–1998 гг. За период наблюдения ФП и/или ХСН возникла у 1470 пациентов. У пациентов с ФП развитие ХСН впоследствии ассоциировалось с ростом смертности (авторы не уточняют конкретный тип данной конечной точки, но, судя по контексту публикации, речь идет о смертности от всех причин): у мужчин ОР 2,7 (95% ДИ 1,9–3,7), у женщин ОР 3,1 (95% ДИ 2,2–4,2). У пациентов с ХСН развитие ФП в дальнейшем также способствовало повышению смертности: у мужчин ОР 1,6 (95% ДИ 1,2–2,1), у женщин ОР 2,7 (95% ДИ 2,0–3,6). Кроме того, ХСН в анамнезе ухудшала выживаемость пациентов с ФП: у мужчин ОР 2,2 (95% ДИ 1,6–3,0), у женщин ОР 1,8 (95% ДИ 1,3–2,3).
При анализе структуры лекарственных назначений нами обнаружено, что в группе персистирующей/постоянной ФП по сравнению с группой пароксизмальной ФП статистически значимо чаще назначались петлевые диуретики (71,7 и 41,7% случаев соответственно; р = 0,002), антагонисты альдостерона (60,4 и 23,4%; р < 0,001) и иНГЛТ-2 (9,4% случаев в группе персистирующей/постоянной ФП и 0% случаев в группе пароксизмальной ФП; р = 0,005). Подобные результаты можно объяснить более высокой частой встречаемости ХСН в целом, в том числе тяжелой ХСН (III–IV ФК по NYHA) в группе персистирующей/постоянной ФП, поскольку именно эти препараты, согласно рекомендациям [22], включены в первоочередную схему лечения больных с симптомной ХСН.
В соответствии с полученными результатами, пациентам с пароксизмальной ФП в отличие от пациентов с персистирующей/постоянной формой ФП статистически значимо чаще назначали антиаритмические препараты (29,8 и 1,9% случаев соответственно; р < 0,001). Наблюдаемые различия в частоте назначения антиаритмиков, с нашей точки зрения, можно объяснить тем, что при пароксизмальной форме ФП в клинической практике обычно выбирают стратегию сохранения синусового ритма, поскольку, по имеющимся данным, подобный подход обеспечивает лучший прогноз для пациентов [23].
Заключение
У пациентов с разными формами ФП имеются различия в отношении количества и структуры сопутствующих заболеваний и характера лекарственных назначений. Больные с персистирующей/постоянной формой ФП характеризуются более высоким бременем полиморбидности по сравнению с пациентами с пароксизмальной формой ФП. Кроме того, у пациентов с разными формами ФП чаще регистрируется ХСН (особенно ее более тяжелые фенотипы), что приводит к закономерным различиям в структуре лекарственных назначений (выше частота назначения петлевых диуретиков, антагонистов альдостерона и иНГЛТ-2), связанных с данной нозологией.
Полученные нами результаты указывают на важность пациент-ориентированного подхода к ведению полиморбидных больных, предполагающего комплексный анализ клиницистом общей картины сопутствующих заболеваний, взвешенное назначение лекарственных препаратов, минимизацию их количества, учет лекарственных взаимодействий. Соблюдение данных принципов особенно важно для пациентов с ФП. Как показывают результаты проведенного исследования, данные базовые алгоритмы должны прежде всего лежать в основе ведения больных с персистирующей/постоянной формами ФП. Можно предположить, что реализация подобной стратегии у пациентов с ФП будет способствовать улучшению баланса риска кровотечений и риска тромбоэмболических событий и благоприятно отражаться на дальнейшем прогнозе.
Авторы заявляют об отсутствии конфликта интересов и дополнительной финансовой поддержки.
I.Yu. Orlova, A.I. Kochetkov, PhD, V.B. Dashabylova, N.Yu. Voevodina, PhD, M.V. Lopukhina, PhD, G.F. Piksina, PhD, O.D. Ostroumova, PhD, Prof.
Russian Medical Academy of Continuous Professional Education
E.O. Mukhin Municipal Clinical Hospital, Moscow
I.M. Sechenov First Moscow Medical University
Contact person: Olga D. Ostroumova, ostroumova.olga@mail.ru
Background. Currently, there is a trend towards an increase in polymorbid patients in combination with atrial fibrillation (AF), which leads to adverse events of polypharmacy, an increased risk of adverse outcomes.
Objective to evaluate the structure of comorbidities and prescribed drugs in patients with various forms of AF receiving direct oral anticoagulants (DOACs).
Methods. The data of patients with various forms of AF who underwent examination and treatment in hospitals in Moscow and took DOACs were retrospectively analyzed (n=147; median age 76 [68; 84] years, men – 37.4%, women – 62.6%).
Results. The patients were divided into 2 groups: the first – patients with paroxysmal AF, the second – patients with permanent and persistent AF. In the second group, in comparison with the first group, a significantly greater number of concomitant diseases was registered (respectively, 5 [3; 6] and 6 [4; 8]; p = 0.002), a larger number of patients with the Charlson index in the range of 7–10 points (respectively, 13.8 and 30.2%; p = 0.017). In the first group, chronic gastritis of unspecified etiology was significantly more common (respectively, 18.1 and 0%; p = 0.001), less common chronic heart failure (CHF) in general (respectively, 63.8 and 94.3%; p < 0.001) CHF III or IV functional class according to NYHA (respectively, 17.1 and 49.1%; p < 0.001). In patients of the second group, non-cardioselective beta-blockers (p = 0.026), aldosterone antagonists (p < 0.001), loop diuretics (p = 0.002) and sodium-glucose cotransporter type 2 inhibitors (p = 0.005) were significantly more frequently prescribed. In the first group, antiarrhythmic drugs were prescribed significantly (p < 0.001) more often.
Conclusion. Patients with different forms of AF have differences in the number and structure of comorbidities and the nature of drug prescriptions. The data obtained indicate the importance of a patient-oriented approach to the management of polymorbid patients with AF.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.