Структурно-функциональное ремоделирование левого предсердия у пациентов с различными формами фибрилляции предсердий
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследовании участвовали 124 пациента. Первую группу составили 70 пациентов с пароксизмальной формой ФП – 49 (70%) женщин и 21 (30%) мужчина (медиана возраста – 73 [64,75; 76,5] года), вторую – 54 пациента с постоянной или персистирующей формой ФП – 33 (61%) женщины и 21 (39%) мужчина (медиана возраста – 78,5 [68; 83] года). Всем пациентам была выполнена трансторакальная эхокардиография (ЭхоКГ) с применением методики speckle tracking.
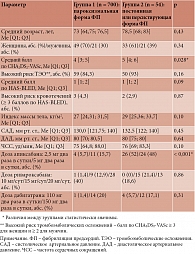
Результаты. У пациентов с постоянной или персистирующей формой ФП по сравнению с больными с пароксизмальной формой ФП были статистически значимо больше переднезадний размер ЛП (4,6 и 4,0 см соответственно), максимальный объем ЛП (60,4 и 35,4 мл), минимальный объем ЛП (83,1 и 65,7 мл), индекс объема ЛП (44 и 35,4 мл/м2), индекс жесткости ЛП (1,4 и 0,6) и статистически значимо меньше усредненный стрейн ЛП (6,1 и 18,3%), усредненная скорость стрейна ЛП (1,1 и 2,3 с-1), индекс растяжимости ЛП (0,4 и 0,9 соответственно) (р < 0,001 для всех сравнений).
Вывод. У пациентов с различными формами ФП, по данным ЭхоКГ с применением методики speckle tracking, выявлены увеличение размеров и объемов ЛП, снижение растяжимости/повышение жесткости миокарда ЛП и нарушение его деформации. Все эти изменения в большей степени были выражены у пациентов с постоянной или персистирующей формой ФП.
Материал и методы. В исследовании участвовали 124 пациента. Первую группу составили 70 пациентов с пароксизмальной формой ФП – 49 (70%) женщин и 21 (30%) мужчина (медиана возраста – 73 [64,75; 76,5] года), вторую – 54 пациента с постоянной или персистирующей формой ФП – 33 (61%) женщины и 21 (39%) мужчина (медиана возраста – 78,5 [68; 83] года). Всем пациентам была выполнена трансторакальная эхокардиография (ЭхоКГ) с применением методики speckle tracking.
Результаты. У пациентов с постоянной или персистирующей формой ФП по сравнению с больными с пароксизмальной формой ФП были статистически значимо больше переднезадний размер ЛП (4,6 и 4,0 см соответственно), максимальный объем ЛП (60,4 и 35,4 мл), минимальный объем ЛП (83,1 и 65,7 мл), индекс объема ЛП (44 и 35,4 мл/м2), индекс жесткости ЛП (1,4 и 0,6) и статистически значимо меньше усредненный стрейн ЛП (6,1 и 18,3%), усредненная скорость стрейна ЛП (1,1 и 2,3 с-1), индекс растяжимости ЛП (0,4 и 0,9 соответственно) (р < 0,001 для всех сравнений).
Вывод. У пациентов с различными формами ФП, по данным ЭхоКГ с применением методики speckle tracking, выявлены увеличение размеров и объемов ЛП, снижение растяжимости/повышение жесткости миокарда ЛП и нарушение его деформации. Все эти изменения в большей степени были выражены у пациентов с постоянной или персистирующей формой ФП.
![Таблица 2. Сравнительный анализ структурно-функциональных характеристик ЛП по данным трансторакальной ЭхоКГ с применением методики speckle tracking у пациентов с различными формами ФП (Ме [Q1; Q3])](/upload/resize_cache/iblock/e51/195_350_1/Orlova2.jpg)
Введение
Фибрилляция предсердий (ФП) – одна из наиболее часто встречающихся в клинической практике наджелудочковых аритмий, распространенность которых в популяции увеличивается с возрастом, достигая одного случая на десять человек среди лиц старше 80 лет [1]. Клиническая значимость ФП заключается в том, что она является причиной развития кардиоэмболических инсультов: по некоторым данным, вследствие ФП развиваются 25–30% ишемических инсультов (кардиоэмболический подтип ишемического инсульта) [2].
Развитие любых форм ФП ассоциировано с изменениями в левом предсердии (ЛП). Любое анатомо-физиологическое изменение и/или снижение функции ЛП называют структурно-функциональным ремоделированием. Именно оно впоследствии приводит к электрическому дисбалансу и развитию сначала пароксизмальной, а затем и персистирующей/постоянной формы ФП [3]. Структурное ремоделирование – результат прогрессирования интерстициального фиброза, впоследствии приводящего к дилатации ЛП [4]. Для оценки функционального ремоделирования предсердий используются не только стандартные (фракция выброса), но и другие параметры, в том числе расчетные, на основе современных технологий (анализ деформации, strain) [5]. Процессы ремоделирования ЛП обычно связаны с развитием фиброза предсердий [6].
Благодаря совершенствованию ультразвуковых диагностических методов стал возможным подробный анализ размеров, функции ЛП, а также механизма его ремоделирования [7]. Методу speckle tracking уделяют особое внимание, поскольку он способствует возникновению новых представлений о патофизиологических процессах развития и прогрессирования различных видов аритмий, в том числе ФП [7].
Целью настоящего исследования стала сравнительная оценка параметров структурно-функционального ремоделирования ЛП у пациентов с различными формами ФП по данным трансторакальной эхокардиографии (ЭхоКГ) с применением методики speckle tracking.
Материал и методы
Протокол ретроспективного исследования рассмотрен и одобрен Этическим комитетом Российской медицинской академии непрерывного профессионального образования (протокол № 6 от 20 июня 2023 г.).
Критерии включения: пациенты обоего пола в возрасте 18 лет и старше с различными формами ФП неклапанной этиологии, подтвержденной при регистрации 12-канальной электрокардиограммы (ЭКГ) и/или суточном мониторировании ЭКГ по Холтеру, которые принимали прямые оральные антикоагулянты и у которых были выполнены рутинная трансторакальная и speckle tracking ЭхоКГ.
Критерии невключения: возраст младше 18 лет, беременность, лактация, пациенты с протезированными клапанами или митральным стенозом средней/тяжелой степени, скорость клубочковой фильтрации (CКФ) менее 15 мл/мин/1,73м² по CKD-EPI и/или клиренс креатинина по формуле Кокрофта – Голта менее 15 мл/мин, обратимые причины ФП, клинически значимое кровотечение на момент включения, острый коронарный синдром в течение 12 месяцев, предшествовавших исследованию, состояния, сопровождающиеся существенным повышением риска геморрагических событий, определенные сопутствующие заболевания и состояния (системные заболевания соединительной ткани, заболевания крови, влияющие на гемостаз, онкологические заболевания, выраженная печеночная недостаточность (классы B и С по классификации Чайлда – Пью), тяжелые психические расстройства. Все пациенты находились на лечении в отделениях кардиологического профиля Городской клинической больницы им. Е.О. Мухина (Москва).
В исследовании участвовали 124 пациента. Первую группу составили 70 пациентов с пароксизмальной формой ФП – 49 (70%) женщин и 21 (30%) мужчина (медиана возраста – 73 [64,75; 76,5] года), вторую – 54 пациента с постоянной или персистирующей формой ФП – 33 (61%) женщины и 21 (39%) мужчина (медиана возраста – 78,5 [68; 83] года). Клинические характеристики участников исследования представлены в табл. 1.
При сравнении сопутствующих заболеваний обнаружено, что во второй группе оказалось статистически значимо больше (р = 0,001) пациентов с хронической сердечной недостаточностью III функционального класса – 17 (31,5%). В первой группе их было 5 (7,1%). Других статистически значимых различий между группами не выявлено.
При анализе медикаментозной терапии установлено, что во второй группе бета-адреноблокаторы принимали 52 (96,3%) пациента, в первой – 48 (68,6%) больных (р < 0,001 между группами). Соталол статистически значимо чаще назначался в группе с пароксизмальной формой ФП – 13 (18,6%) пациентов (р = 0,001), чем во второй – 0 (0%). Как показал анализ диуретической терапии, во второй группе статистически значимо чаще назначали терапию петлевыми диуретиками – 34 (63%) случая и антагонистами минералокортикоидных рецепторов – 21 (38,9%). В первой группе эти показатели составили 11 (15,7%) и 8 (11,4%) больных соответственно. Шесть пациентов второй группы получали дигоксин. В первой группе никто из больных не принимал сердечных гликозидов (р < 0,001 и р = 0,041 соответственно).
ЭхоКГ проводилась с помощью ультразвукового сканера Philips Epic7 (Philips Ultrasound, США) и широкополосного секторного датчика S5–1 (1–5 МГц) по стандартной методике [7–10]. Измерение и трактовка показателей осуществлялись в соответствии с рекомендациями Американского эхокардиографического общества и Европейской ассоциации сердечно-сосудистой визуализации по количественной оценке структуры и функций камер сердца (2015) [7], Консенсуса экспертов Европейской ассоциации сердечно-сосудистой визуализации по стандартизации протокола трансторакальной эхокардиографии (2018) [8], рекомендациями Американского эхокардиографического общества и Европейской ассоциации сердечно-сосудистой визуализации по оценке диастолической функции (2016) [9] и Консенсуса Европейской ассоциации сердечного ритма и Европейской ассоциации сердечно-сосудистой визуализации по мультимодальной визуализации у пациентов с ФП (2016) [10].
Speckle tracking-ЭхоКГ выполняли на ультразвуковом сканере Philips Epic7 (Philips Ultrasound, США) с использованием широкополосного секторного датчика S5–1 (1–5 МГц) в соответствии с Консенсусом Европейской ассоциации сердечно-сосудистой визуализации, Американского эхокардиографического общества, рабочей группы производителей инструментов визуализации по стандартизации определения деформации левого предсердия, правого желудочка и правого предсердия по методике speckle tracking (2018) [11], Консенсусом Европейской ассоциации сердечного ритма и Европейской ассоциации сердечно-сосудистой визуализации по мультимодальной визуализации у пациентов с ФП (2016) [10] и Консенсусом по использованию существующих и внедряемых методик количественной оценки механики сердца (2011) [12].
Статистическую обработку данных проводили с помощью программы IBM SPSS Statistics Base 22.0.
Результаты
При сравнении линейных размеров ЛП установлено, что его переднезадний размер у пациентов второй группы (постоянная или персистирующая форма ФП) был больше, чем у пациентов первой группы (пароксизмальная форма ФП) (табл. 2).
Пациентов с увеличением переднезаднего размера ЛП (> 4 см) во второй группе было статистически значимо больше, чем в первой (49 (90,7%) и 38 (54,3%) соответственно, р < 0,001). Изучение объемных характеристик ЛП свидетельствует о том, что у больных с постоянной или персистирующей формой ФП по сравнению с пациентами с пароксизмальной формой ФП статистически значимо выше индекс объема ЛП, а также максимальный и минимальный объемы ЛП (табл. 2). Количество больных с индексом объема ЛП > 34,0 мл/м2 во второй группе было статистически значимо больше, чем в первой (48 (88,9%) и 38 (54,3%) соответственно; р < 0,001).
Кроме того, у пациентов с постоянной или персистирующей формами ФП по сравнению с пациентами с пароксизмальной формой ФП был статистически значимо выше индекс жесткости ЛП, а индекс растяжимости ЛП и усредненная скорость стрейна, напротив, статистически значимо ниже (р < 0,001 для всех сравнений; табл. 2). При этом в обеих группах было примерно одинаковое количество пациентов со значениями стрейна ЛП меньше нормы (64 (93,4%) пациента в первой группе и 51 (94,4%) – во второй; р = 0,73).
Обсуждение
Возможности современной ЭхоКГ позволяют оценить функцию ЛП, используя количественный анализ параметров продольной деформации (strain) и скорости деформации (strain rate) [7]. Ранее для оценки индекса деформации проводили тканевое допплеровское эхокардиографическое исследование [7]. Однако данный метод имеет существенные ограничения, обусловленные тем, что полученные результаты зависят от угла ультразвукового сканирования [13]. По сравнению со стандартными параметрами, характеризующими функцию ЛП, параметры деформации и скорости деформации относительно независимы и позволяют оценить пофазовую функцию ЛП на протяжении всего сердечного цикла [14].
Структурно-функциональное ремоделирование ЛП обычно ассоциировано с фиброзом предсердий [6, 7]. Несмотря на то что магнитно-резонансная томография (МРТ) с контрастным усилением считается золотым стандартом для оценки фиброза у пациентов с различными формами ФП, доступность данного метода исследования ограниченна [15]. Не случайно в клинической практике для оценки фиброза ЛП в качестве альтернативного метода применяют ЭхоКГ [6, 7].
N.F. Marrouche и соавт. [16] показали, что анализ деформации ЛП по 2D STE у больных с персистирующей ФП коррелирует со степенью фиброза, обнаруженного при МРТ с контрастным усилением. В данном исследовании у пациентов с персистирующей ФП степень фиброза была ожидаемо выше, чем при пароксизмальной ФП. Частота рецидива ФП была ниже у пациентов со сниженным структурным ремоделированием. Таким образом, показано, что эхокардиографическая оценка структурно-функциональных изменений ЛП в достаточной степени соответствует фиброзным изменениям в предсердиях, выявленных при МРТ с отсроченным контрастированием [16, 17].
Ранее также была установлена взаимосвязь между объемом фиброза и дисфункцией предсердий. При этом особенно сильные корреляции выявлены именно у пациентов с ФП, фиброз ЛП связан с его функциональным ремоделированием [6].
Выявленные нами изменения параметров деформации ЛП, особенно у пациентов с постоянной или персистирующей формой ФП, свидетельствуют о более высоком риске развития неблагоприятных событий, в частности инсульта, в указанной когорте больных. Так, J.Y. Shih и соавт. [15] провели небольшое (n = 66) ретроспективное исследование c участием пациентов с постоянной формой ФП и обнаружили, что систолическая деформация ЛП и пиковая скорость систолической деформации ЛП статистически значимо ассоциируются с развитием инсультов. P.C. Hsu и соавт. [18] также установили, что увеличение отношения скорости раннего трансмитрального потока (Е) и деформации ЛП и уменьшение деформации ЛП связаны со статистически значимым повышением частоты развития неблагоприятных цереброваскулярных событий.
Заключение
У пациентов с различными формами ФП, по данным ЭхоКГ с применением методики speckle tracking, выявлены увеличение размеров и объемов ЛП, снижение растяжимости/повышение жесткости миокарда ЛП и нарушение его деформации. Все эти изменения в большей степени выражены у пациентов с постоянной или персистирующей формой ФП.
Применение усовершенствованных методов диагностики, в частности speckle tracking, в реальной клинической практике позволит своевременно идентифицировать пациентов с ФП с высоким риском развития неблагоприятных цереброваскулярных событий и в будущем разработать персонализированные схемы их ведения. Это, безусловно, отразится на увеличении продолжительности жизни больных и улучшении ее качества.
I.Yu. Orlovа, A.I. Kochetkov, PhD, O.D. Ostroumovа, PhD, Prof., M.V. Lopukhinа, PhD, G.F. Piksina, PhD
Russian Medical Academy of Continuous Professional Education
E.O. Mukhin Municipal Clinical Hospital, Moscow
I.M. Sechenov First Moscow State Medical University
Contact person: Olga D. Ostroumova, ostroumova.olga@mail.ru
The purpose of this study was a comparative assessment of the parameters of structural and functional remodeling of the left atrium (LA) in patients with different forms of atrial fibrillation (AF).
Material and methods. 124 patients participated in the study. The first group consisted of 70 patients with paroxysmal AF – 49 (70%) women and 21 (30%) men (median age – 73 [64.75; 76.5] years), the second – 54 patients with permanent or persistent AF – 33 (61%) women and 21 (39%) men (median age is 78.5 [68; 83] years). All patients underwent transthoracic echocardiography (EchoCG) using the speckle tracking technique.
Results. In patients with permanent or persistent AF, compared with patients with paroxysmal AF, the anterior-posterior LA size (4.6 and 4.0 cm, respectively), the maximum LA volume (60.4 and 35.4 ml), the minimum LA volume (83.1 and 65.7 ml), the LA volume index (44 and 35.4 ml/m2), LA stiffness index (1.4 and 0.6) and statistically significantly lower average LA strain (6.1 and 18.3%), average LA strain rate (1.1 and 2.3 s-1), LA extensibility index (0.4 and 0.9, respectively) (p < 0.001 for all comparisons).
Conclusion. In patients with various forms of AF, according to EchoCG data using the speckle tracking technique, an increase in the size and volume of LA, a decrease in the extensibility/stiffness of the LA myocardium and a violation of its deformation were revealed. All these changes were more pronounced in patients with permanent or persistent AF.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.