Дефицит тестостерона как прогностический фактор при операциях на органах мошонки
- Аннотация
- Статья
- Ссылки
- English



Введение
Гидроцеле, или водянка яичка, – довольно распространенное урологическое заболевание. Оно может быть врожденным или приобретенным, а потому встречается у мужчин любого возраста.
Врожденная водянка оболочек яичка чаще бывает сообщающейся. Она возникает при незаращении влагалищного отростка брюшины, по которому брюшная жидкость может опускаться в мошонку. Данное состояние считается физиологическим, поскольку зачастую в течение первого года жизни влагалищный отросток брюшины закрывается, в результате чего происходит самоизлечение [1].
Среди причин развития приобретенной водянки яичка выполненные операции по поводу варикоцеле, паховой грыжи, инфекционно-воспалительные заболевания и онкологические процессы, а также бытовой травматизм. Кроме того, гидроцеле может быть идиопатическим, когда его причиной становится дисбаланс между секретируемой и абсорбируемой собственной оболочкой яичка жидкостью [1–3].
Диагностика гидроцеле сегодня не вызывает затруднений и основывается на результатах сбора анамнеза, диафаноскопии и ультразвукового исследования органов мошонки [1].
К негативным проявлениям гидроцеле относятся косметический дефект, дискомфорт при движении и половом акте, что значительно ухудшает качество жизни пациента. Кроме того, в литературе имеются единичные данные об ухудшении сперматогенеза и тестикулярной функции [4, 5].
На сегодняшний день выделяют два метода лечения гидроцеле: хирургический и малоинвазивный (склеротерапия). Ранее применялась простая аспирация жидкости из мошонки, но эффективность этой процедуры была невелика, поскольку через некоторое время жидкость набиралась повторно. Склеротерапия – новый малоинвазивный метод, при котором после пункции вводится раствор 96%-ного этанола, что приводит к склерозированию оболочек. Проведенные исследования демонстрируют эффективность данного метода, тем не менее для полного избавления от гидроцеле необходимо несколько сеансов [3]. Поэтому на сегодняшний день в большинстве случаев предпочтение отдается традиционным хирургическим методам лечения – операциям Бергмана, Винкельмана, Лорда.
Несмотря на то что эти методы лечения применяются давно, вопрос воздействия хирургического вмешательства на яички как на основной орган, производящий андрогены, остается неизученным. В данных литературы информации об изменении гормонального фона в результате хирургического вмешательства обнаружено не было. Таким образом, изучение изменений гормонального фона при хирургических методах лечения гидроцеле остается актуальным вопросом современной урологии и андрологии.
Цель исследования
Изучение изменений гормонального фона при операции Бергмана.
Материал и методы
Обследованы 35 пациентов с гидроцеле справа/слева, которые перенесли операцию Бергмана. Перед хирургическим вмешательством всем больным выполнены необходимые стандартные общеклинические, лабораторные исследования и функциональные обследования. Кроме того, определялись уровни общего тестостерона, лютеинизирующего гормона и глобулина, связывающего половые гормоны, в крови с помощью иммунохимического метода. Уровень гормонов в крови оценивался за две недели и за сутки до операции и на 3, 10, 30 и 90-е сутки после выполнения оперативного вмешательства. Уровень свободного тестостерона рассчитывался по номограмме Вермюлена. Всем пациентам также было проведено тестирование с помощью Опросника возрастных симптомов андрогенного дефицита у мужчин, Международного индекса эректильной функции и Госпитальной шкалы тревоги и депрессии.
Больные были разделены на две группы. В группу I (n = 13) вошли пациенты с уровнем общего тестостерона крови от 12,1 нмоль/л и более, в группу II (n = 22) – 12 нмоль/л и менее. Группу II разделили на две подгруппы. Пациентам с лабораторно диагностированным дефицитом тестостерона (подгруппа IIA, n = 11) за две недели до оперативного вмешательства была начата заместительная гормональная терапия (ЗГТ) смесью эфиров тестостерона раз в десять дней. За сутки до оперативного вмешательства провели контроль уровня гормонов (общего тестостерона, лютеинизирующего гормона и глобулина, связывающего половые гормоны). Пациенты с дефицитом тестостерона подгруппы IIБ (n = 11) ЗГТ не получали.
Всем пациентам выполнена операция Бергмана.
Статистическая обработка данных проводилась с использованием программы Microsoft Excel 2016, рассчитывались медиана, первый и третий квартили. Уровень статистической значимости определялся по критерию Вилкоксона с поправкой Бонферрони. Сравнение подгрупп по качественному признаку (частота появления осложнений) проводилось с помощью точного критерия Фишера.
Результаты исследования
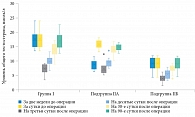
У всех пациентов в результате оперативного вмешательства значительно снизился уровень тестостерона (рис. 1). Среднее значение общего тестостерона до оперативного вмешательства в группе I составляло 17,2 [15,7; 19,2] нмоль/л. В раннем послеоперационном периоде уровень общего тестостерона снизился на 56% до 7,6 [6,2; 8,7] нмоль/л на третьи сутки после операции. С десятых суток началось восстановление уровня общего тестостерона, его уровень повысился до 9,9 [9,3; 10,9] нмоль/л. На 30-е сутки он был ниже дооперационных значений всего на 18% – 14,2 [12,9; 15,6] нмоль/л, а к 90-м суткам практически достиг исходного уровня – 16,2 [15,5; 18,9] нмоль/л, то есть был всего на 6% ниже, чем до хирургического вмешательства.
В подгруппе IIA до оперативного вмешательства наблюдался дефицит общего тестостерона – 8,9 [7,5; 9,7] нмоль/л. На фоне начатой ЗГТ он повысился и за сутки до операции достиг 15,6 [14,8; 16,9] нмоль/л (+75%). К третьим суткам после операции уровень общего тестостерона снизился на 56% до 6,9 [6; 7,8] нмоль/л. К десятым суткам отмечался подъем относительно третьих суток – до 9,7 [8,2; 10] нмоль/л. К 30-м суткам уровень общего тестостерона вырос до 13,9 [13,2; 14,9] нмоль/л, что было на 11% ниже, чем за сутки до операции. К 90-м суткам после оперативного вмешательства уровень общего тестостерона незначительно отличался от значений, достигнутых на фоне ЗГТ – 14,9 [14,3; 15,6] нмоль/л, это всего на 5% ниже, чем за сутки до операции. Таким образом, на фоне проводимой ЗГТ у пациентов подгруппы IIA отмечалась нормализация уровня общего тестостерона к 30-м суткам после операции и дальнейший его рост вплоть до 90-х суток.
В подгруппе IIБ до оперативного вмешательства также имел место дефицит общего тестостерона – 9,2 [8,2; 11] нмоль/л. К третьим суткам после операции уровень общего тестостерона опустился до 3,9 [3,4; 4,7] нмоль/л (-58%). В сравнении с третьими сутками к десятым суткам был отмечен подъем до 5,8 [4,3; 6,4] нмоль/л. К 30-м суткам уровень общего тестостерона продолжил восстанавливаться и составил 7,9 [7,1; 8,3] нмоль/л, тем не менее он все еще был на 14% ниже, чем до операции. Только к 90-м суткам уровень общего тестостерона вернулся к дооперационным значениям, повысившись до 9 [8,2; 10,7] нмоль/л. Нормализации уровня общего тестостерона в данной группе за все время исследования не наблюдалось.
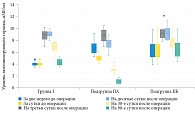
У пациентов группы I и подгруппы IIБ в раннем послеоперационном периоде регистрировалось повышение уровня лютеинизирующего гормона с его последующим постепенным снижением к 90-м суткам. У пациентов подгруппы IIA имела место следующая динамика изменений уровня лютеинизирующего гормона: снижение на фоне начатой ЗГТ, подъем после оперативного вмешательства и дальнейшее постепенное снижение, демонстрирующее эффективность проводимой ЗГТ (рис. 2).
Среднее значение уровня лютеинизирующего гормона у пациентов группы I до оперативного вмешательства составило 3,9 [3,8; 4,1] мМЕ/мл. К третьим суткам после операции уровень лютеинизирующего гормона повысился на 130% и достиг 9 [8,4; 9,5] мМЕ/мл, оставаясь на этом уровне и на десятые сутки – 9 [8,8; 9,3] мМЕ/мл. К 30-м суткам уровень лютеинизирующего гормона начал постепенно снижаться, достигнув 6,9 [6,3; 7,6] мМЕ/мл. К 90-м суткам уровень лютеинизирующего гормона практически вернулся к дооперационным значениям – 4,3 [3,9; 4,8] мМЕ/мл (на 10% выше, чем до операции).
У пациентов подгруппы IIА среднее значение уровня лютеинизирующего гормона до хирургического вмешательства составляло 6,5 [6,1; 7,1] мМЕ/мл. За сутки до операции на фоне начатой ЗГТ его концентрация снизилась на 23% до 5 [4,7; 5,2] мМЕ/мл. На третьи сутки после операции уровень лютеинизирующего гормона вырос на 76% до 8,8 [8,1; 9,6] мМЕ/мл, что свидетельствует об ответе на хирургическое лечение. К десятым суткам уровень лютеинизирующего гормона уменьшился до 7,6 [6,9; 7,9] мМЕ/мл, к 30-м суткам – до 3 [2,9; 3,1] мМЕ/мл. На 90-е сутки уровень лютеинизирующего гормона составлял 1,1 [0,8; 1,3] мМЕ/мл (на 83% меньше первоначального дооперационного показателя), что демонстрирует эффективность проводимой ЗГТ.
Среднее значение уровня лютеинизирующего гормона у пациентов подгруппы IIБ до оперативного вмешательства составляло 5,5 [5,2; 6,8] мМЕ/мл. К третьим суткам после операции уровень лютеинизирующего гормона вырос на 65% до 9,1 [8,5; 9,7] мМЕ/мл. К десятым суткам выраженной динамики не наблюдалось, концентрация гормона в крови не изменилась и равнялась 9,1 [8,2; 9,9] мМЕ/мл. Только к 30-м суткам уровень лютеинизирующего гормона снизился до 7,3 [6,9; 8,1] мМЕ/мл. Несмотря на положительную динамику, он был выше дооперационных значений на 33%. К 90-м суткам уровень лютеинизирующего гормона уменьшился до 6 [5,3; 7,1] мМЕ/мл. Тем не менее его уровень был выше, чем до операции, на 9%.
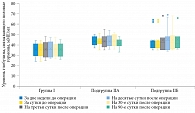
При анализе уровня глобулина, связывающего половые гормоны, статистически значимых изменений его концентрации за все время исследования выявлено не было (рис. 3).
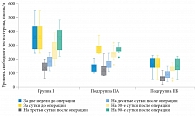
Динамика изменений уровня свободного тестостерона была сходна с таковой уровня общего тестостерона (рис. 4). Наиболее выраженное снижение произошло в раннем послеоперационном периоде с последующим постепенным восстановлением к 90-м суткам. Среднее значение свободного тестостерона до оперативного вмешательства в группе I составляло 351 [280; 420] пмоль/л. К третьим суткам после операции – 127 [120; 175] пмоль/л (снижение на 64%). К десятым суткам уровень свободного тестостерона начал восстанавливаться и повысился до 186 [150; 210] пмоль/л. В более позднем послеоперационном периоде также наблюдалась положительная динамика: к 30-м суткам уровень свободного тестостерона вырос до 285 [205; 320] пмоль/л, к 90-м суткам – до 366 [286; 391] пмоль/л. Таким образом, снижение уровня свободного тестостерона после хирургического вмешательства продолжалось до десятых суток. К 30-м суткам уровень свободного тестостерона нормализовался, а к 90-м суткам вернулся к дооперационным значениям, превысив их на 4%.
Среднее значение свободного тестостерона до оперативного вмешательства в подгруппе IIА составляло 150 [117; 160] пмоль/л. При контрольном обследовании за сутки до операции на фоне начатой ЗГТ уровень свободного тестостерона повысился на 73% до 260 [247; 292] пмоль/л. В ответ на хирургическое лечение уровень свободного тестостерона снизился на 58% к третьим суткам после операции до 110 [95; 137] пмоль/л. Уже к десятым суткам уровень свободного тестостерона начал восстанавливаться и составлял 150 [140; 172] пмоль/л. Далее концентрация свободного тестостерона продолжила нарастать, достигнув к 30-м суткам 240 [217; 250] пмоль/л, а к 90-м суткам – 261 [256; 282] пмоль/л. Таким образом, к 30-м суткам уровень свободного тестостерона нормализовался, а к 90-м суткам вернулся к дооперационным значениям, наблюдавшимся на фоне ЗГТ.
В подгруппе IIБ имел место изначальный дефицит свободного тестостерона, который до операции составлял 150 [142; 202] пмоль/л. В раннем послеоперационном периоде он снизился еще больше, опустившись к третьим суткам на 54% до 70 [47; 72] пмоль/л. С десятых суток уровень свободного тестостерона начал постепенно восстанавливаться, к этому моменту составляя 90 [70; 105] пмоль/л. К 30-м суткам уровень свободного тестостерона был близок к дооперационным значениям – 140 [120; 145] пмоль/л. К 90-м суткам он все еще был на 3% ниже, чем до операции – 146 [127; 195] пмоль/л. Нормализации уровня свободного тестостерона за все время наблюдения в данной подгруппе отмечено не было.
Во всех группах оценивалась частота послеоперационных осложнений. Острый эпидидимоорхит возник у одного (7%) пациента группы I, двух (18%) пациентов подгруппы IIА, четырех (36%) пациентов подгруппы IIБ, также у одного (9%) пациента этой подгруппы образовалась гематома. Таким образом, в группе I осложнения были зафиксированы в 7% случаев, в подгруппе IIА в 18% случаев, а в подгруппе IIБ в 45% случаев. Однако, несмотря на явные различия в процентном соотношении, полученные данные статистически не значимы, что, вероятно, объясняется небольшой выборкой.
При оценке качества жизни, эректильной функции и тревожно-депрессивного состояния до и после операции выявлено статистически значимое различие в подгруппе IIA. Так, сумма баллов по Опроснику возрастных симптомов андрогенного дефицита у мужчин до начала терапии и проведения оперативного вмешательства равнялась 33 [29; 36,5], а к 90-м суткам – 23 [21,5; 24] (р < 0,05) (табл. 1). Кроме того, пациенты, получавшие терапию препаратами тестостерона, отметили улучшение качества эректильной функции, что подтверждалось результатами опросника Международного индекса эректильной функции – 15 [14; 16,5] баллов до начала терапии и 22 [21; 23] после (р < 0,05) (табл. 2).
Данные, полученные при анкетировании по Госпитальной шкале тревоги и депрессии, свидетельствуют о достоверном улучшении психологического состояния пациентов подгруппы IIA (табл. 3). Уровень тревожности до операции составлял 9 [8,5; 9] баллов, а уровень депрессии – 8 [7; 9,5] баллов, после операции отмечено снижение до 3 [2,5; 3,5] и 3 [2; 4] баллов соответственно (р < 0,05).
В группе I и подгруппе IIБ статистически значимых изменений по Опроснику возрастных симптомов андрогенного дефицита у мужчин, Международному индексу эректильной функции и Госпитальной шкале тревоги и депрессии не выявлено.
Заключение
После операции Бергмана значительно снижается уровень тестостерона в крови. Такого рода хирургические вмешательства на фоне дефицита тестостерона негативно сказываются на клиническом течении раннего послеоперационного периода и общем состоянии больного, способствуют развитию осложнений. Предоперационная диагностика и коррекция дефицита тестостерона – важная составляющая, позволяющая минимизировать количество рисков и осложнений в результате хирургических вмешательств, а также улучшить качество жизни и ускорить послеоперационную реабилитацию пациентов.
E.A. Efremov, MD, PhD, Prof., S.Yu. Shekhovtsov, MD, PhD, A.O. Butov, Yu.V. Kastrikin, T.A. Edoyan
N.I. Pirogov Russian National Research Medical University, Moscow
N.A. Lopatkin Scientific Research Institute of Urology and Interventional Radiology – Branch of the National Medical Research Radiological Centre of the Ministry of Health of Russian Federation, Moscow
Contact person: Evgeny A. Efremov, konfandrology@rambler.ru
The results of the study, which evaluated the change in testosterone levels in patients with Bergman’s surgery, are presented. It is noted that operations on the background of testosterone deficiency negatively affect the clinical course of the early postoperative period and the patient general condition, contribute to the complication development. Preoperative diagnosis and correction of testosterone deficiency can minimize the number of risks and complications resulting from surgery, as well as improve the quality of life and accelerate the patients’ postoperative rehabilitation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.