Декскетопрофен в лечении острой боли в спине
- Аннотация
- Статья
- Ссылки
С клинической точки зрения для выбора и назначения терапии при болевом синдроме в спине сначала необходимо выявить источник болевой импульсации и провести дифференциальный диагноз с заболеваниями внутренних органов, онкологическим, травматическим, инфекционным и другими процессами. Успешность диагностики зависит от подробного рассмотрения анамнестических данных, жалоб, детального осмотра с использованием диагностических приемов, параклинических методов исследования.
Дегенеративно-дистрофическая перестройка структур позвоночника, чаще всего определяющая болевой синдром в спине, длительное время протекает бессимптомно. Обнаружение этих изменений на спондилограммах, особенно у лиц молодого и среднего возраста, не является безусловным доказательством вертеброгенной причины боли в спине и не должно определять лечебную тактику. Более того, вертеброгенная болевая импульсация может быть обусловлена другими заболеваниями позвоночника, не связанными с его дегенеративным поражением [1]. К «опасным» симптомам, которые могут свидетельствовать о наличии специфических заболеваний, «замаскированных» под вертеброгенную патологию, относятся:
- нетипичная картина болевого синдрома (отсутствие связи болей с движениями позвоночника; необычная локализация болей);
- наличие в анамнезе недавней травмы спины или злокачественного новообразования;
- лихорадка, симптомы интоксикации; симптомы нарушения функции тазовых органов или поражения спинного мозга либо корешков конского хвоста;
- признаки психического заболевания, при котором боли в спине могут быть проявлением соматоформного расстройства [2].
Более чем у 85% пациентов острая боль в спине имеет скелетно-мышечные причины. Предположительно, микротравматизация и растяжение мышцы при выполнении «неподготовленного движения» являются причиной боли у подавляющего большинства пациентов (> 70% случаев). «Дискогенная» боль и боль, связанная с дисфункцией дугоотростчатых (фасеточных) суставов, отмечается у 10% пациентов. На долю компрессионной радикулопатии пояснично-крестцовых корешков приходится около 4% случаев острой боли в спине. Компрессионные переломы тел позвонков, связанные с остеопорозом, обнаруживаются в 4% случаев, а спондилолистез – в 2% случаев [2].
Для типичной клинической картины скелетно-мышечной боли в поясничной (люмбалгия), шейной (цервикалгия) и грудной области (торакалгия) характерны боли, возникающие после неловкого движения, интенсивной физической или статической нагрузки. Боли обычно носят ноющий характер, усиливаются при движении с участием заинтересованных мышц и (или) отделов позвоночника, в определенных позах. При обследовании можно выявить анталгическую позу, степень ограничения подвижности из-за усиления болей, дефанс мышц спины, болезненность при пальпации мышц и/или области фасеточных суставов. Неврологическая симптоматика для такого вида болей в виде парезов, расстройств чувствительности и выпадения рефлексов не характерна. При радикулопатии боль чаще носит простреливающий характер. Помимо изменений, обнаруживаемых при скелетно-мышечных нарушениях, выявляют чувствительные, рефлекторные и, реже, двигательные нарушения в зоне пораженного корешка. Чаще поражаются нижние поясничные и первый крестцовый корешки, реже – нижние шейные и верхние поясничные корешки.
Для определения терапевтической тактики при боли в спине необходимо также знать источники болевой импульсации. Речь идет не об условиях ее возникновения, а о локализации морфологического субстрата болевых ощущений. При вертеброгенном дегенеративно-дистрофическом заболевании боль может исходить как из позвоночника, так и из других структур: суставов, связок, мышц, периферических нервов, нервных корешков, чувствительных и вегетативных ганглиев, спинного мозга. Независимо от источника болевого импульса, каскад патофизиологических и регуляторных процессов затрагивает всю ноцицептивную систему от тканевых рецепторов до корковых нейронов. Его можно представить в виде следующей схемы: раздражение ноцицепторов при повреждении тканей – выделение альгогенов и сенситизация ноцицепторов в области повреждения – усиление ноцицептивного афферентного потока с периферии – сенситизация нейронов на различных уровнях центральной нервной системы (ЦНС).
В связи с этим патогенетически обоснованным считается применение средств, направленных, во-первых, на ограничение поступления ноцицептивной импульсации из зоны повреждения в ЦНС (блокады местными анестетиками), во-вторых, на подавление синтеза медиаторов воспаления (нестероидные противовоспалительные средства, НПВС), в-третьих, на активацию структур антиноцицептивной системы, осуществляющей контроль проведения ноцицептивной импульсации в ЦНС. Для этого может быть использован целый спектр (в зависимости от клинической задачи) медикаментозных и немедикаментозных средств, снижающих болевую чувствительность и негативное эмоциональное переживание: наркотические и ненаркотические анальгетики, бензодиазепины, антиконвульсанты, антидепрессанты, агонисты альфа-2-адренорецепторов, чрескожная электронейростимуляция, рефлексотерапия, физиотерапия, психотерапия и др. [3, 4].
Кроме того, терапия вертеброгенной боли требует индивидуального и комплексного подхода с учетом фазы патологического процесса. При развитии острого болевого синдрома рекомендуется его быстрое купирование, поскольку правильное и адекватное лечение острой боли в первые дни рассматривается как профилактика ее хронизации. Итогом адекватного и своевременного выбора анальгезии является сокращение времени пребывания на больничном листе, более быстрое восстановление трудоспособности, сокращение частоты инвалидизации, профилактика формирования «болевой памяти» (N.A. Desbiens и соавт., 1997; класс доказательности B [5]; S.A. Schug и соавт., 1995; класс доказательности D [6]).
Препаратами первой линии в лечении острых болевых синдромов любой степени выраженности являются НПВС. После выделения из коры ивы салициловой кислоты в 1829 г. НПВС прочно заняли свое место в медикаментозной терапии различных заболеваний, проявляющихся болью или воспалением. Их широкому распространению также способствовало отсутствие целого ряда побочных эффектов, присущих опиатам: седации, угнетения дыхания и привыкания. Большинство этих препаратов считаются достаточно безопасными и продаются без рецептов. За последние 30 лет количество НВПС значительно возросло, и в настоящее время данная группа насчитывает большое число препаратов, отличающихся по химической структуре, особенностям действия и применения.
Наиболее важным механизмом действия НПВС является способность ингибировать циклооксигеназу (ЦОГ) – фермент, катализирующий превращение свободных полиненасыщенных жирных кислот в простагландины (ПГ), а также другие эйкозаноиды – тромбоксаны (прежде всего тромбоксан A2 (ТрА2)) и простациклин (ПГ-I2). Доказано, что ПГ обладают многосторонней биологической активностью: являются медиаторами воспалительной реакции; сенсибилизируют рецепторы к медиаторам боли (гистамину, брадикинину) и механическим воздействиям, понижая порог чувствительности; повышают чувствительность гипоталамических центров терморегуляции к действию эндогенных пирогенов (интерлейкина-1 и др.), играют важную физиологическую роль в защите слизистой оболочки желудочно-кишечного тракта; влияют на функцию почек. Основным негативным свойством всех НПВС, связанным с угнетением синтеза ПГ и эйкозаноидов, является высокий риск развития нежелательных реакций со стороны желудочно-кишечного тракта, почек, печени, сосудов, бронхолегочной системы.
Сравнение селективной анальгезирующей активности по отношению к степени подавления синтеза простагландинов вообще показало, что некоторые НПВС с сильными анальгетическими свойствами являются слабыми ингибиторами синтеза простагландинов, и наоборот, другие НПВС, способные активно ингибировать синтез простагландинов, обладают слабыми анальгезирующими свойствами. Таким образом, имеет место диссоциация между анальгезирующей и противовоспалительной активностью НПВС. Этот феномен объясняется тем, что анальгетическое действие некоторых НПВС связано не только с подавлением центральных и периферических простагландинов, но и с влиянием на синтез и активность других нейроактивных веществ, играющих ключевую роль в восприятии болевого раздражения в ЦНС.
Механизм анальгетического действия складывается из нескольких компонентов, каждый из которых может иметь самостоятельное значение. Некоторые ПГ (Е2 и F2альфа) могут повышать чувствительность болевых рецепторов к физическим и химическим стимуляторам, например, к действию брадикинина, который, в свою очередь, способствует высвобождению ПГ из тканей. Таким образом, происходит взаимное усиление альгогенного действия. НПВС, блокируя синтез ПГ-Е2 и ПГ-F2aльфа, в сочетании с прямым антибрадикининовым действием препятствуют проявлению альгогенного эффекта.
Хотя НПВС непосредственно на болевые рецепторы не действуют, но, блокируя экссудацию, стабилизируя мембраны лизосом, они опосредованно снижают число чувствительных к химическим раздражителям рецепторов. Определенное значение придается влиянию этой группы препаратов на таламические центры болевой чувствительности (локальная блокировка ПГ-Е2, -F2aльфа в ЦНС), которое приводит к торможению проведения болевых импульсов к коре. Хорошо изучено центральное противоболевое действие кетопрофена, которое обусловлено его следующими свойствами: быстрым проникновением через гематоэнцефалический барьер благодаря исключительной жирорастворимости; центральным воздействием на уровне задних столбов спинного мозга путем ингибирования деполяризации нейронов задних столбов; селективной блокадой рецепторов N-метил-D-аспартата (NMDA) путем подавления деполяризации ионных каналов, оказывая, таким образом, прямое и быстрое действие на трансмиссию боли. Этот механизм обусловлен:
- стимуляцией под действием кетопрофена активности печеночного фермента триптофан-2,3-диоксигеназы, что непосредственным образом отражается на образовании кинуреновой кислоты – антагониста NMDA-рецепторов ЦНС;
- воздействием кетопрофена на гетеротримерный G-белок, приводящим к изменению конфигурации его альфа-подъединицы.
G-белок, находящийся в постсинаптической нейронной мембране, связывается с различными рецепторами, такими как нейрокинины (NK1, NK2, NK3), и рецепторами глутамата, облегчающими прохождение афферентных болевых сигналов через мембрану; обладает способностью контролировать уровень некоторых нейротрансмиттеров, таких как серотонин (через влияние на G-белок и предшественник серотонина 5-гидрокситриптамин), уменьшать выработку субстанции Р [7]. В клинической практике кетопрофен применяют более 30 лет, а его эффективность была неоднократно доказана при различных болевых синдромах. Кетопрофен представляет собой рацемическую смесь двух стереоизомеров. Активным в отношении основного (антиноцицептивного) эффекта является только один, в то время как другой обладает слабо выраженными основными эффектами, но значительно повышает частоту развития побочных эффектов. Было установлено, что только S(+)-изомер (правовращающий) ингибирует ЦОГ [8]. В организме кетопрофен подвергается непрямому превращению из неактивного R- в активный S-изомер. У человека примерно 10% R(-)-кетопрофена конвертируется в S(+)-изомер, хотя эта величина значительно варьирует. Для обеспечения высокой терапевтической эффективности и безопасности из рацемической смеси был выделен S(+)-изомер, который в виде водорастворимой соли (трометамоловой) является действующим веществом препарата Дексалгин®.
Декскетопрофена трометамол представляет собой НПВС с выраженным и быстрым болеутоляющим действием. Трометамоловая соль декскетопрофена имеет улучшенные физико-химические свойства, степень очистки от R(-)-кетопрофена составляет 99,9%. Результаты фармакокинетических исследований свидетельствуют о том, что декскетопрофена трометамол быстро и полностью всасывается после приема внутрь, а максимальная концентрация в плазме крови достигается быстрее, чем при приеме кетопрофена, – за 15–45 мин. До 70–80% препарата выводится с мочой в течение первых 12 ч в основном в виде конъюгата с глюкуроновой кислотой. Отсутствие в моче после приема декскетопрофена R(-)-изомера свидетельствует об отсутствии у человека биоинверсии S(+)-изомера. Основными побочными действиями, характерными для препарата Дексалгин®, как и для других НПВС, часто (1–10% случаев) являются диспепсические явления, редко (0,01–0,1%) – эрозивно-язвенное поражение желудочно-кишечного тракта, очень редко (менее 0,01%) – аллергические реакции и бронхоспазм, нарушение функции почек, повышение артериального давления. Иногда (в 0,1–1% случаев) возможны озноб, отеки конечностей, фотосенсибилизация. В клинической практике применения данного препарата не зарегистрировано синдрома привыкания. Снижение терапевтической дозы приводит к уменьшению риска возникновения побочных эффектов.
Кроме скорости обезболивающего эффекта и хорошей переносимости, преимуществом препарата Дексалгин® является наличие двух форм выпуска: раствора для инъекций и таблеток, что значительно расширяет возможности анальгетической терапии. Дексалгин® раствор для инъекций универсален в плане путей и способов введения препарата: его можно вводить как внутримышечно, внутривенно болюсно (струйно), так и внутривенно капельно, что выгодно отличает его от многих других анальгетиков группы НПВС. Рекомендуемая инъекционная доза для взрослых: 50 мг каждые 8–12 ч. При необходимости возможно повторное введение препарата с 6-часовым интервалом. Суточная доза составляет 150 мг.
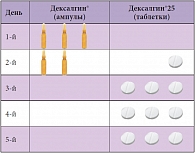
У пациентов пожилого возраста и пациентов с нарушением функции печени и/или почек терапию препаратом Дексалгин® следует начинать с более низкой дозы (50 мг/сут). Инъекционная форма предназначена для краткосрочного (не более 2 дней) применения в период острого болевого синдрома. В дальнейшем возможен перевод пациента на прием анальгетиков перорально. Таблетированная форма препарата Дексалгин® содержит 25 мг декскетопрофена трометамола и начинает действовать при пероральном приеме в течение 30 минут. Эффект продолжается 3–6 часов. Сmax при пероральном приеме наблюдается через 30 мин (в среднем – 15–60 мин). Максимальная суточная доза не должна превышать 75 мг. Длительность лечения препаратом, независимо от способа приема, составляет 5 дней (табл.).
Изучение особенностей фармацевтического взаимодействия инъекционной формы препарата Дексалгин® выявило, что его нельзя смешивать в одном шприце с растворами допамина, прометазина, пентазоцина, петидина или гидроксизина (образуется осадок). Однако Дексалгин® можно смешивать в одном шприце с раствором гепарина, морфина, теофиллина и лидокаина. Смешивание с последним актуально при использовании препарата для введения в триггерные точки при миофасциальном синдроме [9]. Дексалгин® противопоказан для эпидурального, подоболочечного или внутриоболочечного введения из-за входящего в состав препарата этанола. При внутримышечных инъекциях содержимое одной ампулы (2 мл) медленно вводят глубоко в/м, при внутривенной инъекции препарат вводят медленно, в течение не менее 15 сек.
Для инфузий содержимое одной ампулы (2 мл) препарата Дексалгин® разводят в 30–100 мл физиологического раствора, раствора глюкозы или раствора Рингера (лактата). Раствор следует готовить в асептических условиях и всегда защищать от воздействия дневного света. Разбавленный раствор (должен быть прозрачным) вводят путем медленной в/в инфузии продолжительностью 10–30 мин. Известно достаточное количество исследований, показавших превосходство в эффективности декскетопрофена в сравнении с другими известными анальгезирующими средствами. В обзоре Оксфордского центра по изучению боли проанализировано 35 исследований по использованию декскетопрофена в лечении острой и хронической боли, проведенных к 2008 г. [10]. Общее число пациентов с острой и хронической болью в этих исследованиях составило 6380 человек, из них 3381 пациент получал декскетопрофен. В 29 из 30 активных испытаний анальгезирующая эффективность декскетопрофена была эквивалентна эффективности наркотических анальгетиков, использующихся для сравнения.
Изучение возможностей декскетопрофена трометамола в лечении острых болей в спине показало, по данным как зарубежных, так и отечественных авторов, сопоставимость эффекта или его преимущества перед другими НПВС и трамадолом [9–15]. Так, в многоцентровом двойном слепом контролируемом исследовании, включавшем 370 пациентов, сравнивали анальгетический эффект внутримышечного введения 50 мг 2 р/сут декскетопрофена или 75 мг 2 р/сут диклофенака при острой боли в спине. Степень уменьшения боли составила 39% при приеме декскетопрофена и 33% – диклофенака; значимых симптомов непереносимости не отмечено в обеих группах [9].
В многоцентровом рандомизированном двойном слепом клиническом исследовании сравнивали анальгезирующую эффективность препарата Дексалгин® и трамадола у 192 пациентов с острыми болями в спине. Исходная оценка боли в покое и при движении у данных пациентов была не менее 50 мм по 100-миллиметровой визуальной аналоговой шкале. Пациенты первой группы (n = 95) принимали трамадол в суточной дозе 150 мг (50 мг 3 р/сут), пациенты второй группы (n = 97) принимали Дексалгин® по 25 мг 3 р/сут (суточная доза 75 мг). Пациентам было разрешено принимать парацетамол в дозе 500 мг до 4 раз в день в качестве дополнительного обезболивания. Результаты исследования показали, что на 4-й день лечения боль при движении значительно снизилась во второй группе пациентов, принимавших Дексалгин®, по сравнению с группой трамадола (р = 0,044). Различия в степени уменьшения ночных болей составили 22,9% также в пользу декскетопрофена трометамола (р = 0,044). В группе декскетопрофена необходимость в дополнительном приеме парацетамола чаще всего возникала в 1-й день лечения, в то время как пациентам первой группы, принимавшим трамадол, дополнительное лечение парацетамолом требовалось, как правило, в течение первых 3 дней (достоверность различий р = 0,011). При этом количество побочных эффектов у пациентов, принимавших Дексалгин®, было значительно меньше, чем при приеме трамадола (р = 0,026) [15].
Изучение влияния препарата Дексалгин® на механизмы дизрегуляции в комплексной терапии дорсалгии проведено в открытом контролируемом исследовании, включавшем 43 больных. Результаты исследования выявили высокую эффективность терапевтического влияния препарата на механизмы дизрегуляции в лечении обострения синдрома боли в спине различной этиологии [11]. Изучение анальгезирующей эффективности и переносимости комплексного лечения больных с вертеброгенными болевыми синдромами препаратами Дексалгин® и Нимесил® проведено в открытом контролируемом исследовании, включавшем 60 человек. Результаты исследования показали достаточно высокую анальгезирующую эффективность препарата Дексалгин® в суточной дозе 75 мг при использовании его в виде короткого (5 дней) курса терапии в комплексном лечении острых вертеброгенных болевых синдромов шейной и пояснично-крестцовой локализации с корешковыми и скелетно-мышечными расстройствами. Был отмечен быстрый анальгезирующий эффект таблетированной формы препарата, сопоставимый с эффектом от внутримышечных инъекций других обезболивающих средств, что позволило авторам рекомендовать его применение в амбулаторной практике в качестве альтернативы инъекционным формам НПВС [16].
Исследование эффективности препарата Дексалгин® проводили в открытом сравнительном исследовании у 30 пациентов со скелетно-мышечными болевыми синдромами, обусловленными мышечно-тоническим синдромом мышцы, выпрямляющей позвоночник, миофасциальным синдромом ишиокруральной мускулатуры, дисфункцией дугоотростчатых и крестцово-подвздошных сочленений с длительностью заболевания не более 3 недель и интенсивностью боли по 10-балльной визуальной аналоговой шкале не менее 5 баллов. Результаты исследования продемонстрировали, что декскетопрофена трометамол может эффективно применяться в виде короткого курса монотерапии для лечения острых болевых синдромов пояснично-крестцовой локализации в первые недели заболевания, а также в комплексном лечении затянувшегося обострения в сочетании с медикаментозными и немедикаментозными воздействиями, направленными на устранение выявленного источника боли в спине [2].
Таким образом, выбор клиницистами препарата Дексалгин® из большого арсенала средств для купирования острого болевого синдрома при дорсопатии может быть обусловлен быстрым и выраженным развитием анальгезирующего эффекта декскетопрофена трометамола при краткосрочном применении (до 5 дней) без дополнительных видов лечения на начальном этапе заболевания. При этом принятие решения о выборе НПВС для лечения острой боли при дорсопатии должно основываться на соотношении потенциальных пользы и рисков анальгезии для конкретного пациента. В клинической практике остается сложным выбор медикаментозных методов лечения у пациентов пожилого возраста. Реже рекомендуемая, хотя и достаточная эффективная, группа НПВС имеет ограниченное применение из-за риска желудочно-кишечных осложнений. При этом независимо от степени селективности ингибирования ЦОГ-1 и ЦОГ-2 и соотношения «риск/польза» рекомендуются НПВС с коротким периодом полувыведения [4].
Быстрое всасывание, короткий период полувыведения, доказанный благоприятный профиль безопасности и переносимости препарата Дексалгин® обосновывают его широкое клиническое применение во всех возрастных группах для лечения острых болей, терапии хронических болевых синдромов в период обострения, а также в комплексном лечении дегенеративно-дистрофических заболеваний позвоночника.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.