Управление хронической скелетно-мышечной болью: как выбрать правильную терапию
- Аннотация
- Статья
- Ссылки
- English
Хроническая скелетно-мышечная боль: этиология и патогенез
Боль представляет собой один из важнейших симптомов различных заболеваний, который, с одной стороны, в значительной степени формирует картину болезни, а с другой – часто является первым ее проявлением.
Наиболее распространенное определение боли представлено в российских клинических рекомендациях «Хроническая боль у пациентов пожилого и старческого возраста» [1]: боль – неприятное ощущение и эмоциональное переживание, возникающее в связи с настоящей или потенциальной угрозой повреждения тканей или изображаемой терминами такого повреждения.
Существуют и другие определения боли. Так, боль описывается как мучительное переживание, связанное с фактическим или потенциальным повреждением тканей с сенсорными, эмоциональными, когнитивными и социальными компонентами [2]. В любом случае подчеркиваются два основных момента: связь боли с повреждением и выраженная психоэмоциональная окраска симптома. Очень ярко данные характеристики проявляются в случае скелетно-мышечной боли (СМБ), которая часто приобретает хронический характер.
Хроническая СМБ (хСМБ) признана основным проявлением заболеваний опорно-двигательного аппарата и одним из наиболее распространенных вариантов болевого синдрома, поражающим миллионы людей во всем мире, включая Российскую Федерацию [3]. Наиболее частыми причинами хСМБ выступают две группы патологических состояний:
- заболевания суставов, в первую очередь остеоартрит (ОА), ревматоидный артрит (РА) и другие ревматические заболевания [4];
- широкий спектр нарушений состояния костных и мышечно-связочных структур позвоночника, сопровождающихся хронической болью в спине, таких как различные поражения межпозвонковых дисков, деформация позвоночника, спондилез и другие дегенеративно-дистрофические, а также иммуновоспалительные заболевания (спондилоартриты) [5].
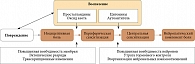
Хроническая СМБ преимущественно развивается по ноцицептивному типу, то есть возникает вследствие возбуждения периферических болевых рецепторов при повреждении/воспалении пораженной ткани. Однако у значительного числа пациентов она носит нейропатический характер вследствие поражения соматосенсорной нервной системы [4]. Ноцицептивный и нейропатический типы хСМБ тесно связаны между собой, что в значительной степени обусловлено вовлечением воспалительных механизмов в формирование болевого синдрома независимо от его причины [6]. При развитии скелетно-мышечной боли первично возникает возбуждение ноцицепторов (болевых рецепторов), которые активируются медиаторами воспаления (простагландинами, брадикинином, гистамином, аденозинтрифосфатом, нейротрофинами). Выбрасываемые при повреждении тканей провоспалительные цитокины, такие как фактор некроза опухоли α, интерлейкины 1 и 6, фактор роста нервов β, сенсибилизируют периферические нервы. При аутоиммунном процессе, например при РА, может наблюдаться вовлечение аутоантител в процесс возбуждения ноцицепторов [7]. При повреждении и воспалении также происходит выброс свободных радикалов, в первую очередь оксида азота, что способствует возникновению и поддержанию боли. В результате первично-воспалительного процесса при таких ревматических заболеваниях, как РА и спондилоартриты, развивается периферическая и центральная сенситизация со снижением порога возбудимости нейронов болевой системы (рисунок) [5, 6].
Очевидно, что для эффективного контроля хСМБ в первую очередь необходимо воздействовать на ноцицептивный компонент болевого синдрома, однако в целом ряде случаев, как при поражении позвоночника, так и при заболеваниях суставов, имеет место сочетание ноцицептивной и нейропатической боли.
В зависимости от преобладания тех или иных патогенетических процессов, приводящих к формированию боли, выделяют следующие фенотипы СМБ [3]:
- воспалительный – с местной воспалительной реакцией и активацией иммунных клеток, повышенным синтезом провоспалительных цитокинов и других медиаторов воспаления;
- механический – с нарушением биомеханики, персистирующим вторичным воспалением, дегенеративными процессами, сенситизацией периферических механорецепторов;
- энтезопатический – с поражением энтезисов и других структур связочного аппарата, что сопровождается ангиофибропластической трансформацией ткани сухожилий, локальным воспалением, гиперчувствительностью ноцицепторов в области энтезиса;
СМБ на фоне центральной сенситизации, в основе которой лежит длительная активация соматосенсорной системы, реакция микроглии, асептическое нейрональное воспаление, нейропластические процессы, повышающие чувствительность нейронов болевой системы.
При каждом из этих фенотипов ту или иную роль, зачастую ведущую, играет воспаление, являющееся универсальным триггером хСМБ. Даже при типичной нейропатической боли воспалительные механизмы активно включены в патогенез, что подчеркивается, в частности, значением в ее развитии гиперпродукции провоспалительных цитокинов, таких как фактор некроза опухоли α [8].
Нестероидные противовоспалительные препараты
Основным классом препаратов, применяемых при хСМБ, являются нестероидные противовоспалительные препараты (НПВП). Как известно, основные фармакологические эффекты НПВП связаны с подавлением активности циклооксигеназы 2 (ЦОГ-2), ответственной за выработку важного класса медиаторов воспаления – простагландинов. К ЦОГ-2-зависимым процессам относятся появление и усиление боли вследствие любого повреждения ткани, развитие хронического болевого синдрома, местная и системная воспалительные реакции, локальная и системная гипертермии, катаболические процессы, неоангиогенез и т.д. Именно подавление выработки ЦОГ-2 приводит к развитию лечебного эффекта НПВП. С выбросом провоспалительных субстанций, прежде всего простагландина Е2, связывают способность НПВП влиять на центральные механизмы передачи болевого импульса [9]. Несмотря на то что НПВП в первую очередь подавляют боль, возникающую по ноцицептивному механизму, и не относятся к специфическим препаратам, рекомендованным при нейропатической боли [10, 11], они нередко применяются при типично нейропатических болевых синдромах, таких как корешковый синдром и спинальная миелопатия, хотя уровень доказательности такого подхода низкий [12, 13]. Таким образом, НПВП обладают значительным потенциалом в контроле хСМБ разного происхождения.
При спондилоартритах и РА, при которых основной причиной боли является первичный активный воспалительный процесс (синовит, энтезит), НПВП занимают первое место среди препаратов первой линии терапии [4, 5]. В клинических рекомендациях Международного общества по изучению спондилоартритов и Европейской антиревматической лиги 2022 г. по ведению больных аксиальным спондилоартритом указывается, что пациенты с данной патологией, страдающие от боли и скованности, должны использовать НПВП в качестве медикаментозного лечения первой линии в дозе вплоть до максимальной (естественно, с учетом рисков), при этом непрерывное использование их предпочтительнее курсового или приема по требованию [14].
В международных и национальных клинических рекомендациях по ведению больных ОА системное назначение НПВП, как правило, является второй линией терапии болевого синдрома после анальгетиков, в первую очередь парацетамола, и топических форм НПВП. Однако реальная эффективность парацетамола и даже трамадола при ОА оказывается недостаточно высокой, а риск развития непереносимости, особенно при длительном применении, – вполне реальным [15]. Топические формы НПВП имеют хорошие параметры безопасности, однако их эффективность невелика при ОА крупных суставов (гонартрозе и коксартрозе). Как следствие, у значительной части пациентов с ОА при выраженном болевом синдроме системное применение НПВП начинается сразу после установления диагноза [16, 17], а иногда и до этого (в плане самолечения). В клинических рекомендациях Минздрава России «Коксартроз» указано, что пациентам с коксартрозом при умеренном и выраженном болевом синдроме назначают НПВП с учетом коморбидности, причем непрерывное их использование обеспечивает лучший контроль симптомов, чем прием в режиме по требованию [18].
Механическая боль в области позвоночника – симптом, сопровождающий широкий спектр патологий, – включает боль в нижней части спины (БНЧС) и болевые синдромы, связанные с поражением шейного отдела позвоночника. Она возникает из-за патологии разных отделов позвоночника (спондилеза, спондилолистеза, спондилолиза, компрессионных переломов позвонков, острой или хронической травмы), межпозвонковых дисков или окружающих мягких тканей [19]. В качестве этиологического фактора болевого синдрома нередко выступает ОА суставов позвоночника (спондилоартроз) [5, 20]. Выделяют также неспецифическую боль в спине. Этот термин часто используется в тех случаях, когда не выявляется серьезная патология как причина боли [21]. В российской клинической практике в отличие от общемировой практики для заболеваний, сопровождающихся болью в позвоночнике, до сих пор используется термин «остеохондроз». Фактически это не нозологический диагноз, а собирательное понятие для разных дегенеративно-дистрофических заболеваний, а также их проявлений, таких как миелопатия и радикулопатия. Использование термина «остеохондроз позвоночника» в таком смысле противоречит Международной классификации болезней 10-го и 11-го пересмотров. Кроме того, это зачастую затрудняет истинно нозологическую диагностику причин боли в спине [5]. С нашей точки зрения, в случае хСМБ при невозможности установить точный диагноз конкретного поражения суставов, дисков и других структур, связанных с позвоночником, корректно использовать термин «неспецифическая боль в спине» или «неспецифическая БНЧС», как это отражено в клинических рекомендациях Минздрава России «Скелетно-мышечные (неспецифические) боли в нижней части спины» [22]. При всех вариантах хСМБ в области позвоночника, включая неспецифическую БНЧС, НПВП играют важную роль в лечении и часто назначаются в качестве препаратов первой линии [5, 19–22].
В целом НПВП сохраняют позицию первой линии медикаментозной терапии при хСМБ вне зависимости от конкретной нозологии.
Нестероидные противовоспалительные препараты представляют химически достаточно разнородную группу лекарственных средств, объединенную общим механизмом действия. В консенсусе российских экспертов 2024 г. суммированы основные современные рекомендации по рациональному использованию НПВП. Наиболее важные, с нашей точки зрения, позиции в отношении их эффективности при хСМБ следующие [11]:
анальгетический потенциал НПВП выше, чем у парацетамола, даже при использовании последнего в максимальных суточных дозах. При хСМБ по анальгетическому эффекту НПВП не уступают мягким опиоидным препаратам, таким как трамадол и кодеин;
НПВП являются основным средством контроля хСМБ при ОА, одним из основных классов препаратов при таких состояниях, как острый подагрический артрит, БНЧС. При спондилоартритах, в частности анкилозирующем спондилите, длительное применение НПВП может замедлить прогрессирование поражения, поэтому должно рассматриваться как патогенетическая терапия;
при использовании НПВП в средних и максимальных терапевтических дозах анальгетическое и противовоспалительное действие разных препаратов данной фармакологической группы примерно одинаково и в значительной степени зависит от дозы, назначение более высоких доз НПВП позволяет добиться лучших результатов;
существенного различия в анальгетическом действии разных лекарственных форм НПВП не отмечено, кроме острой интенсивной боли (при травмах, после хирургических вмешательств и т.д.), при которой НПВП для парентерального введения (внутривенно и внутримышечно), а также быстрорастворимые формы НПВП для приема внутрь (саше) могут иметь преимущество в отношении скорости наступления обезболивания по сравнению с приемом стандартных препаратов перорально;
выраженность действия НПВП может нарастать в течение первых дней применения, поэтому их эффективность при хСМБ следует оценивать не ранее чем через 7–14 дней от начала лечения. Эффект НПВП может сохраняться при длительном (многомесячном) применении;
выбор НПВП в первую очередь основывается на соображениях безопасности у конкретного пациента. Основным методом профилактики развития НПВП-ассоциированных осложнений считается выявление факторов риска, их коррекция (по возможности) и назначение НПВП с более благоприятным профилем безопасности в отношении желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы.
Известно, что профиль желудочно-кишечной безопасности НПВП в значительной степени связан с ингибированием другой изоформы циклооксигеназы – ЦОГ-1, которая играет важную роль в поддержании многих параметров гомеостаза, в том числе защитного потенциала слизистой оболочки ЖКТ. С подавлением ЦОГ-1 связывают такие нежелательные реакции, как эрозивно-язвенное поражение верхних отделов ЖКТ и желудочно-кишечные кровотечения. При наличии умеренного или высокого риска развития желудочно-кишечных осложнений (язвенный анамнез, прием антикоагулянтов, курение, инфекция, вызванная Helicobacter pylori, и др.) определенные преимущества имеют селективные ингибиторы ЦОГ-2 – препараты из группы коксибов (целекоксиб и эторикоксиб), при необходимости их сочетают с ингибиторами протонной помпы [4, 9, 11].
Осложнения со стороны сердечно-сосудистой системы на фоне приема НПВП в настоящее время рассматриваются как ведущая проблема безопасности лечения. Результаты исследований убедительно демонстрируют, что частота возникновения серьезных сердечно-сосудистых нежелательных явлений не только не уступала, но и превышала аналогичный показатель для НПВП-гастропатии [15]. Ухудшение течения имеющейся сердечно-сосудистой патологии, реже – ее развитие de novo являются класс-специфическими нежелательными реакциями на фоне терапии НПВП, что повышает риск сердечно-сосудистых катастроф (инфаркта миокарда, инсульта и внезапной коронарной смерти) [11]. В значительной степени развитие нежелательных реакций со стороны сердечно-сосудистой системы связано с механизмом действия НПВП. К ЦОГ-1-зависимым процессам относят агрегацию тромбоцитов, поэтому ингибирование этого изофермента ацетилсалициловой кислотой используется для профилактики тромбозов. Подобным эффектом обладают и другие НПВП – неселективные ингибиторы ЦОГ, поэтому их действие на ЦОГ-1 может рассматриваться как позитивный фактор для обеспечения сердечно-сосудистой безопасности. Подавление активности ЦОГ-2 может приводить к дисбалансу синтеза тромбоксана А2 и простациклина, что повышает вероятность возникновения сосудистых тромбов. Способность НПВП увеличивать артериальное давление также связывают с блокадой ЦОГ-2 и снижением синтеза простагландина Е2 и простациклина в стенке сосудов [9, 11].
Сердечно-сосудистая безопасность НПВП выходит на первое место при их назначении такому большому контингенту, как больные ОА. Большую часть из них составляют лица пожилого возраста, которые отличаются выраженной мультиморбидностью, включая сердечно-сосудистую патологию. Они заведомо находятся в группе риска развития сердечно-сосудистых нежелательных реакций, в связи с чем при назначении им НПВП в первую очередь необходимо учитывать возможность минимизации именно таких рисков [9, 23].
В качестве препаратов с более высоким профилем сердечно-сосудистой безопасности среди неселективных ингибиторов ЦОГ чаще фигурирует напроксен, среди селективных ЦОГ-2-ингибиторов – целекоксиб [11]. Однако другие препараты также обладают благоприятным соотношением эффективности и переносимости и во многих случаях являются оптимальным выбором. К таким НПВП относится флурбипрофен1, который введен в клиническую практику уже достаточно давно – в 1970–80-х гг., а в настоящее время переживает возрождение интереса к нему.
Флурбипрофен
Флурбипрофен представляет собой производное фенилпропионовой кислоты. К этой группе относятся также ибупрофен и кетопрофен. Молекула флурбипрофена отличается наличием атома фтора. Фторирование широко применяется в фармацевтике в связи с повышением метаболической стабильности получаемых соединений.
Флурбипрофен является мощным неселективным ингибитором ЦОГ-1 и ЦОГ-2 с выраженной анальгетической и противовоспалительной активностью. Согласно экспериментальным данным, у мышей на модели воспаления флурбипрофен подавлял проницаемость капилляров в 7,8 раза сильнее ибупрофена, в 61 раз сильнее ацетилсалициловой кислоты, в 5,7 раза сильнее индометацина и в 25 раз сильнее фенилбутазона. В отношении ингибирования каррагенинового отека активность флурбипрофена была в 52 раза выше, чем у ибупрофена, в 250 раз выше, чем у ацетилсалициловой кислоты, в 14 раз выше, чем у индометацина, и в 110 раз выше, чем у фенилбутазона [24].
Основным способом введения флурбипрофена является пероральный, хотя существуют и другие способы введения, обусловленные другой лекарственной формой.
В настоящем обзоре будет рассмотрено применение флурбипрофена per os.
После приема внутрь флурбипрофен хорошо и полностью всасывается из пищеварительного тракта и достигает максимальной концентрации в плазме (в среднем 15 мкг/мл) через один-два часа. Прием пищи не влияет на биодоступность препарата. Период его полувыведения в среднем составляет шесть часов. Связь с белками плазмы – более 99%.
Флурбипрофен проходит активную биотрансформацию в печени и почти полностью метаболизируется.
Выводится в основном почками, при этом 80% в виде глюкуронидов и сульфатированных конъюгатов, 20% в неизменном виде [25, 26].
Обезболивающий эффект
Сильный обезболивающий эффект флурбипрофена был многократно продемонстрирован в ранних клинических исследованиях. При послеоперационных болях анальгетическое действие флурбипрофена в дозе 50–100 мг per os было сопоставимо с таковым комбинации парацетамола в дозе 650 мг и кодеина в дозе 60 мг per os, 10 мг морфина внутримышечно, а по длительности лечебного эффекта превосходило эти препараты [27–29]. Метаанализ применения флурбипрофена у данной категории пациентов показал, что после однократного приема в дозе 50–100 мг у 65–70% наблюдалось по крайней мере 50%-ное облегчение боли по сравнению с 25–30%-ным на фоне плацебо [30].
Относительно недавний (2019 г.) метаанализ 32 исследований по периоперационному применению разных НПВП продемонстрировал, что применение флурбипрофена в качестве анальгетика снижало потребность в опиоидах на 50%, что выше среднего значения для большинства других НПВП (7–50% для диклофенака, 9–66% для кеторолака, 22–46% для ибупрофена, 34–66% для кетопрофена, 36–50% для декскетопрофена, 38–41% для теноксикама, 36–54% для лорноксикама) [31]. Для мелоксикама опиоид-сберегающий эффект не доказан [31].
Хороший клинический ответ на флурбипрофен отмечен при боли в спине различного происхождения. В ранних исследованиях при анкилозирующем спондилите флурбипрофен в дозе 150–200 мг/сут по эффективности был сопоставим с индометацином в дозе 75–100 мг/сут и фенилбутазоном в дозе 300 мг/сут [32–34]. При этом эндоскопический контроль слизистой ЖКТ показал лучшую переносимость флурбипрофена в дозе до 300 мг/сут по сравнению с переносимостью ацетилсалициловой кислоты в дозе 2100 мг/сут [33]. Хороший терапевтический эффект флурбипрофена был отмечен и при неспецифической боли в спине [35, 36], при острой БНЧС различного происхождения (спондилоартрозе, дегенеративно-дистрофических поражениях межпозвонковых дисков и крестцово-подвздошного сочленения) [37]. При этой патологии также отмечалась хорошая переносимость препарата [37, 38].
При ревматоидном артрите флурбипрофен в дозе 200 мг/сут по клинической эффективности соответствовал индометацину в дозе 100 мг/сут, при этом статистически значимое снижение скорости оседания эритроцитов наблюдалось только на фоне флурбипрофена [39]. Кроме того, для проведения лечения пациенты отдавали предпочтение именно флурбипрофену [39]. Сопоставимость клинического эффекта флурбипрофена в дозе 150–200 мг/сут и индометацина в дозе 75–150 мг/сут была доказана при длительном (≥ 6 месяцев) их применении [40]. При сравнении с напроксеном, получаемым в дозе 500 мг/сут, в шестинедельном двойном слепом рандомизированном клиническом исследовании (РКИ) с открытой продленной фазой флурбипрофен, применяемый в дозе 200 мг/сут, оказался несколько эффективнее по оценке врача и пациента, а также эффективнее в отношении припухлости проксимальных межфаланговых суставов при сопоставимых показателях переносимости [41]. Аналогичные результаты получены еще в одном РКИ, в котором у пациентов с РА сравнивался эффект 200 мг флурбипрофена и 750 мг напроксена, принимаемых один раз в день [42]. Исследователи отметили хорошую переносимость препарата по сравнению с переносимостью индометацина и напроксена [43]. В другом РКИ при лечении РА флурбипрофен в дозе 200 мг/сут был так же эффективен, как кетопрофен в дозе 200 мг/сут, при сопоставимом профиле безопасности обоих препаратов [44]. Систематический обзор 14 РКИ флурбипрофена при РА (суммарно 1103 пациенто-лет наблюдения) показал, что данный препарат превосходил плацебо по всем клиническим показателям (боль, скованность и припухлость в суставах). В сравнительных исследованиях флурбипрофена с другими НПВП (средняя суточная доза флурбипрофена составляла 200 мг, аспирина – 4000 мг, индометацина – 150 мг, напроксена – 750 мг, ибупрофена – 1800 мг) продемонстрировано преимущество флурбипрофена перед индометацином и напроксеном по формальным симптоматическим показателям, по оценке врачей и пациентов, а также по безопасности и особенно переносимости со стороны ЖКТ перед аспирином и индометацином [45].
При остеоартрите также было проведено значительное количество РКИ, сравнивавших флурбипрофен с другими НПВП. У 195 пациентов с ОА периферических суставов флурбипрофен даже в низкой дозе (80 мг/сут) улучшал показатели боли, субъективную оценку состояния и результаты выполнения функциональных тестов, при этом по эффективности он не уступал ибупрофену в достаточно высокой дозе (1600 мг/сут) [46]. При гонартрозе флурбипрофен в дозе 100–200 мг/сут оказался значительно эффективнее аспирина в дозе 2000–4000 мг/сут по большинству показателей [47]. При сравнении эффекта флурбипрофена в дозе 200 мг/сут и пироксикама в дозе 20 мг/сут при ОА коленного сустава оба препарата оказались эффективными, однако флурбипрофен значимо сильнее уменьшал показатель боли в покое, а также значительно реже вызывал развитие нежелательных явлений – 6 против 47% [48]. Доказана эквивалентность эффективности и переносимости флурбипрофена в дозе 100 мг/сут и сулиндака в дозе 300 мг/сут [49]. В РКИ, в которых сравнивался эффект флурбипрофена в дозе 100–200 мг/сут и диклофенака в дозе 75–150 мг/сут при ОА, были получены противоречивые результаты, в частности превосходство флурбипрофена в отношении уменьшения ночной боли, улучшения качества сна и оценки пациентами общего состояния [50], превосходство диклофенака в отношении боли и других показателей [51], равная эффективность [52, 53]. При этом во всех исследованиях параметры безопасности и переносимости обоих препаратов были сопоставимыми.
Безопасность
Как уже указывалось ранее, профиль безопасности является ключевым показателем при выборе НПВП. Опыт применения флурбипрофена свидетельствует о благоприятном профиле желудочно-кишечной безопасности данного препарата при хСМБ, не уступающем или даже превосходящем профиль безопасности других неселективных ЦОГ-ингибиторов [38, 54, 55].
В отличие от целого ряда НПВП (нимесулида, диклофенака и др.) для флурбипрофена не характерна гепато- и нефротоксичность. Объединенные данные девяти клинических исследований фазы III с участием 1677 пациентов с анкилозирующим спондилитом, ОА или РА (941 получал флурбипрофен и 736 получали препараты сравнения) не показали клинически значимых изменений функции почек или печени после приема данного препарата, в том числе у больных старше 60 лет [56]. Крупное популяционное исследование по оценке связи между приемом НПВП и развитием хронической болезни почек (ХБП) было проведено в Италии. Для этого была использована база данных Arianna, куда были включены результаты наблюдения 158 510 пациентов, полученные от 123 врачей общей практики [57]. Было выявлено 1989 случаев ХБП, 7906 пациентов в контрольной группе. Риск развития ХБП значимо повышался на фоне лечения оксикамами (мелоксикам, пироксикам и др.) и кеторолаком. Риск был минимальным (0,71–0,87) для производных пропионовой кислоты, включая флурбипрофен.
Как было отмечено ранее, в настоящее время профиль безопасности лекарственных средств в плане развития/ухудшения сердечно-сосудистой патологии является ведущим параметром с учетом того, что значительное число больных, страдающих хСМБ, относятся к старшим возрастным группам и, соответственно, имеют традиционные факторы риска развития сердечно-сосудистых заболеваний.
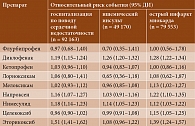
Риск возникновения разных вариантов сердечно-сосудистой патологии на фоне приема НПВП оценивался в рамках многоцентрового европейского проекта SOS [58–60]. Основу исследования составили базы данных здравоохранения нескольких европейских стран (Нидерланды, Италия, Германия, Испания и Великобритания), отражающих ситуацию более чем у 32 млн человек. В исследование включали лиц в возрасте 18 лет и старше, которые начали лечение НПВП в 1999–2011 гг. С помощью метода «случай – контроль» был проанализирован риск развития сердечной недостаточности, ишемического инсульта и острого инфаркта миокарда (таблица) [58–60].
В рамках проекта SOS выявлены 92 163 случая госпитализации по поводу сердечной недостаточности (сопоставлены с 8 246 403 контрольными случаями), 49 170 случаев ишемического инсульта (4 544 608 пациентов в группе контроля), 79 553 случая острого инфаркта миокарда (8 456 399 пациентов в контрольной группе). В таблице представлен относительный риск развития указанных сердечно-сосудистых событий и 95%-ный доверительный интервал (ДИ) с учетом сопоставления с контрольными группами по полу, возрасту, году включения в базу данных, традиционным факторам риска (сердечно-сосудистые заболевания в анамнезе, сахарный диабет 2 типа, дислипидемия, курение и др.) на фоне терапии флурбипрофеном и другими наиболее распространенными НПВП.
По всем трем вариантам серьезных сердечно-сосудистых событий флурбипрофен не ассоциировался с дополнительными рисками наступления таковых по сравнению с контролем (относительный риск 0,7–1,0). В отличие от большинства других НПВП флурбипрофен обладал более низким риском развития каждого из перечисленных выше сердечно-сосудистых событий и суммарно продемонстрировал лучший профиль безопасности.
Таким образом, флурбипрофен представляет собой неселективный ЦОГ-ингибитор с мощным анальгетическим и противовоспалительным действием, доказанной эффективностью при хСМБ различной этиологии и благоприятным профилем желудочно-кишечной и сердечно-сосудистой безопасности. В связи с этим флурбипрофен может рассматриваться как препарат первого выбора при широком спектре патологических состояний, сопровождающихся хСМБ.
D.E. Karateev, MD, PhD, Prof., E.L. Luchikhina, PhD
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Chronic musculoskeletal pain (CMP) is the main sign of the musculoskeletal disorders and one of the most frequent types of pain syndrome in general, affecting millions of people worldwide. The most common causes of CMP are joint lesions, such as osteoarthritis (OA), rheumatoid arthritis (RA) and other rheumatic diseases, as well as a wide range of spine pathology (intervertebral disc lesions, spondylosis, spondyloarthrosis, spondyloarthritis, etc.). Chronic musculoskeletal pain develops predominantly by the nociceptive type, however, some patients develop neuropathic pain. Nociceptive and neuropathic variants of CMP are closely related to each other, which is largely due to the involvement of inflammatory mechanisms in the formation of pain syndrome, regardless of its cause. The main class of drugs used in CMP are nonsteroidal anti-inflammatory drugs (NSAIDs). The choice of NSAIDs is primarily based on the assessment of the risk of adverse events in a particular patient. Currently, the risk of developing cardiovascular complications during NSAID treatment is considered a leading safety issue, especially in elderly patients. In this regard, there is an increased interest in non-selective cyclooxygenase inhibitors. This group NSAIDs includes flurbiprofen, a fluorinated derivative of phenylpropionic acid, which is a compound with pronounced analgesic and anti-inflammatory activity. According to experimental data, flurbiprofen significantly exceeds ibuprofen and indomethacin in anti-inflammatory effect. In studies on postoperative pain, it helped to reduce the need for opioids by ≈50%. In numerous clinical trials, flurbiprofen has shown high efficacy and quite high gastrointestinal safety in RA, OA, ankylosing spondylitis and nonspecific back pain. Large population studies have demonstrated that flurbiprofen had no additional risks compared to the control group for the development of heart failure, acute myocardial infarction, and ischemic stroke (relative risk 0.7–1.0). Compared with most other NSAIDs, flurbiprofen showed lower risks of each of these events and had an overall better cardiovascular safety profile. In this regard, flurbiprofen can be considered as a first-line drug for a wide range of pathological conditions associated with CMP.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.