Диабет и зрение. Взгляд эндокринолога и офтальмолога. VIII Всероссийский диабетологический конгресс «Сахарный диабет – пандемия XXI века». Сателлитный симпозиум компании «Байер»
- Аннотация
- Статья
- Ссылки



Ведение пациентов с диабетической ретинопатией
Сахарный диабет (СД) – группа метаболических заболеваний, характеризующихся хронической гипергликемией. Последняя является результатом нарушения либо секреции инсулина, либо его действия, либо обоих этих факторов.
Хроническая гипергликемия обусловливает целый спектр тканевых, органных и сосудистых изменений, что приводит к повреждению практически всех органов и систем. Как отметила доцент кафедры эндокринологии и диабетологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», к.м.н. Алевтина Николаевна ОРАНСКАЯ, чтобы предотвратить развитие тяжелых сосудистых осложнений, необходимо как можно раньше выявлять и начинать лечение больных сахарным диабетом.
Согласно рекомендациям Американской диабетической ассоциации (2013) скрининг на наличие СД показан всем взрослым с индексом массы тела более 25 кг/м2 и одним и более из нижеперечисленных факторов1:
- с низкой физической активностью;
- отягощенным семейным анамнезом в отношении СД, прежде всего у родственников первой линии;
- артериальной гипертензией ≥ 140/90 мм рт. ст. или получающим гипотензивную терапию;
- уровнем холестерина липопротеинов высокой плотности менее 35 мг/дл (0,9 ммоль/л) и/или триглицеридов более 250 мг/дл (2,82 ммоль/л);
- синдромом поликистозных яичников в анамнезе;
- признаками выраженной инсулинорезистентности;
- сердечно-сосудистыми заболеваниями в анамнезе;
- родившим ребенка с массой тела более 4,1 кг или перенесшим гестационный СД.
В отсутствие данных признаков скрининг необходим всем лицам старше 45 лет. При неподтверждении диагноза повторный скрининг необходимо проводить не реже одного раза в три года. Причиной тому служат не только высокая распространенность СД во всем мире, но и неуклонный рост числа больных, преимущественно за счет пациентов с СД 2 типа.
Кроме того, постоянно увеличивается распространенность нарушения толерантности к глюкозе – в 2017 г. численность таких лиц составила 352,1 млн (7,3% от общемирового населения), к 2045 г. эта цифра возрастет до 531,6 млн (8,3% от общемирового населения)2. Пациенты с нарушением толерантности к глюкозе подвержены высокому риску развития СД 2 типа2.
Результаты российского эпидемиологического исследования NATION также свидетельствуют об актуальности проблемы ранней диагностики. Так, из 5,4% больных СД более половины (54%) впервые узнали о своем диагнозе, у каждого пятого уровень гликированного гемоглобина (HbA1c) был более 9,0%3. У каждого второго с ранее диагностированным заболеванием значения HbA1c превышали 7,0%.
В настоящее время в качестве диагностического критерия СД выбран уровень HbA1c ≥ 6,5%. По значениям HbA1c также оценивают степень контроля заболевания на фоне сахароснижающей терапии.
Целевой уровень HbA1c устанавливается индивидуально. Однако у взрослых пациентов рекомендуется поддерживать его в пределах ≤ 7,0%1. В некоторых случаях может быть целесообразным достижение более низких значений (≤ 6,5%). Это позволит снизить риск развития нефропатии и ретинопатии при условии сбалансирования риска гипогликемий1.
Всегда ли следует ориентироваться только на уровень HbA1c?
По мнению А.Н. Оранской, HbA1c – средняя величина, которая не дает представления о колебаниях глюкозы в крови в течение суток. В то же время именно с вариабельностью гликемии ассоциируется развитие осложнений СД. Результаты ряда исследований продемонстрировали, что вариабельность глюкозы – значимый и самостоятельный фактор развития эндотелиальной дисфункции4, 5.
Диабетическая ретинопатия (ДР) – микрососудистое осложнение СД, характеризующееся поражением сетчатки в результате ишемии, повышения проницаемости и эндотелиальной дисфункции и приводящее к значительному снижению зрения или его потере (рис. 1).
Диабетическая ретинопатия занимает лидирующее место среди причин слепоты и инвалидности (74,2–80,6%) у больных в возрасте от 30 до 60 лет.
У пациентов с СД на долю собственно ДР приходится от 75 до 80% патологий органов зрения6. Клинические симптомы ДР через пять – семь лет от начала заболевания отмечаются в 15–20% случаев, через десять лет – в 50–60%, через 30 лет – в 100% случаев. Высока частота развития ДР и у детей до 15 лет: при длительности диабета до пяти лет она составляет 13%, от пяти до десяти лет – 26%, более десяти лет – 44,5–66,7%.
Через 15 лет от начала заболевания у 42% больных СД 1 типа и 80% больных СД 2 типа развивается макулярный отек (МО). «К сожалению, приходится констатировать, что ежегодно количество пациентов с МО увеличивается на 5–10%», – подчеркнула А.Н. Оранская.
Своевременное выявление и лечение ДР препятствуют прогрессированию сосудистых изменений глазного дна. Поэтому одна из главных задач, стоящих перед эндокринологами, – выявление групп риска и направление пациентов, попавших в такие группы, на консультацию к офтальмологу.
Частота офтальмологических осмотров зависит от наличия и стадии ДР. В отсутствие ДР осмотр проводится один раз в год, при непролиферативной ДР – не менее двух раз в год, при непролиферативной ДР с макулопатией – не менее трех раз в год, при препролиферативной – от двух до четырех раз в год, при пролиферативной – не менее трех-четырех раз в год, при терминальной – по показаниям, при регрессе после лазерной коагуляции сетчатки (ЛКС) – по показаниям, но не менее трех-четырех раз в год6.
Определение стадий ретинопатии и выбор специфического лечения считаются прерогативой офтальмолога. Эндокринологи в свою очередь с помощью своевременно назначенного лечения могут повлиять на модифицируемые факторы риска – гипергликемию, артериальную гипертензию, дислипидемию.
Поскольку сосудистые изменения при СД играют важную роль в развитии ДР (см. рис. 1), необходимо как можно раньше начать профилактику прогрессирования сосудистых изменений с помощью ангиопротекторов. Ангиопротекторы нормализуют проницаемость сосудов, увеличивают резистентность капилляров, улучшают микроциркуляцию, положительно влияют на эндотелий сосудов. Однако их эффективность доказана лишь на начальной стадии заболевания.
На любой стадии ДР может развиться диабетический макулярный отек (ДМО). Последний признан одной из главных причин снижения зрения у больных СД и обращения к офтальмологу7, 8.
Ранее золотым стандартом лечения ДМО считалась ЛКС. Лазерная коагуляция предотвращает дальнейшую потерю зрения, но не восстанавливает его, при этом обладает рядом побочных эффектов.
Улучшить остроту зрения (ОЗ)позволяет локальное ингибирование фактора роста эндотелия сосудов (VEGF). Анти-VEGF терапия не только восстанавливает зрение, но и препятствует прогрессированию заболевания.
В настоящий момент на основании результатов многочисленных двойных слепых рандомизированных контролируемых исследований9 для терапии ДМО в РФ зарегистрированы два препарата: афлиберцепт (Эйлеа®) и ранибизумаб (Луцентис).
Необходимо отметить, что эффективность такой терапии зависит от своевременности ее начала и соблюдения режима инъекций. При ее проведении необходим регулярный мониторинг изменений.
Завершая выступление, А.Н. Оранская отметила, что для эффективного лечения СД и его осложнений необходим междисциплинарный подход. Профилактика диабетического поражения сетчатки должна включать нормализацию гликемии с минимизацией ее вариабельности, коррекцию артериального давления, дислипидемии, применение ангиопротекторов. Важно также рассказывать пациенту с СД о потенциальном риске развития поражений сетчатки и призвать его самостоятельно следить за остротой зрения.
Диабетическое поражение сетчатки – можно ли предотвратить слепоту?
По словам заведующего отделением диабетической ретинопатии и офтальмохирургии ФГБУ «Национальный медицинский исследовательский центр эндокринологии», профессора, д.м.н. Дмитрия Валентиновича ЛИПАТОВА, в декабре 2017 г. были опубликованы обновленные рекомендации Европейской ассоциации по изучению диабета и Международной диабетической федерации, в которых четко указываются три основных направления лечения ДР – ЛКС, интравитреальное введение анти-VEGF препаратов, пролонгированных стероидов и витрэктомия. Отмечено также, что в 76% случаев развитие ДР можно предотвратить благодаря интенсивному контролю глюкозы и применению, если необходимо, соответствующих препаратов.
По данным государственного регистра больных СД за 2017 г., в России зарегистрировано 4,5 млн больных СД. Однако его фактическая распространенность в 1,5–2 раза превышает зарегистрированную и составляет 8 млн10.
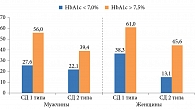
Из 4,5 млн пациентов с СД более 650 тыс. страдают ДР. При СД 1 типа она отмечается в 27,2% случаев, СД 2 типа – в 13,0%. При этом существует прямая корреляция между распространенностью ДР и длительностью диабета, степенью его компенсации. Так, пик заболеваемости у пациентов с СД 1 типа фиксируется при стаже диабета более 20 лет, у лиц с СД 2 типа – от 15 до 20 лет. При недостаточном контроле гликемии частота встречаемости ДР значительно увеличивается как у пациентов с СД 1 типа, так и у страдающих СД 2 типа (рис. 2)11.
С 2013 по 2016 г. отмечено повышение частоты случаев полной потери зрения вследствие ДР: с 55 до 70% на 10 тыс. больных СД 1 типа и с 22 до 40% на 10 тыс. пациентов с СД 2 типа. «По всей видимости, это связано с увеличением общего количества пациентов и продолжительности их жизни», – прокомментировал Д.В. Липатов.
Современная классификация ДР, которой придерживаются российские офтальмологи, предусматривает три стадии: I стадия – непролиферативная ДР, II стадия – препролиферативная, III стадия – пролиферативная ДР. Именно на пролиферативной стадии развиваются такие тяжелые осложнения ДР, как вторичная рубеозная глаукома и тракционная отслойка сетчатки.
По данным национального проекта «Здоровье» (2011–2013) и общероссийского проекта «Диабет – узнай вовремя» (2012–2014), пролиферативная ДР встречается у 6,9% больных СД, препролиферативная –у 9,6%, непролиферативная – у 28,4% пациентов. В 55,0% случаев изменения глазного дна отсутствуют12. «Именно эту когорту нельзя оставлять без наблюдения эндокринолога и офтальмолога», – подчеркнул Д.В. Липатов.
На любой стадии ДР может развиться ДМО8. Диабетический макулярный отек – утолщение сетчатки, связанное с накоплением жидкости в межклеточном пространстве нейроэпителия вследствие нарушения гематоретинального барьера. В отсутствие лечения приблизительно у трети пациентов с клинически значимым макулярным отеком в течение трех лет может происходить серьезная потеря центрального зрения. Потеря зрения приводит к социальной изоляции, ограничивает активность пациентов13.
Проведенный в рамках программы «Барометр диабетической ретинопатии» опрос более 4 тыс. больных СД из 41 страны показал, что для пациентов страх потерять зрение как минимум в два раза выше, чем страх развития других осложнений диабета14. Далее по значимости следовали болезни сердца и инсульт (17%), ампутации конечностей (16%), болезни почек (13%) и т.д. Однако пациенты часто не знают, что необходимо делать для предупреждения развития осложнений. Это еще раз подтверждает значимость проведения обучения методам профилактики развития осложнений в данной когорте.
Современные подходы к лечению ДМО включают лазерную коагуляцию, анти-VEGF терапию и витрэктомию. При лазерной коагуляции на макулярную зону наносятся коагулянты, которые запечатывают источник просачивания. Это позволяет стабилизировать, но не улучшить зрение9.
В исследовании ETDRS, ставшем эпохальным для офтальмологов, была подтверждена эффективность фокальной лазерной терапии в предотвращении потери зрения при ДМО15. Однако проведение ЛКС у ряда пациентов сопровождалось неблагоприятными симптомами. На сегодняшний день установлено, что к серьезным нежелательным явлениям такой терапии в зоне макулы относятся16:
- потеря зрения, связанная с ненамеренной фотокоагуляцией центральной ямки сетчатки;
- усиление макулярного отека вследствие воспаления;
- ограничение поля зрения;
- потеря цветовосприятия;
- пре- и субретинальный фиброз;
- прогрессирующее распространение рубцов в центральную ямку сетчатки.
Кроме того, лазерная коагуляция только предотвращает дальнейшую потерю зрения, не обеспечивая его улучшения8.
В отличие от лазерной коагуляции анти-VEGF терапия позволяет не только сохранить, но и значительно улучшить зрение у пациентов с ДМО17–19. Это обусловлено тем, что причиной развития ДР являются микроангиопатия и окклюзия капилляров, которые приводят к ишемии сетчатки и нарушению гематоофтальмического барьера. Это является мощным триггером гиперпродукции VEGF, которому отводят ведущую роль в повышении проницаемости ретинальных сосудов. Как следствие, кровоизлияние в сетчатку, экссудация и ее отек20.
Анти-VEGF терапия способствует уменьшению проницаемости сосудов, толщины сетчатки и макулы, повышению остроты зрения.
Эффективность ингибиторов VEGF в отношении улучшения функциональных и анатомических показателей у пациентов с ДМО продемонстрирована в многочисленных рандомизированных клинических исследованиях.
В двух многоцентровых рандомизированных активно контролируемых двойных слепых клинических исследованиях VIVID и VISTA сравнивалась эффективность препарата Эйлеа® (афлиберцепт) и лазерной коагуляции у пациентов с ДМО21–23. В исследование VISTA-DME были включены 459 пациентов из 51 медицинского центра США, в исследование VIVID-DME – 403 пациента из 90 центров Европы и Азиатско-Тихоокеанского региона.
Пациенты были рандомизированы в соотношении 1:1:1 на три группы терапии: интравитреальные инъекции афлиберцепта 2 мг один раз в четыре недели, интравитреальные инъекции афлиберцепта 2 мг один раз в восемь недель (2q8) (после пяти ежемесячных инъекций загрузочной фазы) и лазерная коагуляция сетчатки18, 24. Общая длительность терапии составила 148 недель.
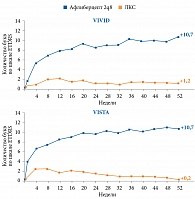
Первичной конечной точкой считалось среднее изменение максимально корригированной остроты зрения (МКОЗ) через 52 недели относительно исходных значений.
После 52 недель лечения более значимое повышение ОЗ наблюдалось у пациентов с ДМО в группах терапии препаратом Эйлеа®. В исследованиях VIVID и VISTA в группах афлиберцепта 2q8 МКОЗ в среднем повысилась на 10,7 буквы по шкале Бейли – Лови, ETDRS, в группах лазерной терапии – на 1,2 и 0,2 буквы соответственно (р < 0,0001) (рис. 3).
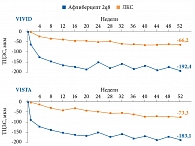
Терапия препаратом Эйлеа® также приводит к значимому улучшению анатомических показателей. Так, в исследованиях VIVID и VISTA среднее снижение толщины центральной зоны сетчатки (ТЦЗС) в группах афлиберцепта 2q8 составило 192,2 и 183,1 мкм соответственно. В группах лазерной фотокоагуляции сетчатки ТЦЗС уменьшилась на 66,2 и 73,3 мкм соответственно (р < 0,0001) (рис. 4)18.
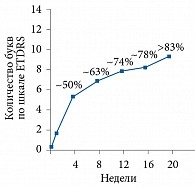
Важно отметить, что в исследованиях VIVID и VISTA было продемонстрировано наиболее значительное повышение ОЗ в период проведения пяти ежемесячных загрузочных инъекций препарата Эйлеа®. После пяти ежемесячных загрузочных инъекций ОЗ у пациентов повысилась более чем на девять букв по шкале ETDRS, что составляло > 83% от общего повышения ОЗ за первый год терапии (рис. 5). Таким образом, применение загрузочных инъекций ассоциируется со значимым улучшением зрения в максимально короткие сроки. Подобные улучшения могут позволить пациентам с ДМО, большинство из которых лица трудоспособного возраста, вернуться на работу настолько рано, насколько это возможно (см. рис. 5).
Установлено, что пять загрузочных инъекций способствуют снижению потенциального риска неэффективности лечения. В исследовании F. Ziemssen и соавт.25 порядка 80% пациентов достигли клинически значимого повышения ОЗ (плюс пять букв) после пяти ежемесячных инъекций препарата Эйлеа®.
Через три года терапии преимущество интравитреальных инъекций афлиберцепта перед лазерной коагуляцией сетчатки в отношении достигнутых анатомических и функциональных показателей сохранилось24. Так, согласно результатам 148-недельных исследований VIVID и VISTA среднее повышение МКОЗ в группах афлиберцепта составило +11,7 и 10,5 буквы по шкале ETDRS соответственно против +1,6 и 1,4 буквы в группах ЛКС. ТЦЗС в группах афлиберцепта в среднем снизилась на 203 и 190 мкм соответственно. В группах лазерной фотокоагуляции сетчатки (с учетом показателей после инъекций афлиберцепта по потребности) ТЦЗС сократилась на 123 и 110 мкм соответственно. Таким образом, результаты данных исследований демонстрируют большую эффективность анти-VEGF терапии в лечении ДМО по сравнению с лазерной коагуляцией сетчатки – бывшим золотым стандартом терапии ДМО.
В прямом сравнительном исследовании Protocol T, проведенном независимой группой исследователей DRCR.net, оценивалась эффективность интравитреальных инъекций афлиберцепта, ранибизумаба и бевацизумаба у 660 пациентов с ДМО. Наибольшее повышение ОЗ к концу первого года терапии было зафиксировано в группе афлиберцепта: 13,3 буквы по шкале ETDRS против 11,2 и 9,7 буквы в группах ранибизумаба (p = 0,03) и бевацизумаба (p < 0,001) соответственно26.
Более значимая эффективность афлиберцепта к концу первого года лечения также отмечалась у пациентов с исходной остротой зрения ниже 20/40. Среднее улучшение ОЗ у таких больных в группе афлиберцепта составило +18,9 буквы по шкале ETDRS, в группе ранибизумаба – +14,2 буквы по шкале ETDRS (p = 0,003), в группе бевацизумаба – +11,8 буквы (p < 0,001). К концу второго года наблюдения преимущество афлиберцепта в отношении улучшения остроты зрения у данной группы пациентов сохранилось, однако с утратой статистической значимости: +18,1 буквы по шкале ETDRS в группе афлиберцепта, +16,1 буквы в группе ранибизумаба и +13,3 буквы в группе бевацизумаба27. Особый интерес при анализе данных за два года терапии представляет показатель AUC – площадь под кривой, характеризующий среднюю ОЗ у пациентов на протяжении двух лет и качество их жизни. Этот показатель был статистически значимо выше у пациентов с исходной МКОЗ ниже 20/40 в группе афлиберцепта: +17,1 буквы по шкале ETDRS против +13,6 буквы (p = 0,009) в группе ранибизумаба и +12,1 буквы (p < 0,001) в группе бевацизумаба28. Суммарное количество инъекций было сопоставимо во всех группах терапии.
Следует также отметить, что в этот период в группе афлиберцепта лазерная коагуляция, проводимая в качестве терапии спасения, требовалась значительно реже – 41 против 64% случаев в группе бевацизумаба (p < 0,001) и 52% случаев в группе ранибизумаба (p = 0,04).
Результаты DRCR.net Protocol T позволяют сделать следующие выводы26, 27:
- препарат афлиберцепт значимо и устойчиво повышает ОЗ уже после первой инъекции, даже у пациентов с исходно низкой ОЗ;
- доля пациентов, нуждающихся в проведении ЛКС в качестве терапии спасения, значимо снижается при применении афлиберцепта;
- показатель AUC, характеризующий среднюю ОЗ на протяжении двух лет терапии и косвенно отражающий качество жизни пациентов с исходно низкой ОЗ, статистически значимо увеличивается на фоне терапии афлиберцептом (по сравнению с применением бевацизумаба и ранибизумаба).
Заключение
Сахарный диабет и его осложнения являются значительным бременем для пациента и системы здравоохранения. Учитывая последние тенденции, количество пациентов с СД и сопутствующими ему патологиями в дальнейшем будет только расти, что требует грамотных подходов к диагностике и лечению.
Одним из самых грозных осложнений СД являются диабетическая ретинопатия и диабетический макулярный отек. Для своевременного выявления и терапии этих состояний требуется взаимодействие между эндокринологами и офтальмологами. Это предполагает информирование пациентов о возможности развития подобных осложнений, своевременное направление их на скрининг и начало лечения.
Новые перспективы связаны с широким внедрением в клиническую практику нового золотого стандарта терапии ДМО – ингибиторов VEGF для интравитреального введения. Наиболее широким спектром анти-VEGF активности обладает афлиберцепт (препарат Эйлеа®), блокирующий не только VEGF-A, но и PGF и демонстрирующий высокую эффективность у пациентов с ДМО вне зависимости от исходной остроты зрения. Повышение остроты зрения, улучшение анатомических показателей, а также качества жизни пациентов, получавших терапию препаратом афлиберцепт, подтверждены результатами рандомизированных клинических исследований.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.