Диабетическая полинейропатия. Новые направления повышения эффективности патогенетической терапии
- Аннотация
- Статья
- Ссылки
- English




Сахарный диабет (СД) представляет собой одну из важнейших медико-социальных проблем современного общества. Данное заболевание нередко осложняется выраженными неврологическими нарушениями, которые ведут к тяжелым и порой необратимым изменениям и в конечном итоге к тяжелой инваладизации пациентов, в связи с чем своевременная и адекватная диагностика, профилактика и терапия данных состояний имеют крайне важное значение.
Одним из подобных осложнений СД является диабетическая полинейропатия (ДПН), которая наряду с диабетическими ретинопатией и нефропатией составляет классическую триаду поздних осложнений СД.
СД вызывает 30% всех случаев полинейропатии, являясь основной их причиной [1].
Те или иные симптомы полинейропатии наблюдаются у 50% пациентов с СД, а электронейромиографические признаки поражения периферических нервов – у 90% [2–4].
ДПН существенно снижает качество жизни пациентов, а также является частой причиной глубокой инвалидизации и смертности населения.
Клинические или субклинические симптомы ДПН – прогрессирующей гибели волокон периферических нервов проявляются разнообразными нарушениями чувствительности, снижением мышечной силы дистальных отделов нижних конечностей, формированием язв стоп, нарушениями сна, снижением трудоспособности и качества жизни [5].
ДПН – ведущий фактор риска и основная патоморфологическая причина развития язвенного дефекта стопы, на долю которого приходится от 40 до 70% всех нетравматических ампутаций у пациентов с СД, согласно данным разных авторов [2, 3].
Среди основных факторов риска развития полинейропатии у пациентов с СД выделяют возраст, повышенный уровень триглицеридов в крови, артериальную гипертензию, курение [6, 7], а также продолжительность течения СД. В 40–65% случаев ДПН развивается через 15–25 лет после начала СД, хотя у 5% пациентов с СД симптомы полинейропатии встречаются уже в дебюте заболевания [4]. В последнее время появились данные о генетической предрасположенности к развитию ДПН, а именно генетически детерминированной повышенной активности супероксиддисмутазы и альдозоредуктазы [6, 7].
Существует достаточно большое количество различных теорий развития ДПН, среди которых прежде всего можно выделить метаболическую, сосудистую, наследственную и дизиммунную.
Согласно воззрениям М.А. Pfieffer и М.Р. Schumer, патогенетические механизмы развития ДПН достаточно условно можно разделить на функциональные и анатомические нарушения [8]. Функциональные изменения развиваются на ранних стадиях ДПН и представляют собой полностью или частично обратимые нарушения на фоне постоянного контроля уровня глюкозы в крови [7, 9].
В соответствии с метаболической теорией патогенеза невропатии, ведущим фактором поражения нервной ткани при СД является гипергликемия, которая приводит к значительным патологическим изменениям в метаболизме нервных клеток.
Гипергликемия вызывает нейрональное повреждение вследствие внутриклеточного повышения уровня глюкозы с избыточным метаболизмом, включающим: повышение степени действия альдоредуктазы и соответственно активации полиолового пути утилизации глюкозы, а также избыточное накопление сорбитола, фруктозы и других токсических продуктов, повышение внутриклеточного осмотического давления и отек нейронов. Кроме того, гипергликемия с накоплением токсических метаболитов и конечных продуктов гликирования активирует синтез свободных радикалов и соответственно способствует развитию окислительного стресса, который рассматривается как ведущая причина поздних осложнений СД, в том числе генерализованного поражения периферических нервов [10]. Гипергликемия воздействует на протеом нервных, эндотелиальных клеток и перицитов с образованием патологически гликированных протеинов, трансформацией их структуры, нарушением функций и накоплением конечных продуктов гликирования [11, 12]. Модификации протеома способствуют нарушение структуры остатков лизина и аргинина (остатки аргинина чаще всего локализованы в сайтах межбелковых взаимодействий и взаимодействий между белками и нуклеотидами, где трансформация структуры белков имеет функциональные последствия из-за своей способности вызывать сшивание и агрегацию белков. Кроме того, взаимодействие между КПГ и рецептором КПГ (RAGE) активирует процессы нейровоспаления, окислительного стресса и эксайтотоксичности, которые способствуют гибели нейронов [13].
Понижение уровня фактора роста нервов и других нейротрофинов, наблюдаемое при ДПН, существенно ухудшает регенераторные возможности аксонов, что способствует прогрессированию аксональной дегенерации и сегментарной демиелинизации.
Сосудистая теория развития ДПН также рассматривается как одна из ведущих в объяснении патогенеза ДПН. В рамках данной теории прежде всего выделяют микроангиопатию, которая, как отмечалось выше, развивается вследствие гликирования белков эндотелиальных клеток и перицитов, в результате чего поражаются vasa nervorum и возникают нарушения эндоневральной циркуляции с последующим формированием перикапиллярного отека [11].
Выделяют следующие клинические формы ДПН: хроническую сенсомоторную полинейропатию (дистальную симметричную полинейропатию), острую сенсорную болевую нейропатию, транзиторную гипергликемическую нейропатию и некоторые другие формы, на долю которых приходится менее 5% [10].
Наиболее часто встречается хроническая сенсомоторная полинейропатия, дебютом которой в большинстве случаев является субклиническая стадия, отличающаяся бессимптомным течением. Данная форма ДПН нередко выступает в качестве единственного проявления СД.
Неврологические нарушения и симптомы у пациентов с хронической сенсомоторной полинейропатией достаточно часто обнаруживаются случайно при скрининговом обследовании. Данная симптоматика носит непостоянный и умеренный характер, и ее проявления усиливаются к вечеру. К проявлениям данной формы ДПН относят прежде всего онемение или «ощущение немых ног» (со слов пациента), а также неустойчивость при стоянии и ходьбе, что является следствием нарушения проприоцепции и способствует нарушению походки, последующему развитию стопы Шарко и падениям пациента, риск которых при ДПН увеличивается в 15 раз [10].
Возникающая специфическая деформация стопы с высоким ее сводом и молоткообразной деформацией пальцев приводит к развитию синдрома диабетической стопы.
Острая сенсорная болевая нейропатия развивается на фоне декомпенсации СД или кетоацидоза. Данная форма отличается возникновением острой, усиливающейся в вечернее и ночное время нейропатической боли, гиперестезии и аллодинии. Нарушения чувствительности в отличие от хронической сенсомоторной полинейропатии выражены весьма умеренно или не выражены вовсе.
Для диагностики ДПН крайне важно тщательное клиническое обследование, поскольку, как уже отмечалось, данное заболевание нередко протекает бессимптомно, а отсутствие симптоматики не всегда означает отсутствие заболевания.
Для обеспечения тщательного клинического обследования необходимо использовать скрининг-тесты: исследование тактильной чувствительности с помощью монофиламента, температурной чувствительности – с помощью тестера термочувствительности кожи, вибрационной чувствительности – с помощью градуированного камертона и/или биотензиометра вибрационного, посредством которого определяется порог вибрационной чувствительности, что крайне важно для анализа риска развития нейропатических язв. Так, согласно результатам исследований, увеличение порога вибрационной чувствительности лишь на 1 балл (1V) повышает риск развития первой язвы стопы на 5,6% [14].
Кроме того, важно применять различные шкалы и опросники для выявления полинейропатии и нейропатической боли.
Для проведения диагностики также используются различные электрофизиологические методы исследования (электронейромиография, ультразвуковая допплерография, реовазография, тепловизионное исследование) [10].
Для успеха терапии пациентов с ДПН большое значение имеет своевременность начала лечения. К основным методам терапии ДПН относятся коррекция модифицируемых факторов риска, патогенетическая и симптоматическая терапия.
Контролирование течения СД (инсулинотерапия, использование помп, современные противодиабетические лекарственные средства) способствует достижению у большинства пациентов целевых значений содержания глюкозы в крови как натощак, так и после еды, в связи с чем при ведении пациентов с СД на первый план выходят поздние осложнения данного заболевания, в том числе ДПН [5].
Одними из ведущих патогенетических механизмов развития нарушений при ДПН являются свободнорадикальное окисление, окислительный стресс и соответственно гипоксия.
Окислительный стресс – это проявление дисбаланса между продукцией свободных радикалов и истощением антиоксидантной системы защиты [15]. Свободные радикалы представляют собой молекулы и/или молекулярные фрагменты, содержащие один или несколько неспаренных электронов, присутствие которых делает данные молекулярные фрагменты высокоактивными. В то же время активные формы кислорода и являются разновидностью свободных радикалов, представляющих собой производные кислорода, которые обладают более высокой реакционной активностью по сравнению с молекулярным кислородом.
Кроме того, существенным патогенетическим механизмом развития ангионеврологических и нейрометаболических нарушений при СД, который клиницистами, к сожалению, не всегда учитывается, что, безусловно, снижает эффективность проводимой терапии, является развивающийся энергодефицит.
Уже на начальном этапе развития ДПН в митохондриях снижается скорость аэробного окисления и окислительного фосфорилирования, что способствует снижению уровня аденозинтрифосфата и увеличению концентрации аденозиндифосфата и аденозинмонофосфата, что, во-первых, значительно снижает функциональные возможности нервных клеток и нервных стволов, а во-вторых, активирует фосфофруктокиназу.
Активация данного фермента способствует выраженной стимуляции реакций анаэробного гликолиза, в связи с чем возрастает степень выраженности гипоксии. Это приводит к активации стрессовых гормонов, прежде всего катехоламинов, избыточное высвобождение которых способствует усилению активности нервной ткани и возникновению дополнительных потребностей в энергетическом субстрате, что в условиях энергодефицита усугубляет ее поражение. Необходимо отметить исключительную важность и актуальность выявления всего симптомокомплекса неврологических, метаболических и сосудистых нарушений для применения препаратов патогенетической терапии ДПН [16].
Для выбора оптимального препарата патогенетической терапии пациентов с ДПН и во избежание полипрагмазии важно также понимать, что энергодефицит и окислительный стресс при развитии данного заболевания являются звеньями одной патогенетической цепи, поскольку первичный энергодефицит приводит к неполноценной трансформации метаболитов в циклах анаэробного и аэробного гликолиза.
Таким образом, при выборе препаратов патогенетической терапии пациентов с ДПН необходимо делать выбор в пользу тех лекарственных средств, которые воздействуют на основные патогенетические механизмы развившихся и прогрессирующих на фоне СД нейрометаболических и ангионеврологических нарушений и соответственно отвечают определенным требованиям, предъявляемым к подобному препарату при терапии и профилактике пациентов данной категории.
Одним из препаратов, который в полной мере отвечает представленным требованиям, является препарат Целлекс – фракционированный протеомный секретом нейрональных стволовых и прогениторных клеток, в состав которого входит ряд сигнальных белков и полипептидов: факторы роста и дифференцировки нервных клеток, сигнальные молекулы клеточных ядер, цитоплазмы и межклеточного матрикса с молекулярной массой от 10 до 250 кДа.
Основные клинические эффекты Целлекса обусловлены выраженным нейропротективным действием при повреждении нервной ткани посредством активации клиренса продуктов измененного метаболизма, восстановления баланса нейротрансмиттеров и нейромедиаторов, а также активации процессов нейрорегенерации и нейрорепарации.
Целлекс обладает прямым нейрорепаративным действием, что обусловлено эффектами входящих в его состав сигнальных белков и полипептидов – факторов роста, дифференцировки нервных клеток и сосудов, нейротрофинов. При этом тканеспецифическое и системное репаративное действие препарата способствует восстановлению регенеративного и репаративного потенциала нервных клеток, аксоно- и дендритогенеза, ангиогенеза [17].
Кроме того, данный препарат активирует вторичную нейропротекцию за счет восстановления сигналов аутофагии, улучшения тканевой иммунорегуляции с торможением иммуногенной цитотоксичности макрофагов [18].
Достаточно важным звеном патогенеза развития осложнений при СД, которому, к сожалению, специалисты не всегда уделяют должное внимание, является эндотелиальная дисфункция, которая в свою очередь ведет к выраженным нарушениям микроциркуляции. В то же время в развитии эндотелиальной дисфункции существенную роль играет повышение концентрации в крови различных маркеров воспаления и дисфункции эндотелия: гомоцистеина, фактора фон Виллебранда, С-реактивного белка, асимметричного диметиларгинина.
Как показали результаты недавно проведенного исследования, препарат Целлекс в статистически значимой степени снижает концентрацию всех перечисленных факторов развития воспаления и дисфункции эндотелия [19].
Таким образом, учитывая вышесказанное о нейтрализующем влиянии Целлекса на основные патогенетические механизмы развития ДПН, этот препарат можно рассматривать как препарат патогенетической терапии данного заболевания.
Для изучения влияния Целлекса на эффективность терапии пациентов с ДПН нами было проведено исследование, цель которого состояла в повышении эффективности терапии пациентов с ДПН и эффективности профилактики развития тяжелых осложнений ДПН, а задачей было изучение эффективности и безопасности препарата Целлекс у данной категории пациентов.
Материал и методы
Анализу были подвергнуты результаты лечения 106 пациентов (42 женщины и 64 мужчины) с верифицированным диагнозом «диабетическая полинейропатия». Средний возраст пациентов составил 59,4 года (от 38 до 69 лет).
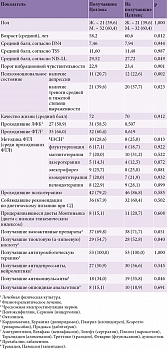
Все пациенты были разделены посредством простой рандомизации на две группы по 53 пациента в каждой (получавшие и не получавшие Целлекс), которые были стандартизированы по различным показателям, таким как возраст, пол, степень выраженности нейропатических, неврологических и психоэмоциональных нарушений, уровень качества жизни, а также проводимая базисная медикаментозная терапия, виды, методы немедикаментозного воздействия (принцип matched-controlled). Стандартизация исследуемых групп, проведенная по перечисленным показателям сопоставимости, представлена в табл. 1.
Целлекс назначали в виде повторных курсов с месячным интервалом между курсами. В рамках каждого курса препарат вводили подкожно по 0,1 мг (1 мл) один раз в сутки в течение десяти дней. Иную медикаментозную терапию (базисную) пациенты обеих групп получали в постоянном режиме на протяжении всего исследования. Графическая схема исследования представлена на рис. 1.
Результаты лечения анализировали по следующим параметрам: наличие или отсутствие нейропатической боли, выраженность и частота проявления нейропатических симптомов, выраженность неврологических симптомов в нижних конечностях, риск развития нейропатических язв, а также уровень качества жизни.
Наличие или отсутствие нейропатической боли определялось с помощью диагностического опросника нейропатической боли (DN4) [20].
Выраженность и частоту появления нейропатических симптомов оценивали по общей шкале симптомов – Total Symptom Score (TSS), представляющей собой двумерную сумму тяжести и частоты четырех положительных нейропатических сенсорных симптомов: боль, жжение, парестезии, онемение [21].
Выраженность неврологических симптомов выявляли с помощью шкалы неврологического дефицита в нижних конечностях – Neuropathy Impairment Score Lower Limb (NIS-LL) [22].
Риск развития нейропатических язв анализировали исходя из порога вибрационной чувствительности, выявление которого в свою очередь проводилось с помощью вибрационного биотензиометра, установленного в четырех точках обеих стоп: malleolus medialis (медиальная лодыжка), caput metatarsalis medialis primi (медиальная головка первой плюсневой кости), hallux pulpae (подушечка большого пальца стопы), caput metatarsalis lateralis quinti (латеральная головка пятой плюсневой кости). Рассчитывали среднее значение для четырех точек (в исследование включался максимальный из показателей на двух стопах для каждого пациента). На основании выявленного порога чувствительности риск развития нейропатических язв оценивали следующим образом: менее 15V – норма; 15–20V – умеренный риск; 20–25V – средний риск; более 25V – высокий риск.
Качество жизни пациентов оценивали с помощью профиля влияния болезни (Sickness Impact Profile) [23]. Качество жизни оценивали в соответствии с количеством баллов, набранных по данной шкале: отсутствие нарушений качества жизни – 0 баллов; минимальные нарушения – 1–10 баллов; легкие нарушения – 11–25 баллов; умеренные нарушения – 26–40 баллов; выраженные нарушения – 41–55 баллов; грубые нарушения – более 55 баллов.
Обследование пациентов, согласно перечисленным выше параметрам, в обеих группах проводилось перед началом исследования и через 50 дней после начала исследования, то есть по окончании второго курса инъекций препарата Целлекс.
Психоэмоциональное состояние при проведении стандартизации групп исследования определялось по шкале самооценки депрессии Уэйкфилда и шкале тревоги Гамильтона.
Критерии включения пациентов в настоящее исследование:
- информированное согласие пациента или его представителя на проведение исследования;
- возможность и желание пациента находиться под наблюдением исследователя в течение предусмотренного протоколом времени;
- пациенты обоего пола с подтвержденным диагнозом «сахарный диабет второго типа»;
- наличие нейропатической боли – 4 и более балла по DN4;
- количество баллов по TSS – любое;
- минимальное количество баллов по NIS-LL – 6;
- средняя величина порога вибрационной чувствительности хотя бы на одной стопе, выявленная с помощью биотензиометра вибрационного, – 15V и более;
- количество баллов, согласно Sickness Impact Profile (качество жизни), – более 40;
- отсутствие противопоказаний к приему препарата в течение предусмотренного времени.
Критерии невключения пациентов в исследование:
- наличие заболеваний, осложнением которых может являться полинейропатия с болевым синдромом (дефицит витамина В12, парапротеинемия, алкоголизм, заболевания почек, гипотиреоз);
- участие в клиническом испытании каких-либо лекарственных препаратов менее чем за три месяца до скрининга;
- данные о гиперчувствительности к исследуемому препарату;
- любые другие состояния, затрудняющие, по мнению врача-исследователя, участие в клиническом исследовании.
Критерии исключения пациентов из исследования:
- отказ пациента от дальнейшего участия в исследовании;
- возникновение заболевания и/или состояния, которое, по мнению исследователя, потенциально может повлиять на результаты лечения;
- непереносимость препарата, развитие нежелательных явлений.
Настоящее исследование является проспективным, сравнительным, открытым.
Исследование проводилось с 2 февраля 2022 г. по 16 июля 2024 г. в Центре медицинской реабилитации СПб ГБУЗ «Городская больница № 38 им. Н.А. Семашко», сотрудники которого оказали существенную помощь авторам исследования.
Статистический анализ результатов исследования проводился с использованием пакетов программы SPSS STATISTICS 29.0.2.0. Для сравнения качественных признаков и процентных соотношений использовались критерий независимости качественных (категориальных) признаков χ², точный критерий Фишера и коэффициент неопределенности. Зависимость между изучаемыми признаками признавалась, когда доверительный уровень (р) составлял менее 0,05. При частоте изучаемого события менее 5 наблюдений в одной из граф таблицы использование критерия χ2 признавалось некорректным и требовало использования точного критерия Фишера.
Результаты
Согласно результатам исследования, использование препарата Целлекс в комплексной терапии пациентов с ДПН способствует статистически значимому снижению выраженности проявлений нейропатической боли.
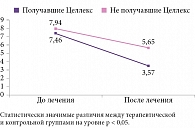
Так, в группе пациентов, получавших Целлекс, средний балл по опроснику DN4 снизился на 3,89 (с 7,46 до 3,57) (р < 0,05). Аналогичный показатель в группе не получавших Целлекс уменьшился на 2,29 балла (с 7,94 до 5,65), что указывает на статистически значимые различия между группами по данному показателю (р < 0,05) (рис. 2).
Показано, что применение Целлекса благоприятно влияет на купирование или уменьшение выраженности, а также снижение частоты появления различных нейропатических симптомов.
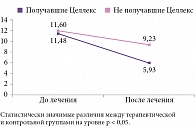
Так, согласно данным TSS, отмечались существенные и статистически значимые различия между группами пациентов, получавших и не получавших Целлекс, в отношении уменьшения выраженности и частоты появления таких нейропатических симптомов, как покалывание, жжение, онемение, ноющая боль (р < 0,05) (рис. 3). В группе Целлекса общий суммарный балл, набранный пациентами по TSS, снизился на 5,67 (р < 0,05) и составил по окончании курса терапии 5,93 балла (с 5,67 до 2,25). В контрольной группе данные показатели составили соответственно 2,25 и 9,23 балла (статистические различия между общим суммарным баллом до и после прохождения курса лечения в данной группе не выявлены) (см. рис. 3).
Далее приводятся раздельные итоги исследования по TSS относительно выраженности и частоты появлений нейропатических симптомов.
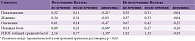
Общий средний балл, отражающий выраженность нейропатических симптомов в группе получавших Целлекс на фоне терапии снизился на 4,28 балла, в то время как в группе не получавших Целлекс – на 1,66, что указывает на статистически значимые различия между группами в отношении данного показателя (р < 0,05) (табл. 2).
Особенно ярко подобная тенденция проявляется в отношении такого симптома, как онемение, средний балл выраженности которого снизился в группе Целлекса на 2,49 (р<0,05), а в контрольной группе – на 0,74 (р < 0,001).
Кроме того, статистически значимые различия между группами наблюдались в отношении уменьшения выраженности покалываний. Соответствующие показатели в группах пациентов, получавших и не получавших Целлекс, составили -1,0 и -0,17 балла соответственно (р < 0,05).
Статистически значимые различия в отношении уменьшения выраженности жжения и ноющей боли между группами не обнаружены (см. табл. 2).
Частота появления нейропатических симптомов, согласно результатам исследования, также статистически значимо зависела от применения Целлекса. Согласно анализу, выполненному по TSS, общий средний балл, отражающий частоту появления нейропатических симптомов, в группе получавших Целлекс снизился на фоне терапии на 1,39 (р < 0,05), в то время как в группе не получавших Целлекс – на 0,59 (р < 0,05). В наибольшей степени данное утверждение справедливо в отношении ноющей боли и покалываний, уменьшение частоты появления которых в группах исследования имеет статистические различия (р < 0,05) (табл. 3).
Статистически значимые различия в отношении уменьшения частоты появления жжения и онемения между группами исследования не выявлены (см. табл. 2).
Включение в схему терапии препарата Целлекс также оказывало благоприятное влияние на уменьшение неврологического дефицита в нижних конечностях. Так, согласно NIS-LL, общий средний балл, отражающий выраженность неврологической симптоматики в группе получавших Целлекс, снизился на фоне терапии на 19,70, в то время как в группе не получавших Целлекс – на 8,90, что указывает на статистически значимые различия между группами по данному показателю (р < 0,001) (табл. 4).
Наиболее выраженно применение Целлекса способствовало уменьшению расстройств чувствительности. Так, средний балл, отражающий чувствительные нарушения, снизился в группе Целлекса на 9,92 (р < 0,001), в то время как в группе пациентов, не получавших Целлекс, – на 1,66 (р < 0,001) (см. табл. 4). Кроме того, имели место статистически значимые различия между группами в отношении повышения мышечной силы пациентов: в группе получавших Целлекс средний балл, отражающий мышечную слабость, снизился на 6,21 (р < 0,05), в группе пациентов, не получавших данный препарат, – на 4,76 (см. табл. 4).
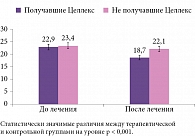
Крайне важным результатом исследования стал анализ влияния терапии на порог вибрационной чувствительности, поскольку данный показатель свидетельствует о степени выраженности риска развития нейропатических язв, которые нередко приводят к одному из наиболее грозных последствий ДПН – ампутации конечности.
Согласно результатам исследования, Целлекс в существенной и статистически значимой степени снижал порог вибрационной чувствительности на 4,2V (с 22,9 до 18,7) (р < 0,001), в то время как в группе пациентов, не получавших Целлекс, данный показатель снизился незначительно – на 1,3V (с 23,4 до 22,1) (рис. 4).
Между тем результаты более раннего исследования C.A. Abbott и соавт. свидетельствуют о том, что при снижении порога вибрационной чувствительности всего на 1V риск развития первичной язвы стопы уменьшается на 5,6% [14].
Таким образом, применение Целлекса в лечении пациентов с ДПН снижает риск развития нейропатической язвы стопы на 23,5%, а следовательно, способствует предотвращению последующих ампутаций конечностей.
В группе пациентов, не использовавших Целлекс, проводимое лечение способствовало снижению риска развития нейропатической язвы стопы лишь на 7,3%.
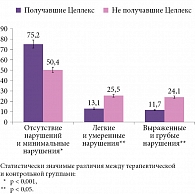
Согласно опроснику профиля влияния болезни (Sickness Impact Profile), уровень качества жизни пациентов в группе Целлекса был статистически значимо выше, чем в контрольной группе.
В группе пациентов, получавших Целлекс, отсутствие нарушений качества жизни и их минимальная выраженность наблюдались в 75,2% случаев, в контрольной группе – в 50,4% (р < 0,001) (рис. 5). Напротив, выраженные и грубые нарушения качества жизни отмечали 11,7% пациентов группы Целлекса и 24,1% – контрольной группы (р < 0,05) (см. рис. 5).
Необходимо отметить, что применение препарата Целлекс способствовало статистически значимому улучшению как физических, так и психосоциальных и бытовых характеристик качества жизни.
В группе Целлекса отсутствие нарушений физических составляющих качества жизни, таких как уход за телом, перемещение, функциональная мобильность, и их минимальная выраженность наблюдались у 75,5% больных, в контрольной группе – у 52,8% (р < 0,001). Выраженные и грубые нарушения данных составляющих качества жизни отмечали 9,4% пациентов группы Целлекса и 22,6% – контрольной группы (р < 0,05) (табл. 5).
Отсутствие нарушений психосоциальных аспектов качества жизни (эмоциональность, социальное взаимодействие, инициативность, энергичность поведения, общение) и их минимальная выраженность наблюдались у 64,2% пациентов, получавших Целлекс, и у 35,8% больных, не получавших данного препарата (р < 0,0001). Выраженные и грубые нарушения указанных составляющих качества жизни отмечались у 5,7% пациентов группы Целлекса и у 24,5% – контрольной группы (р < 0,001) (см. табл. 5).
В группе Целлекса отсутствие нарушений бытовых характеристик качества жизни (работа, сон, отдых, досуг, питание, ведение домашнего хозяйства) и их минимальная выраженность наблюдались у 69,8% больных, в группе не получавших Целлекса – у 49,1% (р < 0,001). Выраженные и грубые нарушения данных составляющих качества жизни отмечали 15,1% пациентов группы Целлекса и 26,4% – контрольной группы (р < 0,05) (см. табл. 5).
В ходе исследования зафиксирована хорошая переносимость Целлекса. Случаев возникновения нежелательных реакций и побочных явлений, равно как и необходимости отмены данного препарата, не зарегистрировано.
Заключение
Успех терапии пациентов с ДПН заключается в комплексном и адекватном использовании как медикаментозных, так и немедикаментозных методов.
В рамках медикаментозного лечения важнейшим фактором, определяющим эффективность комплексного лечения пациентов с ДПН, считается патогенетическая терапия, ярким представителем которой, согласно результатам проведенного исследования и данных клинической практики, является препарат Целлекс.
Результаты проведенного исследования демонстрируют статистически значимую эффективность препарата Целлекс в лечении пациентов с ДПН, использование которого в рамках комплексной терапии пациентов с данной патологией способствует нормализации состояния больных, снижению выраженности и частоты появления нейропатических и неврологических симптомов заболевания, уменьшению риска развития нейропатических язв и соответственно существенному повышению шансов на спасение нижних конечностей от ампутаций, а также улучшению качества жизни.
Целлекс, демонстрирующий выраженную эффективность у пациентов с ДПН благодаря своему мультимодальному действию, оказывает:
- нейрометаболический эффект;
- прямое нейрорепаративное действие, обусловленное свойствами входящих в состав препарата тканеспецифических сигнальных белков и полипептидов (факторов роста и дифференцировки нервных клеток и сосудов) и заключающееся в обеспечении восстановления и нормализации регенеративного и репаративного потенциалов нервных клеток и нервных стволов;
- вазотрофический эффект, основанный на эндотелиопротективном действии и нормализации микроциркуляции в системе vasa nervorum.
Результаты проведенного исследования также убедительно свидетельствует о благоприятном профиле безопасности Целлекса, отсутствии нежелательных реакций и побочных явлений на фоне его применения.
Таким образом, препарат Целлекс при лечении пациентов с ДПН оказывает болезнь-модифицирующий эффект. Данный препарат целесообразно рекомендовать к широкому использованию как в стационарной, так и в амбулаторной практике при ведении пациентов с СД и ДПН.
Безусловно, дальнейшие исследования в данной области представляются достаточно интересными и полезными.
V.V. Kovalchuk, I.M. Metlenko, A.P. Yermagambetova, G.B. Kabdrakhmanova, T.S. Yuzefovich, R.S. Pichko, K.V. Nesterin
City Hospital № 38 named after N.A. Semashko, Medical Rehabilitation Center, Saint Petersburg
West Kazakhstan Medical University named after Marat Ospanov, Aktobe
City Clinical Hospital № 1, Cheboksary
Contact person: Vitaly V. Kovalchuk, vikoval67@mail.ru
The article presents modern ideas about the features of etiopathogenesis, pathomorphological causes and risk factors of diabetic polyneuropathy, describes its main forms and clinical manifestations, as well as features of diagnosis and pathogenetic therapy. The results of a study on the efficacy and safety of using Cellex in the treatment of patients with diabetic polyneuropathy are presented, which analyzed the effect of Cellex on reducing the severity and frequency of neuropathic and neurological symptoms of the disease, reducing the risk of developing neuropathic ulcers, as well as on the quality of life of patients. According to the results of the study, the use of Cellex significantly contributes to the normalization of the condition of patients with diabetic polyneuropathy, reduces the risk of developing neuropathic ulcers, and also leads to an improvement in the quality of life.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


