Диагностика раннего рака желудка с использованием ультратонкого назального эндоскопа и технологии оптической узкоспектральной визуализации NBI®
- Аннотация
- Статья
- Ссылки
- English
Введение
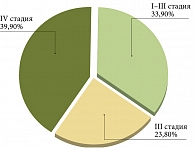
В 2017 г. в структуре общей онкологической заболеваемости в России доля рака желудка составила 3,9%. При этом показатель несвоевременной диагностики (IV стадия) составляет 39,9% и в отдельных областях достигает 54,8%. Еще 23,8% случаев рака желудка выявляют на III стадии (рис. 1). Как следствие – высокий показатель смертности среди больных раком желудка [1]. Более половины больных раком желудка не проживают и года с момента установления диагноза.
Ситуация усложняется тем, что до III стадии рак желудка зачастую протекает бессимптомно. Больные даже с IV стадией рака могут испытывать только распространенные диспепсические жалобы.
Всероссийская статистика раннего рака желудка (Tis, 0 стадия) вообще не ведется в связи со спорадическим учетом единичными экспертными центрами.
Обратите внимание: ранний рак желудка (Tis, 0 стадия) можно выявить только эндоскопическим путем и только специально обученным высококвалифицированным специалистом, с обязательным соблюдением критериев качества эндоскопического исследования верхних отделов пищеварительного тракта с помощью аппаратуры с определенными техническими характеристиками (высокое разрешение, режим осмотра в узком спектре света, желательно оптическое увеличение), что несомненно требует крупных финансовых и временных затрат.
Выявление раннего рака желудка – непростая задача. Между тем пятилетняя выживаемость при обнаружении Tis-рака желудка достигает 100%, а при IA-стадии – 94% [2]. Например, в Японии с помощью эндоскопического скрининга удалось добиться снижения смертности от рака желудка на 30%. Программы скрининга рака желудка, в которых участвует население старше 35–40 лет, действуют в странах Азии – Японии [3], Китае, Корее [4], Сингапуре, Тайване. В этих странах рак желудка имеет высокую распространенность и в структуре онкологической заболеваемости занимает второе-третье место. Обследование проводится с применением фотофлюорографии желудка с раствором сульфата бария, анализа сывороточного пепсиногена, эндоскопии, анализа антител к Helicobacter pylori [5]. Эндоскопический метод оценивается как высокоэффективный, наиболее чувствительный и рентабельный метод скрининга раннего рака желудка [6].
В большинстве развитых стран эзофагогастродуоденоскопия (ЭГДС) выполняется под седацией [7]. Отсутствие таковой тяжело переносится пациентами, что влечет за собой снижение качества осмотра, повышение риска невыявления патологии, нежелание больных проходить повторное исследование.
Использование ультратонких (< 6 мм) эндоскопов и выбор назального пути их введения позволяют выполнять ЭГДС под местной анестезией. Как правило, она хорошо переносится пациентами. Ранние модели таких эндоскопов имели серьезный недостаток – низкое качество изображения. С внедрением новых технологий производства светочувствительных матриц и оптики этот недостаток полностью устранен.
Корпорация OLYMPUS™ – лидер в отрасли производства гибких эндоскопов. На сегодняшний день это единственная компания, выпускающая назальные гастроскопы с высоким разрешением матрицы (1066 × 1066 точек) и диаметром дистального конца 5,4 мм, использующая технологию оптического узкоспектрального режима (NBI®), не имеющую аналогов. Такие характеристики обеспечивают полноценный детальный осмотр и возможность выявления предраковой патологии и рака на ранней стадии в режиме NBI® [8–11].
В Центре экспертной эндоскопии (Симферополь) применяется только эндоскопическая видеосистема последнего поколения экспертного класса OLYMPUS™ EVIS EXERA III. Более 90% ЭГДС выполняются трансназально под местной анестезией раствором лидокаина с помощью ультратонкого видеогастроскопа OLYMPUS™ после пероральной подготовки раствором симетикона 100 мг в 100 мл воды за 30 минут до исследования. Кроме того, при эндоскопии пищеварительного тракта всегда применяются СО2-инсуффлятор UCR и водяная помпа. Длительность ЭГДС колеблется от 8 до 22 минут, что позволяет тщательно отмыть и осмотреть всю поверхность слизистой оболочки пищевода, желудка и двенадцатиперстной кишки. Проведение каждого исследования подтверждается материалами видео- и фотосъемки. Протокол ЭГДС содержит паспортные данные, диагноз при направлении, жалобы и анамнез, подробное описание, десять эндоскопических фотографий, в соответствии с рекомендациями ESGE по контролю качества в гастроинтестинальной эндоскопии [12], заключение и рекомендации. Переносимость исследования хорошая. В ряде случаев (19%) после назальной гастроскопии отмечается носовое кровотечение, обычно незначительное, но в 6% требующее тампонады (марлевая турунда, смоченная в пятипроцентном растворе аминокапроновой кислоты). Ни одного случая упорного и интенсивного носового кровотечения, которое потребовало бы помощи ЛОР-врача, по результатам более чем 500 исследований не зарегистрировано.
Клинический случай
В Центр экспертной эндоскопии (Симферополь) обратилась 41-летняя пациентка с жалобами на периодическую боль и дискомфорт в эпигастральной области, кашицеобразный стул до двух раз в сутки с примесью слизи. Жалобы появились за два месяца до обращения на фоне стресса, вызванного смертью матери от рака желудка в 63 года. Согласно результатам предварительных обследований, онкомаркеры в пределах нормы: СА 72-4 – 3761 нг/мл (норма 0,2–30300 нг/мл), СА 242 – 12 МЕ/мл (норма до 35 МЕ/мл). В описательной части ультразвукового исследования органов брюшной полости обращало на себя внимание единичное округлое эхоплотное образование диаметром 10 мм в правой доле печени.
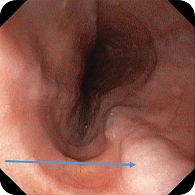
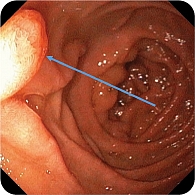
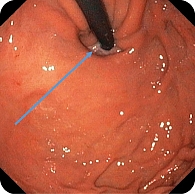
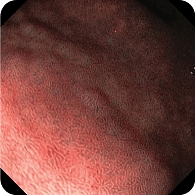
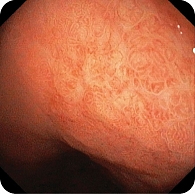
При эндоскопическом исследовании в среднегрудной и дистальной частях пищевода обнаружена единичная варикозно расширенная до 5 мм вена (рис. 2). В луковице двенадцатиперстной кишки определялась небольшая гиперемия слизистой оболочки, большой дуоденальный сосочек – без признаков патологических изменений (рис. 3). При осмотре кардиального отдела в инверсии отмечались расширение хиатального отверстия и пролапс кардиального отдела желудка, что расценивалось как признаки хиатальной грыжи и требовало манометрии пищевода для уточнения диагноза (рис. 4). Слизистая оболочка антрального отдела желудка гиперемирована (рис. 5). При осмотре в режиме NBI микрорельеф соответствовал Н. pylory-положительному типу по упрощенной NICE-классификации, предложенной P. Pimentеl-Nunes и соавт. [13] (рис. 6).
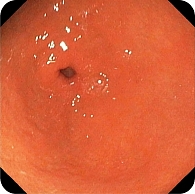
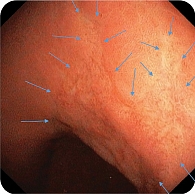
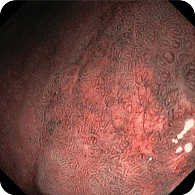
В дистальной части тела желудка по малой кривизне обнаружена зона небольшой депрессии сложной формы с четкими контурами, по цвету неоднородная, чуть светлее окружающей слизистой, размер 35 × 25 мм (рис. 7). Благодаря короткофокусному объективу назального эндоскопа проведен осмотр с минимального расстояния, что позволило в белом свете увидеть нерегулярную структуру поверхности со светлыми зонами и утолщенными «оборванными» капиллярами. Это свидетельствовало об атрофии, кишечной метаплазии и дисплазии (рис. 8). При осмотре в режиме NBI четко визуализировались бесструктурные участки в зоне депрессии слизистой оболочки желудка, которые были определены как соответствующие С-типу по упрощенной NICE-классификации, предложенной P. Pimentеl-Nunes и соавт. (рис. 9).
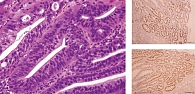
Выполнена биопсия из трех наиболее измененных участков. При патогистологическом исследовании обнаружено умеренно выраженное хроническое активное воспаление с очагами кишечной метаплазии и фокусами дисплазии низкой и высокой степени, оверэкспрессией белков Ki-67 и p-53 при иммуногистохимическом исследовании (рис. 10). Патологогистологические результаты были представлены профессору Такаши Яо (Япония), а также С.С. Пирогову (Москва). Мнение обоих экспертов совпало: у пациентки рак желудка.
Пациентка была направлена в МНИОИ им. П.А. Герцена (Москва), где С.С. Пироговым была выполнена магнификационная эндоскопия с последующей резекцией новообразования методом эндоскопической диссекции в подслизистом слое (ESD).
Выводы
Ввиду высокой распространенности рака желудка в России и его несвоевременной диагностики почти в половине случаев на первое место выходят меры профилактики. Несомненно, к таким мерам относятся выявление и эрадикация инфекции, вызванной H. pylori, строгое соблюдение эпидемиологических принципов лечения, информирование пациентов о необходимости проведения планового профилактического эндоскопического обследования как единственного способа своевременного обнаружения предраковых изменений и раннего рака пищевода, желудка, двенадцатиперстной кишки.
Использование современных ультратонких назальных эндоскопов высокого разрешения GIF-XP170N или GIF-XP190N с технологией оптического узкоспектрального режима (NBI® OLYMPUS™) под местной анестезией позволяет обнаруживать рак желудка на ранней стадии. Этот метод комфортен для пациента, является простой и удобной альтернативой ЭГДС под седацией, что особенно важно в амбулаторных условиях.
A.A. Korneev
Center for Expert Endoscopy (Simferopol)
Contact person: Alexey Aleksandrovich Korneev, korneyev@hotmail.com
In domestic practice, gastric cancer of stage IV is being diagnosed in 39.9% of cases. Endoscopic diagnosis is the only way to detect in time precancerous changes and early cancer of the esophagus, stomach, duodenum. Modern high-resolution ultra-thin nasal endoscopes with optical narrow-band image mode (NBI® OLYMPUS) technology allow detecting gastric cancer at an early stage. The use of such endoscopes under local anesthesia is the simple and convenient alternative to esophagogastroduodenoscopy under sedation, which is especially important in ambulatory settings. The article presents a clinical case of early gastric cancer detection using an ultrathin nasal gastroscope with NBI® technology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.