Междисциплинарный консенсус RE.GA.IN.: что нового? Часть 1: дефиниции, Нelicobacter pylori-ассоциированный и аутоиммунный гастрит
- Аннотация
- Статья
- Ссылки
- English
В междисциплинарном консенсусе RE.GA.IN. приняли участие признанные специалисты-эксперты по гастриту с пяти континентов. После оживленных дебатов по наиболее спорным аспектам участники консенсуса RE.GA.IN. суммировали существующие научные сведения, чтобы выработать ориентированные на курацию пациента ключевые положения с позиций доказательной медицины, которые призваны помочь врачам-специалистам в их повседневной клинической практике. Конечной целью RE.GA.IN. было и остается содействие дальнейшему совершенствованию клинического ведения пациентов с гастритом. В данной статье представлены положения консенсуса RE.GA.IN., определяющие понятия нормы, современные представления о гастрите, ассоциированном с Н. pylori, и аутоиммунном гастрите.
В междисциплинарном консенсусе RE.GA.IN. приняли участие признанные специалисты-эксперты по гастриту с пяти континентов. После оживленных дебатов по наиболее спорным аспектам участники консенсуса RE.GA.IN. суммировали существующие научные сведения, чтобы выработать ориентированные на курацию пациента ключевые положения с позиций доказательной медицины, которые призваны помочь врачам-специалистам в их повседневной клинической практике. Конечной целью RE.GA.IN. было и остается содействие дальнейшему совершенствованию клинического ведения пациентов с гастритом. В данной статье представлены положения консенсуса RE.GA.IN., определяющие понятия нормы, современные представления о гастрите, ассоциированном с Н. pylori, и аутоиммунном гастрите.
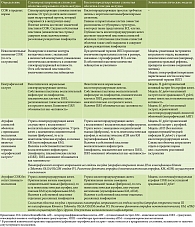
![Таблица 2. Этиологическая классификация гастрита (по [12])](/upload/resize_cache/iblock/328/195_350_1/Bordin2.jpg)

Введение
В 1990 г. на Всемирном конгрессе гастроэнтерологов, проходившем в Сиднее, была сформирована международная рабочая группа, рассмотревшая клинико-морфологические аспекты хронического гастрита [1, 2]. В результате был подготовлен согласительный рабочий документ «Сиднейская система: новая классификация гастрита», в котором недвусмысленно была отражена главная цель – создать «гибкую систему правил, которую можно будет адекватно модифицировать в ответ на меняющиеся требования» в рассматриваемой области. Положения Сиднейской системы были вновь рассмотрены в 1994 г. на встрече в Хьюстоне, где основное внимание было уделено патоморфологическим (гистологическим) и топографическим вариантам гастрита [2]. Последние десятилетия ознаменовались несколькими вехами в области изучения гастрита: появились новые эпидемиологические данные о заболеваемости раком желудка [3]; признание Helicobacter pylori (H. pylori) в качестве главного этиологического фактора гастрита с его включением в число инфекционных онкогенов первого класса [4]; успехи в диагностике и эрадикации H. pylori; привлечение внимания к ранее игнорируемой роли микробиоты желудка в развитии заболеваний желудка [5]; выраженный прогресс эндоскопических технологий [6] и формирование стандарта патоморфологического заключения по оценке гастрита с точки зрения стадирования процесса и, соответственно, стратификации риска развития рака желудка. Дальнейшие проекты были направлены на изучение клинико-морфологических особенностей гастрита или отдельных компонентов данного заболевания. Среди них следует назвать международный консенсус по атрофии, шесть проведенных конференций «Маастрихт» с выработкой положений консенсусов I–VI пересмотров (1996–2022), а также формирование согласованных положений международной группы экспертов в Киото (Kyoto Global Consensus Report) [7].
Опубликованный в феврале 2024 г. консенсус RE.GA.IN. стал итогом работы группы по изучению гастрита в клинической практике и представляет собой следующий шаг в понимании заболеваний желудка [8]. В состав международной группы экспертов вошли специалисты из Африки, Северной и Южной Америки, Азии, Австралии и Европы, которые были отобраны на основе их научного опыта, рецензируемых научных работ, а также вклада в предыдущие международные рекомендации и руководства. Первоначально все участники были разбиты на пять рабочих групп (РГ) по семь делегатов, двое из которых выступали в качестве координаторов группы. Каждая РГ выбирала конкретные темы на основе научных приоритетов делегатов. Затем эти темы были сведены примерно в семь положений от каждой РГ. Процесс продолжался с апреля по ноябрь 2022 г. и включал 36 международных внутригрупповых и межгрупповых конференций в режиме онлайн. 7–10 ноября 2022 г. в Венеции делегаты приняли участие в открытых научных дебатах. В результате обсуждения положения были изменены в соответствии с мнениями, высказанными делегатами во время работы в очном режиме. Затем по каждому положению было проведено голосование в режиме онлайн.
Градация рейтинга голосования по положениям включала четыре уровня: 1) полное согласие; 2) согласие с незначительными возражениями; 3) несогласие; 4) полное несогласие. Первые два уровня были в итоге объединены как выражение согласия, в то время как последние два уровня рассматривались как выражение несогласия. Заявление считалось одобренным консенсусом при ≥ 80% голосов, отражающих согласие (то есть сумма процентов полного согласия и согласия с незначительными возражениями).
Для разработки клинических рекомендаций при оценке материалов учитывали качество доказательства и силу рекомендаций на основе системы GRADE [9].
Качество доказательства:
- высокое качество: маловероятно, что дальнейшие исследования изменят нашу уверенность в оценке эффекта;
- умеренное качество: маловероятно, что дальнейшие исследования окажут существенное влияние на нашу уверенность в оценке эффекта и смогут изменить оценку;
- низкое качество: дальнейшие исследования с большой вероятностью окажут существенное влияние на нашу уверенность в оценке эффекта, что, скорее всего, изменит оценку;
- очень низкое качество: любая оценка эффекта весьма неопределенна.
Сила рекомендации:
- сильная рекомендация;
- слабая рекомендация.
Результаты консенсуса включают восемь разделов, посвященных клинико-морфологическим однородным темам:
- определения и вопросы классификации гастрита;
- спектр гастритов, вызванных H. pylori;
- ключевые вопросы диагностики H. pylori-ассоциированного гастрита;
- H. pylori-ассоциированный гастрит: клинические исходы;
- аутоиммунный гастрит;
- редкие формы гастрита;
- гастрит и микробиота желудка;
- эпидемиология гастрита и связанных с ним предопухолевых и опухолевых изменений.
В данной публикации рассмотрены первые пять разделов консенсуса RE.GA.IN.
2.1. Определения и вопросы классификации гастрита
Гастрит характеризуется спектром состояний с морфологически подтвержденным воспалением слизистой оболочки желудка (СОЖ). Мононуклеарные клетки (например, лимфоциты, гистиоциты, плазматические клетки) и небольшое количество эозинофилов, но не полиморфноядерных нейтрофильных лейкоцитов (ПЯЛ), присутствуют в нормальной СОЖ
(в собственной пластинке).
Гастрит следует отличать от гастропатии, при которой выявляются нарушения гистоархитектоники слизистой оболочки (например, фовеолярная гиперплазия, гиперплазия мышечной пластинки слизистой оболочки) с минимальным или отсутствующим воспалительным компонентом (например, реактивная гастропатия, обусловленная дуоденогастральным рефлюксом, портальная гипертензивная гастропатия и эктазия сосудов антрального отдела желудка). Однако с практической точки зрения эти два состояния часто пересекаются.
При рутинной морфологической оценке дефиниция «гастрит» включает в себя воспаление СОЖ от низкой до высокой степени градации [10]. Произошедшее в эмбриогенезе разделение желудка на части сохраняется во взрослом организме в виде двух анатомически и функционально различных отделов: кислотопродуцирующего (тело/дно) и слизепродуцирующего (антрум/пилорус) [11]. Эти два отдела могут быть вовлечены в воспалительный процесс различным образом, что приводит к появлению различных фенотипов гастрита.
В Киотской классификации выделены разные подходы к гастриту в зависимости от этиологического агента, связанного с окружающей средой или самим хозяином; по клиническому течению – острый (то есть самоограничивающийся) и хронический (то есть длительно протекающий, «не поддающийся самоограничению»). В зависимости от эндоскопической и морфологической картины определяют варианты гастрита в соответствии с их макроскопическим или микроскопическим фенотипом.
Этот разнородный спектр классификаций привел к появлению сложных, часто пересекающихся терминов (табл. 1). Приоритет однозначной идентификации различных подтипов гастрита обусловливает необходимость детализации применяемых определений.
2.1.1. Клинико-морфологическое определение СОЖ в пределах нормы является клиническим приоритетом. Не рекомендуется использовать общий термин «гастрит» из-за риска формирования заблуждений и необоснованных стратегий лечения (уровень согласия: полное согласие – 58%, согласие с незначительными возражениями – 31%, качество доказательств – В,
сила рекомендации – 1).
Комментарий. «Слабо выраженный (хронический) гастрит» и подобные неспецифические термины часто используются в эндоскопических и гистологических/морфологических заключениях. Кроме того, термин «гастрит» иногда используется как синоним диспепсических симптомов [12]. Постановка таких неквалифицированных диагнозов гастрита может укрепить неверные клинические предположения и привести к необоснованным стратегиям лечения (например, длительному приему ингибиторов протонной помпы (ИПП) или к проведению ненужных/необязательных в данном случае эндоскопических исследований). Поэтому определение эндоскопически и морфологически нормальной СОЖ имеет решающее значение для предотвращения клинически неактуальных диагнозов (см. табл. 1).
Нормальная эндоскопическая картина может быть трудноопределимой, и отсутствие поражений или изменений обычно считается адекватным синонимом. Однако существует признак, заключающийся в регулярном расположении собирательных венул в дистальном отделе желудка при использовании стандартной эндоскопии высокого разрешения – белым светом или интегрированной эндоскопии в виде регулярно распределенных красных точек или сосудистых структур типа «морской звезды» [13]. Наличие таких признаков имеет положительную прогностическую ценность более 90% в отношении наличия нормальной кислотопродуцирующей слизистой желудка и надежно исключает инфекцию H. pylori [14].
Морфологически различают два основных типа СОЖ: кислотопродуцирующую и слизепродуцирующую – пилорическую [15]. Третий тип слизистой оболочки расположен дистальнее пищеводно-желудочного соединения [13]. Граница между кислотопродуцирующей и антральной слизистой представляет собой так называемый переходный фенотип слизистой оболочки с перемежающимися железами (см. раздел 2.5.1) [16]. Наличие слизепродуцирующих желез проксимальнее угла желудка (incisura angularis) повышает вероятность наличия метапластической псевдопилорической трансформации на месте кислотопродуцирующей слизистой [17].
Нормальная собственная пластинка СОЖ содержит редкие резидентные лимфоциты, редкие плазматические клетки и эозинофилы, но не нейтрофильные лейкоциты [15]. При отсутствии гистологических признаков изменения структуры (гистоархитектоники) СОЖ, включая воспалительный инфильтрат, лимфоидные фолликулы, атрофию, кишечную или псевдопилорическую метаплазию, обнаруживаемые микроорганизмы, следует поставить гистопатологический диагноз «СОЖ в пределах нормы» [18].
2.1.2. Острый гастрит клинически включает широкий спектр краткосрочных (самоограничивающихся) симптоматических воспалительных изменений СОЖ в результате воздействия различных инфекционных и неинфекционных агентов (уровень согласия: полное согласие – 61%, согласие с незначительными возражениями – 29%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Определение острого гастрита охватывает широкий спектр краткосрочных (как правило, самоограничивающихся) воспалительных изменений СОЖ [2]. Согласно Киотской классификации, этиология острого гастрита включает инфекционные и неинфекционные агенты (табл. 2) [12].
Клиническая картина во многом зависит от этиологии. Эпигастральная боль различной степени выраженности является наиболее частым симптомом наряду с тошнотой, рвотой и постпрандиальным дистресс-синдромом. Кровотечение может иметь место при наличии редких петехий, диффузного геморрагического гастрита и эрозий.
Эндоскопическая картина обычно характеризуется гиперемией, отеком слизистой оболочки, ее легкой ранимостью/рыхлостью/хрупкостью, наличием эрозий, язв, вздутием, кровотечением, редко – наличием флегмоны.
Традиционное морфологическое различие между острым (то есть кратковременным, самоограничивающимся) и хроническим гастритом строится на основе характеристики клеточной популяции воспалительного инфильтрата и является ненадежным. Различные морфологические паттерны с соответствующими этиологическими агентами обобщены в табл. 3 [8].
2.1.3. Хронический гастрит клинически определяется как длительное воспаление СОЖ. Хронический гастрит часто длится всю жизнь при постоянном присутствии причинного фактора, в частности Н. pylori (уровень согласия: полное согласие – 69%, согласие с незначительными возражениями – 31%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Хронический гастрит определяется как длительное (как правило, не самоограничивающееся) воспаление СОЖ. Когда этиологические факторы сохраняются длительное время, хронический гастрит может протекать в течение многих десятилетий, как, например, при инфекции Н. pylori.
Морфологические особенности состоят в наличии признаков воспаления СОЖ, которое также может быть связано с утратой желез, что приводит к атрофии слизистой оболочки. В зависимости от этиологии воспаление и атрофия могут быть неравномерно представлены в двух отделах СОЖ (кислотопродуцирующая слизистая оболочка тела/дна желудка и слизепродуцирующий антральный отдел).
Хронический гастрит подразделяется на неатрофический и атрофический [7, 19]. При неатрофическом гастрите воспаление представлено в слизистой оболочке равномерно или же с преобладанием в антральном отделе или теле желудка. Атрофия СОЖ определяется как потеря желез с наличием или без метаплазии (кишечной и псевдопилорической) [20].
Атрофия может располагаться в различных отделах желудка: ограничиваться антральным отделом, телом желудка или же присутствовать в обоих отделах. В последнем случае это косвенно относится либо к «мультифокальному атрофическому гастриту», либо к «атрофическому пангастриту». Однако эти определения описывают два характерных топографических паттерна атрофии: пятнистое распределение /пятнистый паттерн с рассеянными атрофическими очагами без преобладания антрального отдела или же тела желудка (то есть мультифокальная атрофия) и обширная/распространенная атрофия с вовлечением слизистой оболочки всего желудка («пан», что означает «целый/весь» – атрофический пангастрит). Термин «пангастрит» следует использовать исключительно при атрофии всей СОЖ (см. табл. 1; раздел 2.3.2).
Следуя строгому семантическому подходу, необходимо отличать атрофический гастрит от атрофии желудка. Первое состояние является результатом в первую очередь активной инфекции Н. pylori с участием богатого ПЯЛ воспалительного инфильтрата; последнее (атрофия желудка) представляет собой атрофическую слизистую с отсутствующим или незначительным воспалением, что имеет место после эрадикации Н. pylori или его «самопроизвольного» исчезновения (спонтанной эрадикации) (см. табл. 1; разделы 2.4.3 и 2.4.4).
В фундаментальных исследованиях дохеликобактерной эпохи, текущих научных публикациях и клинической практике принято использовать термин «атрофический гастрит» для обозначения предракового состояния независимо от наличия воспалительного компонента. Два определения (то есть атрофия с воспалением и без него) отражают различные клинико-морфологические варианты заболевания, которые отличаются по степени риска развития рака желудка с необходимостью различных клинических подходов. Данные варианты заболевания с позиции морфологической оценки необходимо различать между собой в виде двух разных фенотипов атрофического гастрита, что особенно важно в клинических исследованиях, где воспаление определяет характер лечения пациента (см. табл. 1).
Эндоскопия высокого разрешения в сочетании с усилением/контрастированием и увеличением изображения (магнификационная эндоскопия) позволяет визуализировать многие признаки гастрита: узловатость (нодулярный характер) слизистой оболочки, отек, размытие вида соединительных венул и наличие увеличенных складок. Эндоскопические доказательства атрофии включают исчезновение желудочных складок и повышенный контраст / лучшую визуализацию сосудов слизистой оболочки. Кишечная метаплазия (КМ) может проявляться в виде серо-белых пятен, а при использовании узкоспектрального изображения – в виде голубых линий, или так называемых голубых гребней [21].
В идеале лечение хронического гастрита (с наличием и без атрофии желез) реализуется путем устранения основного этиологического фактора. Отмена определенных препаратов, эрадикация Н. pylori приводят к заметному регрессу воспаления; атрофия может в некоторой степени регрессировать в зависимости от ее фенотипического варианта и распространенности (см. раздел 2.4.3) [22].
2.1.4. Предраковое состояние определяется как состояние, при котором существует повышенный риск развития опухоли. Гастрит – это предраковое состояние, при котором риск развития опухоли зависит от таких факторов, как этиология и стадия заболевания (уровень согласия: полное согласие – 97%, согласие с незначительными возражениями – 3%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Пренеопластические, или предшествующие развитию неоплазии (синоним: предраковые), состояния – это неопухолевые заболевания, при которых есть повышенный риск развития злокачественных новообразований. Следует отличать предраковые состояния от «поражений». Последний термин более строго относится к морфологическому субстрату (фону, основе), непосредственно участвующему в гистогенезе злокачественных новообразований (например, изменения эпителиальных клеток (интраэпителиальная неоплазия), которые могут прогрессировать до инвазивного рака, или пролиферация энтерохромаффиноподобных (ECL) клеток желудка, которая может дать начало нейроэндокринным опухолям (НЭО) первого типа) (см. раздел 2.5.3).
2.2. Гастрит, вызванный H. pylori
Более половины населения планеты инфицированы H. pylori, которая вызывает длительное воспаление, не проходящее спонтанно, путем самоизлечения. На уровне популяции успешная эрадикация приводит к резкому снижению риска развития рака желудка, ассоциированного с H. pylori [61]. Статус H. pylori можно оценить с помощью неинвазивных и инвазивных тестов. Среди неинвазивных тестов наиболее информативными в отношении наличия текущей инфекции следует признать 13С/14С-уреазный дыхательный тест и тест на антиген H. pylori в кале, тогда как положительный серологический тест не позволяет отличить текущую инфекцию от имевшей место ранее. ДНК бактерии, полученная из биоптатов и из желудочного сока, также позволяет проводить молекулярное тестирование на устойчивость к антибиотикам [23].
После оценки факта наличия колонизации H. pylori проводится так называемая функциональная желудочная серология (то есть пепсиноген I и II, гастрин-17), что помогает организовать мониторинг в зависимости от степени тяжести атрофии
СОЖ [24].
Эндоскопия желудка высокого разрешения позволяет достоверно оценить топографию и протяженность кишечной метаплазии, а также визуализировать наличие очаговых поражений, подлежащих гистологическому исследованию после забора биопсийного материала [22, 25]. Протоколы биопсийного исследования СОЖ всегда включают получение репрезентативных образцов ткани из кислотопродуцирующего компартмента (тело и дно) и слизесекретирующего (антральный отдел и привратник). Забор биопсийного материала угла желудка может дать дополнительную информацию (см. раздел 2.3.1). Оценка по системе мониторинга гастрита OLGA/OLGIM достоверно коррелирует с риском развития рака при H. pylori-атрофическом гастрите, причем этот риск также потенциально можно предположить, оценив кишечную метаплазию неполного типа [7].
2.2.1. Во всем мире H. pylori по-прежнему является основной известной причиной хронического гастрита; его распространенность во многих странах мира снижается, особенно среди молодого населения. Эпидемиологическую значимость других возможных этиологических факторов хронического гастрита в отсутствие H. pylori или после его эрадикации еще предстоит выяснить (уровень согласия: полное согласие – 97%, согласие с незначительными возражениями – 3%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Гастрит – это воспаление, возникающее в результате повреждения СОЖ. Почти у всех инфицированных H. pylori развивается хронический гастрит, но на распространенность и степень воспаления могут влиять факторы окружающей среды, генетические факторы хозяина, время после инфицирования и бактериальные факторы вирулентности.
В связи с постепенным снижением распространенности инфекции H. pylori, что обусловлено как успешной эрадикацией, так и снижением числа новых случаев инфицирования, потребуется больше эпидемиологических исследований, чтобы охарактеризовать относительную долю и важность вклада других этиологических факторов в развитие гастрита [26, 27].
2.2.2. H. pylori-ассоциированный гастрит – хроническое активное воспаление СОЖ, которое при отсутствии эрадикации может персистировать длительное время. Гастрит проявляется в виде различных фенотипов в зависимости от топографического распределения и интенсивности воспаления и атрофии. Осложнениями гастрита могут быть доброкачественные патологические процессы, а также злокачественные опухоли, зависящие от фенотипа гастрита (уровень согласия: полное согласие – 75%, согласие с незначительными возражениями – 25%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Гастрит, вызванный H. pylori, является инфекционным заболеванием, не проходящим самостоятельно, с широким спектром клинических и гистопатологических проявлений. Большинство инфицированных людей остаются бессимптомными, в то время как у других развиваются диспепсические симптомы или осложнения, такие как гастродуоденальные язвы или рак желудка [28].
Гастрит, вызванный H. pylori, определяется и классифицируется как самостоятельное заболевание с характерными морфологическими признаками, наличием топографических и морфологических изменений, связанных с различной степенью инфильтрации нейтрофильными лейкоцитами (активность), мононуклеарным инфильтратом (лимфомакрофагальным) и развитием атрофии желез. Эзофагогастродуоденоскопия (ЭГДС) с биопсией является золотым стандартом диагностики, поскольку позволяет оценить тяжесть гастрита, топографию воспаления и атрофию желез, а также выявить другие изменения слизистой оболочки (например, эрозии, язвы, опухолевый рост) [2].
Подробная информация о гастрите, вызванном H. pylori, и о том, произошло ли уже развитие выраженной атрофии слизистой оболочки, необходима для планирования долгосрочного ведения пациентов. Существует множество доказательств того, что эрадикация бактерии является единственным эффективным методом лечения гастрита, ассоциированного с H. pylori, и может остановить (а иногда и привести к обратному развитию) прогрессирование долгосрочных осложнений, включая рак желудка [4, 29].
2.3. Основные диагностические стратегии (подходы) при H. pylori-ассоциированном гастрите
Уникальные свойства H. pylori позволяют диагностировать инфекцию множеством способов с использованием различных методов, основанных либо на прямой визуализации бактерии при гистобактериоскопии и исследовании в культуре, либо с учетом метаболизма бактерии (13С-уреазный дыхательный тест (13С-УДТ)), иммунных (определение антигена H. pylori в кале) или иммунореактивных параметров (антитела в сыворотке крови) бактерии [28]. Эндоскопия, хотя сама по себе не является достаточной для диагностики H. pylori, незаменима для оценки состояния СОЖ и правильного забора гастробиоптатов.
Неинвазивные тесты, такие как 13C-УДТ и выявление антигенов в кале, определяют текущий H. pylori-статус. Положительный результат теста является показанием к проведению эрадикационной терапии. И наоборот, серологическое определение антител к H. pylori не позволяет различить текущую и имевшую место в прошлом инфекцию и поэтому требует дополнительного подтверждения (с помощью или 13C-УДТ, или чуть менее точного метода с оценкой антигенов в кале) [30].
Для комплексной оценки гастрита необходимо проведение морфологического исследования с прямой визуализацией H. pylori, дополненного определением степени воспаления (низкая или высокая степень) и выраженности атрофии (стадирование). При наличии симптомов тревоги стратегия лечения H. pylori, основанная на эндоскопии в сочетании с морфологическим исследованием, рекомендуется всем пациентам в возрасте 50 лет и старше.
Поскольку морфологическое исследование требует проведения эндоскопии для забора биопсийного материала, возможно получение дополнительных образцов ткани для традиционного микробиологического исследования или молекулярных тестов на устойчивость к антибиотикам, выполняемых на свежих образцах ткани или фиксированных в формалине [28].
2.3.1. Для диагностики и определения стадии гастрита необходимо взять не менее двух биоптатов из антрума и двух биоптатов из тела желудка. Кроме того, должен быть получен биопсийный материал из любых подозрительных участков слизистой оболочки. Образцы биопсийного материала должны быть топографически идентифицированы и представлены в отдельных флаконах. Биопсийный материал из угла желудка, рекомендованный в модифицированной Сиднейской системе, не является обязательным (уровень согласия: полное согласие – 89%, согласие с незначительными возражениями – 9%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Рекомендуется «базовый» набор (стандарт) биопсийного исследования, включающий четыре биоптата: а) два из заранее определенных точек антрального отдела желудка (один биоптат из малой кривизны и один из большой кривизны) или же забор биопсийного материала из тех точек, в которых присутствуют эндоскопически заметные изменения, подозрительные в отношении атрофии или КМ; б) два биоптата из тела желудка, один – из малой кривизны и один – из большой кривизны. Образцы из этих двух отделов, а также любые дополнительные образцы из зон с заметными при эндоскопическом исследовании патологическими изменениями должны быть топографически идентифицированы и доставлены для морфологического исследования [31]. Из очаговых изменений слизистой оболочки, подозрительных в отношении опухолевого роста, всегда следует производить забор биопсийного материала и направлять его в отдельных четко маркированных флаконах для морфологического исследования.
2.3.2. Диагностика атрофического гастрита должна включать данные эндоскопического и морфологического исследований, а также серологического анализа. Как фенотип, так и топография атрофических изменений должны быть отражены в заключении и классифицированы в соответствии с валидированными системами эндоскопического и морфологического стадирования. Диагноз должен быть основан на данных эндоскопии, морфологии и включать доказанную или предполагаемую этиологию, по возможности подкрепленную серологическими данными (уровень согласия: полное согласие – 65%, согласие с незначительными возражениями – 35%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Атрофия желудка – потеря соответствующих (оригинальных) желудочных желез в данном отделе СОЖ. Атрофия является предраковым состоянием. Различные фенотипы атрофических изменений (неметапластическая атрофия, КМ, псевдопилорическая метаплазия) могут сосуществовать и должны регистрироваться (должны быть верифицированы) как эндоскопически, так и морфологически [22, 32].
2.3.3. Эндоскопия высокого разрешения с биопсией желудка необходима и настоятельно рекомендуется для точной диагностики гастрита, его тяжести, распространенности, типа и этиологии (уровень согласия: полное согласие – 91%, согласие с незначительными возражениями – 9%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Для проведения эндоскопии высокого разрешения необходимы: a) показания, включая историю болезни пациента и его информированное согласие; б) соответствующее оборудование; в) технические и подготовительные процедуры (очистка слизистой оболочки, достаточное время осмотра, фиксация обнаруженных находок с фотодокументацией, безопасность) [33]. При исследовании СОЖ с наличием эндоскопически видимых изменений забор биопсийного материала всегда необходим для определения особенностей гастрита (см. раздел 2.3.2) [14].
2.3.4. Как атрофия, так и КМ могут быть распознаны эндоскопически. В заключении следует указать процентную долю пораженной (вовлеченной) СОЖ. В настоящее время такие системы, как EGGIM, Киотский протокол и Kimura-Takemoto, имеют некоторые ограничения (например, при аутоиммунном гастрите (АИГ)), но хорошо согласуются с морфологической оценкой и оценкой риска рака желудка (уровень согласия: полное согласие – 68%, согласие с незначительными возражениями – 32%, качество доказательств – В, сила рекомендации – 1).
Комментарий. ЭГДС должна выполняться в соответствии с актуальными практическими рекомендациями, что имеет решающее значение для достоверного (адекватного) сопоставления данных эндоскопической и морфологической картины (см. раздел 2.3.3) [34]. С учетом тесной связи атрофии с риском развития рака желудка, эндоскопические особенности распространения атрофии слизистой оболочки имеют важное значение [7]. Заключение об атрофии СОЖ, независимо от ее причины, должно включать: 1) топографию (например, распределение по отделам; «закрытая», то есть С-паттерн (С-образная), или «открытая», то есть О-паттерн); 2) распространенность поражения слизистой оболочки; 3) фенотип, который можно характеризовать при магнификационной эндоскопии (например, метапластический или неметапластический).
2.3.5. Существуют данные о том, что распространенность КМ коррелирует с долей неполной КМ. Таким образом, анализ типов КМ может быть использован для интегративной оценки риска развития рака желудка с помощью стадирования по OLGA/OLGIM (уровень согласия: полное согласие – 84%, согласие с незначительными возражениями – 12%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Мультифокальная КМ является вариантом атрофии СОЖ, представляя собой ключевой компонент стартовой площадки для рака желудка [32]. Формирование КМ является биологически и фенотипически гетерогенным феноменом; упрощенная классификация различает полный и неполный варианты КМ [33]. Иммуногистохимические и иммуноцитохимические исследования подтверждают наличие более высокого риска рака желудка, ассоциированного именно с неполной КМ.
В клинической практике, когда количество взятых фрагментов биопсийного материала недостаточно для стадирования OLGA/OLGIM, типирование КМ и определение доли неполной КМ могут рассматриваться в качестве полезной суррогатной оценки для предположения о наличии распространенной КМ. Однако следует отметить, что типирование КМ на основании ограниченного биопсийного исследования может быть клинически ошибочным, и результаты такой оценки следует интерпретировать с осторожностью.
2.3.6. Системы стадирования OLGA и OLGIM могут быть использованы для оценки риска развития рака желудка как кишечного, так и диффузного типа (уровень согласия: полное согласие – 68%, согласие с незначительными возражениями – 30%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Атрофия СОЖ с обширной КМ является основным предшественником рака желудка кишечного типа. И наоборот, предполагается, что диффузный тип рака желудка чаще всего связан с генетическими аномалиями и характеризуется появлением «дисперсно расположенных/дискогезивных» раковых клеток, диффузно инфильтрирующих стенку желудка [35]. Эти два типа рака желудка часто сосуществуют (гетерогенность рака), и диффузный (дискогезивный) вариант может представлять собой вариант дедифференцировки кишечного подтипа [36, 37]. Риск развития рака желудка кишечного типа в значительной степени зависит от распространенности и тяжести атрофического гастрита и КМ и должен быть стратифицирован с помощью таких систем оценки, как OLGA и OLGIM [38]. Однако роль атрофического гастрита и КМ как потенциальных предшественников рака желудка диффузного типа до конца не изучена. В целом стадии высокого риска, оцененные по OLGA и OLGIM, могут быть использованы для предиктивной оценки риска развития как кишечного, так и диффузного рака желудка.
2.3.7. Для оценки риска развития рака желудка рекомендуется проведение эндоскопического исследования с полным осмотром слизистой оболочки и морфологическим исследованием биопсийного материала в соответствии с системами OLGA и/или OLGIM (уровень согласия: полное согласие – 62%, согласие с незначительными возражениями – 21%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Лица с наличием риска развития рака желудка могут быть обследованы с помощью серологических, морфологических методов, проведения эндоскопии с улучшенным изображением. Наилучшим подходом является использование эндоскопии с улучшенным изображением и морфологическое стадирование в соответствии с системами OLGA или OLGIM [20]. Метаанализ показал, что у людей с III–IV стадиями OLGA или OLGIM повышен риск развития рака желудка по сравнению с пациентами со стадиями 0–II. В странах со средним и высоким уровнем заболеваемости раком желудка отношение шансов составило 2,64 (95%-ный доверительный интервал (95% ДИ) 1,84–3,79) для III–IV стадий OLGA и 3,99 (95% ДИ 3,0–5,21) для III–IV стадий OLGIM [39].
2.4. Исходы H. pylori-ассоциированного гастрита
Гастрит, вызванный H. pylori, является специфическим инфекционным заболеванием [12]. Успешная эрадикация бактерии приводит к разрешению активного компонента воспаления (богатого ПЯЛ), тогда как мононуклеарный воспалительный компонент (лимфоциты, гистиоциты и плазматические клетки) уходит медленнее. Полное выздоровление маловероятно, если уже развилась распространенная атрофия (то есть гастрит высокой стадии).
Различные фенотипы гастрита формируются с учетом всех возможных факторов: генотипов H. pylori, генетических особенностей хозяина, факторов окружающей среды и образа жизни (привычек) [7].
2.4.1. Гастрит, вызванный H. pylori, может прогрессировать из неатрофического в атрофический и быть связан с риском развития рака желудка. Тяжесть (выраженность) и степень распространенности хронического атрофического гастрита коррелируют с риском развития рака желудка (уровень согласия: полное согласие – 100%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Сочетание воспаления, богатого ПЯЛ (активного), и мононуклеарных клеток (хронического) может привести к повреждению и возможной утрате собственных желудочных желез (атрофия), которые могут быть замещены мультифокальными островками КМ [19]. В антральном отделе слизесекретирующий эпителий может замещаться клетками кишечного типа (бокаловидными и абсорбтивными). Кислотопродуцирующая слизистая оболочка первоначально может подвергаться псевдопилорической трансформации, потенциально прогрессирующей до кишечного фенотипа (развития КМ) [20, 40]. Атрофия СОЖ считается стартовой площадкой канцерогенеза и развития рака желудка [20, 41]. Неопластические изменения, первоначально ограниченные железистым эпителием (интраэпителиальная неоплазия, синоним: дисплазия), могут со временем трансформироваться в инвазивный рак [42].
2.4.2. Неатрофический гастрит – потенциально обратимое воспалительное заболевание с минимальным риском развития рака желудка. Диагноз должен включать вероятную или предполагаемую этиологию, которая может определить лечение и стратегии профилактики атрофии (уровень согласия: полное согласие – 61%, согласие с незначительными возражениями – 31%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Диагноз неатрофического гастрита ставится на основании эндоскопического и морфологического исследований с исключением атрофии (метапластической и неметапластической), дисплазии и неоплазии (опухолевого роста) [2, 42]. Неатрофические фенотипы представляют собой потенциально обратимые воспалительные поражения, не включенные в предраковый спектр из-за незначительного риска развития рака. В заключении должен быть указан вероятный или предполагаемый этиологический фактор, что поможет определить стратегию лечения [42].
В прошлом неатрофический гастрит называли «поверхностным» (см. раздел 2.4.1), однако в настоящее время этот термин рассматривается как потенциально вводящий в заблуждение, поскольку воспаление, особенно в антруме, часто охватывает всю толщу СОЖ.
Прогрессирование атрофии изучено не до конца, поскольку оно включает в себя как воздействие факторов окружающей среды (например, бактериальная вирулентность), так и факторы, связанные с хозяином. Среди внешних причин инфекция H. pylori является ведущим триггером атрофии, которая первоначально развивается в дистальном отделе желудка, а затем распространяется на кислотопродуцирующий компартмент [43]. Другие агенты окружающей среды (инфекционные и неинфекционные) могут являться этиологическими факторами неатрофического гастрита и влиять как на (дистальную) слизесекретирующую, так и на (проксимальную) кислотопродуцирующую СОЖ (см. раздел 2.7). Примеры включают самоограничивающийся острый гастрит (см. раздел 2.1.2) и другие инфекционные гастриты (см. табл. 2).
В присутствии H. pylori ИПП приводят к усилению воспаления в кислотопродуцирующей СОЖ и могут способствовать прогрессированию атрофии; отсюда рекомендация по эрадикации инфекции H. pylori у пациентов, которым необходима длительная терапия ИПП [44]. Неатрофический гастрит с поражением слизистой оболочки тела желудка может также быть проявлением ранней стадии АИГ (см. раздел 2.5.3) [45].
Баланс этих факторов регулирует выраженность атрофической трансформации СОЖ и время перехода от неатрофического к атрофическому фенотипу гастрита. Понимание сложных механизмов, участвующих в развитии атрофического гастрита, является приоритетной задачей исследований, поскольку ограничение развития и прогрессирования атрофии может стать одним из важнейших шагов в первичной профилактике рака желудка [46].
2.4.3. Существуют серологические, эндоскопические и морфологические доказательства того, что регрессия атрофических поражений может происходить в ответ на удаление этиологического агента. Необходимы исследования для определения наиболее надежного метода оценки и возможного количественного определения наличия и степени регрессии (уровень согласия: полное согласие – 92%, согласие с незначительными возражениями – 8%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Регрессия атрофических поражений может происходить, но обратное развитие атрофии трудно продемонстрировать объективно [47]. Существующая информация основывается на серологических, эндоскопических и морфологических данных, полученных в различных популяциях [48]. Эпидемиологические исследования подтверждают надежность оценки сывороточного пепсиногена I и соотношения пепсиноген I/пепсиноген II в качестве показателей функционального состояния СОЖ [49]. Исходя из этого, серологический показатель (концентрация) пепсиногена был использован в качестве функционального маркера регрессии атрофии после эрадикации. У корейских пациентов успешная эрадикация привела к значительному увеличению соотношения пепсиноген I/пепсиноген II в сыворотке крови (с 3,07 до 4,98, p < 0,001). Отсутствие восстановления (регресса атрофии) было связано с выраженной атрофией желудка и возрастом ≥ 60 лет [50]. С биологической точки зрения регресс атрофии потенциально достижим путем удаления ее предполагаемого этиологического агента(-ов) (см. раздел 2.4.4). Получение доказательств обратимости атрофии ограничено необходимостью проведения проспективных исследований с длительным периодом наблюдения и большой вариабельностью эндоскопических и морфологических критериев оценки регресса. Кроме того, документирование значительного изменения распространения КМ затруднено из-за мозаичности (или неравномерности) поражения СОЖ в сочетании с технической сложностью получения повторных биоптатов из одних и тех же участков [51].
2.4.4. Эрадикация H. pylori останавливает прогрессирование повреждений слизистой оболочки и способствует улучшению структуры и функции желудка (уровень согласия: полное согласие – 82%, согласие с незначительными возражениями – 14%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Эрадикация H. pylori высокоэффективна для остановки и регресса воспаления и других морфологически заметных изменений, особенно при активном H. pylori-ассоциированном гастрите с атрофией или без нее. Рандомизированные контролируемые исследования и когортные исследования показали, что риск развития рака желудка снижается примерно на 50% [52].
Модификация образа жизни и социального поведения, включая сокращение потребления соленых и обработанных продуктов питания [53], отказ от курения [54], избегание чрезмерного употребления алкоголя [55], увеличение в рационе количества свежих овощей и фруктов [56], в сочетании с успешной эрадикацией H. pylori также могут играть важную роль в снижении риска развития рака желудка [57].
2.4.5. Факторы, связанные с ускоренным прогрессированием гастрита, включают штамм H. pylori, вызывающий инфекцию, определенную генетическую предрасположенность хозяина, наличие родственников первой степени родства с раком желудка, а также нездоровый образ жизни и социальные привычки (уровень согласия: полное согласие – 89%, согласие с незначительными возражениями – 8%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Потенциальное этапное прогрессирование гастрита, вызванного H. pylori, начинается с неатрофического хронического активного гастрита и может перейти в атрофический метапластический гастрит, дисплазию и в конечном итоге в рак желудка.
Проспективное исследование, проведенное в Японии, показало, что пятилетний кумулятивный риск развития рака желудка после эрадикации H. pylori составил 0,7; 1,9 и 10% у пациентов с отсутствующим/легким, умеренным и выраженным атрофическим гастритом соответственно [58]. В общенациональном когортном исследовании в Нидерландах ежегодный уровень заболеваемости раком желудка составил 0,1; 0,25; 0,6 и 6% у пациентов с атрофическим гастритом, КМ, легкой/умеренной дисплазией и выраженной дисплазией в начальной исследовательской точке соответственно [59].
Семейный анамнез рака желудка среди лиц первой степени родства связан с ускоренным прогрессированием гастрита [60]. Курение, высокое потребление соли и употребление алкоголя в больших количествах связаны с увеличением риска в 1,7; 2,9 и 1,1 раза соответственно [54, 55]. Выяснение этиологии и естественного течения (эволюции) рака желудка может обеспечить профилактические меры для пациентов и их родственников.
2.4.6. Пациентам с эндоскопическими результатами, которые свидетельствуют о высоком риске развития рака, или III–IV стадией OLGA/OLGIM, и/или распространенной неполной КМ рекомендуется динамическое наблюдение с эндоскопическим/морфологическим исследованием с интервалом один раз в три года или в соответствии с локальными рекомендациями (уровень согласия: полное согласие – 78%, согласие с незначительными возражениями – 11%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Эрадикация H. pylori снижает риск развития рака желудка [52]. Однако пациенты, у которых уже развился атрофический гастрит, вероятно, сохраняют уровень риска, аналогичный тому, который существовал на момент эрадикации H. pylori. В систематическом обзоре и метаанализе сообщается, что частота возникновения рака желудка при атрофическом гастрите и КМ составляет 2,25 (95% ДИ 1,67–2,90) и 7,58 (95% ДИ 4,10–11,91) на 1000 человеко-лет в Азии и 0,74 (95% ДИ 0,13–1,71) и 1,72 (95% ДИ 0,36–3,70) на 1000 человеко-лет в Европе соответственно [61].
Роль эндоскопического исследования при динамическом наблюдении таких пациентов заключается в выявлении предраковых изменений и карциномы желудка на ранней стадии с целью предотвращения развития или снижения уровня смертности от рака.
В европейском исследовании долгосрочного наблюдения ни у одного пациента с OLGA/OLGIM 0–II стадии не развился рак желудка в течение 51 месяца наблюдения [62]. Таким образом, эндоскопическое наблюдение каждые три года для пациентов со стадией III–IV, оцененной по OLGA/OLGIM, представляется достаточным в регионах с низким и средним уровнем заболеваемости раком желудка [63].
Пациенты с дисплазией низкой/высокой степени или ранним раком желудка после эндоскопической резекции слизистой оболочки (мукозальной резекции) или эндоскопической подслизистой диссекции остаются в группе риска по развитию синхронного или метахронного рака желудка, при этом частота заболеваемости составляет от 7,7 до 33,9 на 1000 человеко-лет [64]. Интервал эндоскопического наблюдения после эндоскопической мукозальной резекции в один год, пять лет или 10 лет оказался экономически эффективным для азиатских пациентов, а пять лет или 10 лет был экономически эффективным для пациентов латиноамериканского происхождения в США [65].
2.5. Аутоиммунный гастрит
Доля иммуноопосредованных заболеваний во всем мире растет параллельно со снижением заболеваемости инфекционными заболеваниями. АИГ рассматривается в качестве примера воспалительного заболевания желудка, связанного с организмом человека. Первоначальное иммуноопосредованное воспаление кислотопродуцирующей слизистой оболочки (то есть неатрофический АИГ) обычно прогрессирует до атрофии слизистой оболочки с характерным топографическим фенотипом (атрофия тела) и наличием специфических серологических реакций. Атрофия слизистой оболочки приводит к прогрессирующему снижению секреции кислоты, что вызывает гиперплазию ECL-клеток и может перерасти в НЭО первого типа (см. раздел 2.1.4).
Значительно повышенный риск развития нейроэндокринной неоплазии подтверждает необходимость наблюдения за пациентами с атрофическим АИГ [66].
2.5.1. АИГ – хроническое иммуноопосредованное заболевание с поражением париетальных клеток. Воспаление и атрофия ограничиваются кислотопродуцирующей слизистой оболочкой, что на поздних стадиях приводит к нарушению или отсутствию секреции кислоты (уровень согласия: полное согласие – 92%, согласие с незначительными возражениями – 8%, качество доказательств – А, сила рекомендации – 1).
Комментарий. АИГ – это хронический гастрит, связанный с факторами хозяина, возникает в результате «первичной аутоиммунной реакции», направленной на париетальные клетки желудка (см. табл. 1 и 2). Расположение аутоантигена-мишени ограничивает воспалительное поражение слизистой оболочкой тела желудка; реже, при увеличении протяженности кислотопродуцирующих желез, воспаление распространяется дистальнее, на область угла желудка (см. разделы 2.3.1; 2.3.4) [17].
Этиология и патогенез «первичного АИГ» до сих пор неясны. Основной мишенью аутоантигена является H+/K+-АТФаза (протонный насос) и ее α- и β-субъединицы [67], которые служат мишенью как для антипариетальных клеточных аутоантител [68], так и для аутореактивных Т-клеток [69]. In vivo, вероятно, основная патогенетическая роль в АИГ может быть приписана аутореактивным Т-хелперам и цитотоксическим клеткам, повышающим уровень провоспалительных цитокинов, как предполагалось в экспериментах ex vivo [69]. Однако точный триггер экспансии этих аутореактивных клонов неизвестен.
Гистопатологическим маркером заболевания является его морфологически подтвержденное ограничение пределами кислотопродуцирующей слизистой оболочки. Текущая или предшествующая инфекция H. pylori, при которой поражена слизистая оболочка антрального отдела, может маскировать избирательное поражение тела желудка, приводя к развитию атрофии СОЖ в обоих отделах желудка. Стереотипный характер динамики течения АИГ включает неатрофические и атрофические изменения СОЖ [70]. Однако в большинстве случаев клинико-морфологический диагноз ставится только на поздних стадиях заболевания, когда атрофия желез тела желудка уже состоялась и функциональные изменения стали очевидными.
Диагноз АИГ устанавливается с помощью серологических исследований (аутоантител к париетальным клеткам, внутреннему фактору Касла, пепсиногенов как маркеров прогрессирующей атрофии, гастрина-17), ЭГДС и характерной морфологической картины (см. разделы 2.5.3 и 2.5.4) [71]. Гипоацидность желудка приводит к потере внутреннего фактора с мальабсорбцией железа и витамина В12 и в конечном итоге к пернициозной мегалобластной анемии (см. раздел 2.5.5). Мальабсорбция микроэлементов способствует возникновению опасных для жизни и необратимых осложнений.
2.5.2. Распространенность АИГ различна и, вероятно, растет, особенно в западных популяциях. Эта тенденция должна быть подтверждена в дальнейших хорошо спланированных популяционных исследованиях, исключающих текущую или предшествующую коморбидность с H. pylori (уровень согласия: полное согласие – 77%, согласие с незначительными возражениями – 23%, качество доказательств – С, сила рекомендации – 1).
Комментарий. АИГ является частью спектра аутоиммунных состояний, и его распространенность гораздо выше у пациентов с сопутствующими аутоиммунными заболеваниями, в частности аутоиммунным тиреоидитом и сахарным диабетом первого типа. Среди таких пациентов распространенность АИГ составляет от 10 до 40% [72, 73]. Гистопатологические изменения (атрофия и КМ, нодулярная или линейная гиперплазия ECL-клеток) остаются основой для диагностики АИГ. Необходимость проведения эндоскопического исследования с забором биопсийного материала для подтверждения диагноза исключает возможность проведения крупных популяционных исследований. В связи с этим для оценки могут быть использованы различные суррогатные диагностические маркеры [74, 75]. К ним относятся сывороточные антитела к париетальным клеткам и внутреннему фактору, сывороточный уровень пепсиногенов и гастрина. Исследования, основанные на оценке распространенности АИГ по уровню кобаламина и пернициозной анемии (оба – поздние проявления), обладают низкой чувствительностью. Несмотря на эти методологические трудности, некоторые исследования показали, что распространенность АИГ составляет от 0,1 до 2% в общей популяции [76] и может быть выше у лиц старше 60 лет и среди женщин [70].
Считается, что АИГ не связан с карциномой желудка, за исключением случаев одновременного или предшествующего инфицирования H. pylori [77]. Однако существует определенный риск развития НЭО желудка, связанный с постоянным повышением уровня гастрина в сыворотке крови.
2.5.3. Диагноз аутоиммунного атрофического гастрита может быть поставлен с высокой степенью достоверности на основании эндоскопических, гистопатологических и серологических данных (уровень согласия: полное согласие – 85%, согласие с незначительными возражениями – 15%, качество доказательств – А, сила рекомендации – 1).
Комментарий. АИГ включает неатрофическую и атрофическую стадии [78]. Из-за скудности клинических признаков и симптомов неатрофическая стадия АИГ распознается редко [79]. При переходе от неатрофической к атрофической стадии клинические проявления усиливаются по мере развития серологических, эндоскопических и гистопатологических изменений СОЖ.
Морфологические изменения наиболее специфичны и могут быть использованы как надежные для постановки диагноза. Серологические и гематологические данные полезны для подтверждения диагноза
(см. раздел 2.5.5). Гипохлоргидрия препятствует всасыванию железа, что приводит к железодефицитной анемии; дефицит внутреннего фактора и дефицит кобаламина (витамина В12) лежат в основе мегалобластной анемии, дегенерации дорсальных и боковых столбов спинного мозга вследствие демиелинизации, в дальнейшем приводящей к выраженным неврологическим проявлениям [80].
Наиболее чувствительным сывороточным тестом при АИГ является выявление антител к париетальным клеткам, однако их отсутствие, часто встречающееся у пожилых людей, не исключает АИГ [71]. Обнаружение антител к внутреннему фактору, низкого уровня пепсиногена или высокого уровня гастрина помогает поставить диагноз, но их чувствительность и специфичность низки и должны быть сопоставлены с эндоскопическими и морфологическими находками (см. раздел 2.5.5) [63].
Гистопатологическая картина АИГ характеризуется потерей кислотопродуцирующих желез, сопровождающейся хроническим воспалением и замещением их соединительной тканью. Исчезновение желез тела желудка также сопровождается двумя типами метапластической трансформации – псевдопилорической и КМ [81]. КМ при этом в основном характеризуется полным фенотипом (см. раздел 2.4.6) [82]. Выраженный атрофический гастрит при аутоиммунном воспалении обычно характеризуется гиперпластическими полиповидными изменениями (редко ассоциированными с аденомами пилорических желез) и линейной или узелковой (микронодулярной) гиперплазией ECL-клеток [83, 84].
2.5.4. Предполагается, что у некоторой группы пациентов H. pylori может запускать аутоиммунный процесс, приводящий к атрофии слизистой оболочки тела желудка (уровень согласия: полное согласие – 96%, согласие с незначительными возражениями – 4%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Существуют надежные свидетельства того, что первичный АИГ (не связанный с H. pylori) является реально существующей нозологической единицей. Во множестве серий наблюдений сообщается о более высокой частоте первичного АИГ, особенно в странах с низкой распространенностью инфекции H. рylori [70]. Кроме того, АИГ гораздо чаще встречается у пациентов с аутоиммунными заболеваниями щитовидной железы, болезнью Аддисона, витилиго, целиакией и другими аутоиммунными заболеваниями и у тех, кто имеет гаплотипы HLA-DRB1*03 и HLA-DRB1*04, обычно ассоциированные с аутоиммунными заболеваниями [85]. Роль H. pylori в патогенезе АИГ до сих пор обсуждается, но есть доказательства того, что у части пациентов H. pylori может запускать аутоиммунный процесс, приводящий к атрофии слизистой оболочки тела желудка («вторичный» АИГ). Это может быть связано с перекрестной реактивностью между H. рylori-индуцированными антителами и антигенами протонной помпы в париетальных клетках (антигенной мимикрией) [86]. Согласно этой теории, по крайней мере в ряде случаев H. pylori может выступать в качестве триггера воспалительного процесса, сдвигая его в сторону опосредованного аутоиммунной реакцией повреждения слизистой оболочки тела желудка. Эта гипотеза была подтверждена в крупном популяционном исследовании, показавшем, что одновременная или предшествующая инфекция H. pylori часто встречается у пациентов с АИГ и что антитела к париетальным клеткам могут быть выявлены у пациентов, инфицированных H. pylori [87].
2.5.5. Диагноз АИГ устанавливается при проведении гастроскопии с раздельным взятием биопсийного материала из антрума и тела желудка. Наиболее чувствительным серологическим тестом при АИГ является обнаружение антител к париетальным клеткам (уровень согласия: полное согласие – 92%, согласие с незначительными возражениями – 8%, качество доказательств – А, сила рекомендации – 1).
Комментарий. Для морфологической диагностики АИГ необходимо взять биопсийный материал из антрального отдела и тела желудка в раздельные флаконы (топографически идентифицированные пробирки с биопсийным материалом). На ранней стадии при неатрофическом АИГ все отделы слизистой оболочки могут эндоскопически выглядеть в пределах нормы [78]. В последующей атрофической фазе при эндоскопическом исследовании могут быть обнаружены признаки атрофии в кислотопродуцирующей слизистой оболочке (дне и теле желудка), сглаживание рельефа СОЖ, бледная и тонкая слизистая оболочка, в которой видны подслизистые капиллярные сосуды [63].
Воспаление в теле желудка и атрофия связаны со спектром гиперпластических изменений ECL-клеток, от линейной и узелковой гиперплазии до опухолевой прогрессии с развитием НЭО первого типа (см. раздел 2.5.3). У пациентов с АИГ роль OLGA/OLGIM в прогнозировании эпителиальных неопластических поражений желудка необходимо изучить дополнительно. Поскольку при первичном АИГ антрум не затрагивается, стадия OLGA у таких пациентов никогда не превышает стадию II. Стадии III–IV убедительно свидетельствуют о предшествующей инфекции H. pylori, которая привела к атрофическим поражениям антрума (см. раздел 2.5.7). У этих пациентов с АИГ, имеющих высокую стадию OLGA (связанную с влиянием H. pylori), риск развития неоплазии желудка оценивается в диапазоне от 6,3 до 25% [88]. В связи с отсутствием или скудностью симптомов на ранних стадиях АИГ значительная диагностическая задержка может привести к развитию опасных для жизни и необратимых осложнений [70]. Мальабсорбция микроэлементов при АИГ обусловливает широкий спектр клинических проявлений на поздней стадии при прогрессирующем течении заболевания (см. раздел 2.5.3).
2.5.6. Измерение уровней пепсиногена I, гастрина-17 и соотношения пепсиноген I/пепсиноген II в сыворотке крови являются наиболее точными серологическими тестами для скрининга АИГ на стадии выраженных (поздних) атрофических изменений СОЖ (уровень согласия: полное согласие – 79%, согласие с незначительными возражениями – 21%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Британское общество гастроэнтерологов рекомендовало не использовать биомаркеры в качестве скрининговых инструментов в регионах с низким уровнем заболеваемости аденокарциномой желудка, например, в Великобритании [89]. Такие серологические биомаркеры, как соотношение пепсиногенов I и II, гастрин-17 в сыворотке крови и антитела к H. pylori, уже давно применяются, по отдельности или в комбинации, для выявления атрофического гастрита на поздних (выраженных) стадиях [90]. В обсервационном исследовании, в котором оценивали скрининговые тесты у 28 японских пациентов с морфологически подтвержденным АИГ, положительная прогностическая ценность составила 78,6% для уровня гастрина-17 в сыворотке > 172 пг/мл или при значениях точки отсечения пепсиногена I и соотношения пепсиноген I/пепсиноген II в 14,5 нг/дл и 2,1 соответственно [91]. Вместе с тем необходимы дальнейшие проспективные исследования с включением пациентов, страдающих АИГ, с использованием неинвазивных биомаркеров для определения оптимального долгосрочного ведения таких пациентов.
2.5.7. У пациентов с АИГ следует рассматривать возможность проведения эндоскопического наблюдения. На основании ограниченных данных предлагается интервал в 3–5 лет между исследованиями (уровень согласия: полное согласие – 79%, согласие с незначительными возражениями – 18%, качество доказательств – В, сила рекомендации – 1).
Комментарий. Риск развития нейроэндокринной неоплазии при АИГ связан с повышением уровня гастрина в сыворотке крови (как косвенного показателя атрофии желез тела желудка), способствующим пролиферации нейроэндокринных клеток и потенциально приводящим к развитию НЭО первого типа (также ранее называемых карциноидами желудка) [92]. Оптимальный интервал для эндоскопического наблюдения за пациентами с АИГ не был согласован. В одном небольшом проспективном исследовании был сделан вывод о том, что четырехлетние интервалы являются безопасными и достаточными для выявления ранних неопластических поражений СОЖ [93]. В европейских рекомендациях MAPS II сообщается, что интервалы для эндоскопического наблюдения должны основываться на наличии эпителиальных предраковых изменений с акцентом на наличие эндоскопически или морфологически выявляемых поражений [22].
Исходя из имеющихся данных о незначительном риске развития злокачественных новообразований желудка, связанных с первичным АИГ, предлагается проводить эндоскопическое исследование с биопсией с интервалом 3–5 лет, что больше подходит для раннего выявления НЭО, а не для вторичной профилактики рака желудка.
Заключение
В данной статье представлены положения консенсуса RE.GA.IN., определяющие понятия нормы, гастрита, ассоциированного с Н. pylori, и аутоиммунного гастрита. Благодаря научно обоснованному подходу к отбору и обработке первичных данных ученые и клиницисты, принимавшие участие в обсуждении и разработке консенсуса, создали документ, необходимый для улучшения клинической практики ведения больных гастритом.
D.S. Bordin, PhD, Prof., S.I. Mozgovoy, PhD, Prof., M.A. Livzan, PhD, Prof., Corresponding member of the RAS, O.V. Gaus, PhD, I.V. Maev, PhD, Prof., Academician of the RAS
A.S. Loginov Moscow Clinical Scientific Center
Russian University of Medicine, Moscow
Tver State Medical University
Omsk State Medical University
Contact person: Dmitry S. Bordin, d.bordin@mknc.ru
The most relevant topics related to gastritis were addressed in the work of the international group for the study of gastritis in clinical practice – Real-World Gastritis Initiative (RE.GA.IN.), from the revision of the definition of the disease to clinical diagnosis and assessment of prognosis. The RE.GA.IN. interdisciplinary consensus brought together gastritis scholars from five continents. After active debates on the most controversial aspects, the RE.GA.IN. consensus summarised the existing scientific evidence
in order to develop patient-centred, evidence-based key messages to assist specialist physicians in their daily clinical practice. The ultimate goal of RE.GA.IN. was and remains to contribute to the further improvement of the clinical management of patients with gastritis. This article presents the RE.GA.IN. consensus statements defining the concepts of normality, current concepts of H. pylori-associated gastritis and autoimmune gastritis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.