Диетологические аспекты развития и лечения дивертикулярной болезни
- Аннотация
- Статья
- Ссылки
- English
Дивертикулярная болезнь (ДБ) толстой кишки представляет собой морфокулярное заболевание, морфологическим субстратом которого являются дивертикулы кишечной стенки, а функциональные расстройства формируют симптомокомплекс с последующими вариантами течения болезни [1].
ДБ является очень распространенным заболеванием желудочно-кишечного тракта (ЖКТ) в настоящее время и в основном встречается у лиц пожилого возраста, причем чаще болеют женщины [2].
Дивертикулез может быть врожденным и приобретенным. Наиболее часто встречается приобретенный дивертикулез, который, в свою очередь, может быть:
- пульсационным (появляется вследствие воздействия высокого внутриклеточного давления на измененную стенку кишечника);
- тракционным (возникает при спаечном процессе вследствие тяги на стенку кишечника извне);
- ложным (образуется вследствие выпячивания слизистой оболочки и подслизистой основы через дефект мышечной оболочки стенки кишки) [3].
Факторы риска развития дивертикулярной болезни, связанные с питанием
Приобретенная ДБ ассоциируется с западным образом жизни из-за значительных изменений в структуре питания и образе жизни, возникших в последние годы. Фактически это подтверждается и данными о распространенности ДБ в странах Африки – ДБ в этих странах встречается лишь у 4% населения, что, вероятно, связано с употреблением продуктов с низким содержанием жиров [4–6]. В то же время в странах Азии распространенность ДБ составляет от 8 до 25% [7].
N.S. Painter и D.P. Burkitt [8] впервые предположили, что ДБ является расстройством, которое можно предотвратить изменением характера диеты. Их теория основана на предположении, что пищевые волокна влияют на время прохождения пищи через кишечник и массу стула. В частности, они проанализировали более 1200 человек из Великобритании и сельских районов Уганды и пришли к выводу, что западная диета с низким содержанием клетчатки приводит к уменьшению объема стула и более длительному времени его транзита в кишечнике, что может способствовать повышению внутрипросветного давления и, следовательно, формированию дивертикулярной грыжи [9].
В последующем было установлено, что ДБ действительно связана в первую очередь с диетой с низким содержанием клетчатки, что обусловлено недостатком в рационе питания фруктов, овощей, цельного зерна и бобовых при высоком содержании продуктов животного происхождения и/или рафинированных продуктов. Таким образом, клетчатка обязательно должна присутствовать в диете для больных дивертикулезом и ее недостаток способствует формированию дивертикулов [10]. Ранее существовало мнение, что некоторые продукты (орехи, семена, кукуруза и др.) при попадании в дивертикул могут повредить слизистую оболочку и вызвать воспаление или кровотечение. Однако эта точка зрения не получила объективного подтверждения. Более того, в одном из крупных исследований, включавшем 47 228 мужчин в возрасте 40–75 лет [11], было установлено отсутствие риска развития дивертикулита при потреблении орехов, кукурузы и попкорна. Более того, исследователи показали, что их потребление даже уменьшало риск развития указанной патологии. Клетчатка может препятствовать перфорации толстой кишки вследствие увеличения объема стула и сокращения времени прохождения фекалий благодаря снижению давления на сегмент толстой кишки. Кроме того, клетчатка благотворно влияет на микробиом кишечника и уменьшает воспаление. Люди, потребляющие большое количество нерастворимой клетчатки (например, пшеничных отрубей, бобовых, кожицы фруктов, орехов, семян), имеют примерно на 40% меньший риск ДБ по сравнению с теми, кто потребляет меньшее количество пищевых волокон [12].
Это получило подтверждение и в проспективном исследовании с участием 43 881 мужчины, в котором показано, что диета с высоким содержанием растворимой клетчатки снижает риск развития ДБ [13]. В последующем исследовании, проведенном на большой группе лиц (47 033), оценивали связь между вегетарианской диетой и предположением о роли пищевых волокон в снижении риска развития ДБ [13]. Выявлено, что после длительного наблюдения в течение 11,5 лет у вегетарианцев было отмечено выраженное снижение риска развития ДБ (на 30%) по сравнению с лицами, потребляющими мясо. Кроме того, у лиц, потребляющих более 25 г клетчатки в день, риск госпитализации снижается примерно на 40% по сравнению с лицами, потребляющими менее 14 г клетчатки в день [14]. В совокупности эти данные свидетельствовали о защитной роли клетчатки в развитии ДБ. Тем не менее связь между потреблением клетчатки и ДБ все еще остается спорной. Так, в одном из исследований с участием 2104 человек, в противоположность доминирующей точке зрения о пользе потребления клетчатки, было продемонстрировано, что диета с высоким содержанием клетчатки была связана даже с более высокой распространенностью дивертикулеза. Исследование показало отсутствие связи между запорами, связанными с диетой с низким содержанием клетчатки, и риском развития дивертикулеза. В частности, у субъектов с менее чем семью дефекациями в неделю по сравнению с субъектами с семью дефекациями в неделю был снижен риск развития дивертикулеза. Кроме того, наличие твердого стула было связано и со сниженным риском формирования дивертикулеза, и, таким образом, авторы пришли к выводу об отсутствии связи между количеством потребляемых пищевых волокон и дивертикулезом [15]. Однако подобные результаты единичны, и в большинстве случаев более значимы данные о положительной роли пищевых волокон в профилактике ДБ.
Через кишечную микробиоту опосредуется положительное действие волокон на человека, так как пищевые волокна способствуют увеличению микробного разнообразия вследствие продукции короткоцепочечных жирных кислот (КЦЖК), которые влияют на иммунную систему хозяина, а также на слизистый барьер [16–18]. А КЦЖК, продуцируемые анаэробными кишечными бактериями, являются основным продуктом микробной ферментации углеводов, жиров и белков вследствие сахаролитической ферментации неперевариваемых и адсорбирующихся в тонком кишечнике сложных углеводов (например, фруктоолигосахаридов, сахарных спиртов, резистентного крахмала, инулина и полисахаридов из клеточных стенок растений).
Несмотря на существование противоречивых наблюдений о роли клетчатки, известные эксперты европейских диетологических организаций, а также Американской гастроэнтерологической ассоциации (AGA) рекомендуют высококачественную диету (с высоким содержанием клетчатки из фруктов, овощей, цельного зерна и бобовых и с низким содержанием красного мяса) с целью снижения риска рецидива ДБ [19].
Несмотря на то что люди, придерживающиеся вегетарианской диеты, обычно потребляют больше клетчатки и имеют более низкий риск развития ДБ, формирование болезни зависит не только от потребления клетчатки, но и от других механизмов [20]. Так, установлена значительная корреляция между потреблением красного мяса и развитием ДБ, хотя зависимости «доза – ответ» в этом исследовании обнаружено не было [9].
Соблюдение диеты с низким содержанием клетчатки и высоким содержанием мяса приводит к трехкратному увеличению риска развития ДБ [9]. В другом исследовании установлено, что у людей, употребляющих в пищу большое количество мяса, риск развития правостороннего дивертикулеза на 58% выше, чем у лиц, употребляющих небольшое количество мяса [21]. Фактором наибольшего риска, возможно, является приготовление необработанного мяса с использованием более высоких температур, а также вследствие попадания недостаточно переваренных кусков мяса в толстый кишечник. Вместе с тем имеются и противоположные данные о роли избыточного потребления мяса в развитии ДБ. Так, в исследовании A.F. Peery и соавт. [22] не было обнаружено связи между потреблением красного мяса и ДБ.
Важную роль в профилактике дивертикулита играет поддержание нормальной массы тела. Когортные исследования показали линейное увеличение риска развития дивертикулита при индексе массы тела (ИМТ) выше 25 кг/м2 [23, 24]. Проспективное исследование с участием 623 пациентов показало, что ожирение увеличивает риск дивертикулеза у женщин, но не у мужчин [25]. Кроме этого, ожирение является фактором риска развития дивертикулита из-за провоспалительного эффекта адипокинов и хемокинов жировой ткани [26, 27].
Диета и образ жизни являются ключевыми факторами патофизиологии ДБ, и эти факторы, наряду с ожирением и другими метаболическими нарушениями, тесно связаны с составом кишечной микробиоты [28]. Во многих исследованиях показано, что западноевропейские диеты, а также ожирение связаны с уменьшением микробного разнообразия и изменением микробного состава [9, 29, 30–32].
Среди других факторов риска следует отметить злоупотребление алкоголем и курение. В исследовании «случай – контроль» с участием 2164 пациентов, в том числе 542 пациентов с бессимптомным дивертикулезом, которым была выполнена колоноскопия, было показано, что употребление алкоголя и курение являются факторами риска развития дивертикулеза. Кроме того, эти два фактора риска способствовали формированию преимущественно правосторонних и двусторонних дивертикулов [33].
В большом проспективном исследовании, проводившемся в течение десяти лет в Японии, оценивали 16 возможных факторов риска у 3327 бессимптомных пациентов, прошедших колоноскопию, из общей популяции. В результате показана значительно более выраженная корреляция между дивертикулезом и некоторыми факторами, связанными с нездоровым образом жизни, включая курение, употребление алкоголя и резкое увеличение веса во взрослом возрасте [34].
Однако основополагающие патологические механизмы, способствующие формированию дивертикулов толстой кишки, остаются до конца не ясными. Наиболее вероятным является возникновение заболевания в результате воздействия совокупности факторов: особенностей диеты, состава кишечной микрофлоры, генетической предрасположенности, аномальной подвижности толстой кишки, наличия микроскопических воспалительных изменений [1, 2].
Помимо неправильного питания (ограничение растительной пищи, уменьшение потребления жидкости) объяснением высокой частоты ДБ у людей пожилого и старческого возраста может служить совокупность таких этиологических факторов, как низкая физическая активность [9, 35], гипотония или атония кишечника [35, 36], рост числа аутоиммунных реакций, связанный с ослаблением супрессорной функции тимуса [37], обменно-дистрофические нарушения генетически детерминированной дисплазии соединительной ткани [37–40].
При ДБ наблюдаются воспалительные изменения в стенке дивертикула. Задержка эвакуации содержимого из тела дивертикула через узкую шейку приводит к образованию плотного комка (фекалит). При полной обструкции шейки дивертикула в его теле развиваются процессы воспаления, а в просвете накапливается экссудат. Еcли в результате размягчения фекалита воспалительным экссудатом не происходит эвакуации через шейку в просвет кишки, развивается реактивное воспаление окружающих дивертикул тканей, а затем окружающие ткани пропитываются воспалительным экссудатом. В зависимости от реактивных свойств организма и вирулентности инфекционного агента воспаление может варьировать от незначительного отека окружающей кишку жировой клетчатки до перфорации дивертикула с развитием перитонита [40–42].
При ДБ определяется макроскопическая картина воспаления различной степени выраженности: от хронической лимфоцитарной до выраженной нейтрофильной инфильтрации в зависимости от степени тяжести заболевания. Выработка провоспалительных цитокинов, особенно фактора некроза опухоли (ФНО), значительно увеличивается. Избыточный вес пациентов также может провоцировать развитие воспалительных изменений кишечной стенки в связи с повышенной выработкой адипокинов и хемокинов [27, 43, 44].
По мере уменьшения острого воспаления полного восстановления структурной целостности стенки дивертикула не происходит. Дефекты стенки при этом заполняются грануляционной тканью, которая находится в постоянном контакте с агрессивным содержимым толстой кишки с высокой концентрацией микроорганизмов.
Микробное разнообразие кишечника и роль микробиоценоза при ДБ
В формировании клинических проявлений и развитии осложнений немаловажную роль играют нарушения микробиоценоза толстой кишки и, как следствие, развитие воспалительного процесса и интоксикации [27, 45, 46].
Патофизиологические механизмы, приводящие от бессимптомного дивертикулеза к острому дивертикулиту, по-видимому, сопровождаются увеличением степени нарушения гомеостаза микробиоты [42]. Тем не менее в литературе имеются и противоречивые данные о составе микробиоты при ДБ и исследования, показывающие незначительные изменения состава фекальной микробиоты у пациентов с ДБ. Усиление воспаления при ДБ, как и нарастание тяжести воспаления, также может быть связано с более высоким биоразнообразием фекальной микробиоты [47].
Так, в исследовании G. Barbara и соавт. [48] у пациентов с осложненной и неосложненной формами дивертикулеза по сравнению с группой здоровых лиц в фекалиях было обнаружено снижение кластера Clostridium IV – группы бактерий, которая включает несколько видов с противовоспалительной функцией и способностью продуцировать бутират. У пациентов с ДБ также было снижено количество Fusobacterium и Lactobacillaceae и повышено количество микроорганизмов Akkermansia muciniphila. Интересно, что как кластер Clostridium IV, так и Lactobacillaceae связаны с выраженным противовоспалительным и иммунорегуляторным эффектами, что показано в экспериментальных моделях колита [49–51]. Установлена обратная корреляция между экспансией Akkermansia muciniphila, а также кластера Clostridium IV и макрофагальной инфильтрацией в дивертикулярной области, что свидетельствует об их провоспалительном эффекте, который может лежать в основе возникновения симптомов [52].
Показано, что у пациентов с воспалением кишечника снижено содержание Bifidobacterium adolescentis, Lactobacillus, Phascolarctobacterium, Akkermansia muciniphila, которые способны уменьшать воспаление, воздействуя на провоспалительные медиаторы, такие как C-реактивный белок (СРБ), интерлейкин 6 (ИЛ-6) и ФНО-α [53].
В результате ПЦР-анализа биоптатов слизистой оболочки толстой кишки пациентов с ДБ выявлено значительное преобладание Enterobacteriaceae [54]. Рост энтеробактерий является одним из основных отличительных признаков тяжелого дисбиоза и, как правило, следствием воспаления слизистой оболочки [42, 55]. Результаты исследования состава микробиоты при ДБ дают основание полагать, что изменяется не только количество бактерий, но и слизистый слой. В работе [56] показано, что в образцах кала пациентов с ДБ по сравнению с контрольной группой наблюдается истощение количества Bacteroides fragilis, Collinsella aerofaciens и Сollinsella stercoris. В то же время в большом исследовании с использованием 16S-секвенирования при обследовании 226 пациентов с дивертикулами и 339 лиц без дивертикулов была обнаружена лишь слабая связь между наличием дивертикулов и снижением количества Proteobacteria и Comamonadaceae – бактерий, прикрепляющихся к слизистой оболочке, на основании чего исследователи пришли к выводу о том, что указанные микроорганизмы не играют ключевой роли в развитии дивертикулов [57].
Анализ образцов кала пациентов с ДБ выявил положительную корреляцию между тяжестью вздутия живота и относительной численностью Ruminococcus и отрицательную – между данным симптомом и количеством Roseburia [58]. Следует отметить, что представители рода Ruminococcus ферментируют полисахариды до водорода в кишечнике, в то время как виды, принадлежащие к роду Roseburia, вырабатывают бутират, который усиливает перистальтику кишечника и снижает гиперчувствительность.
Исследование 115 пациентов с ДБ толстой кишки с симптомами кишечной диспепсии выявило, что сниженное количество микроорганизмов Escherichia coli с нормальной ферментативной активностью имело место в 15,9%, лактозонегативных – в 41,5%, кишечной палочки с гемолитическими свойствами – в 58,5% случаев. Энтерококки определены у 29,3%, стафилококки – у 91,5%, грибы рода Candida – у 84,1% пациентов. Условно-патогенные микроорганизмы рода Proteus выделены у 28,1%, синегнойная палочка – у 9,8%, Klebsiella – у 68,3% исследуемых пациентов. Сниженный уровень бифидобактерий обнаружен у 92,7%, лактобактерий – у 95,1% пациентов.
У пациентов с наличием ДБ толстой кишки без симптомов кишечной диспепсии сниженное количество кишечной палочки с нормальными ферментативными свойствами имело место в 24,2%, гемолитическими – в 42,4%, лактозонегативными – в 18,2% случаев. Доля стафилококков составила 39,4%; энтерококки, грибы рода Candida, а также микроорганизмы рода Proteus не были выявлены; условно-патогенные микроорганизмы рода Klebsiella обнаружены в 15,2%; бифидобактерии в нормальном количестве определены у 72,7% пациентов; содержание лактобактерий в 66,6% случаев было в норме.
Степень выраженности дисбиотических нарушений у больных с наличием кишечной диспепсии значительно выше, чем у больных без клинических проявлений. При наличии признаков кишечной диспепсии нарушения микробиоценоза кишечника, соответствующие степени I, установлены у 3,7%, степени II – у 28,1%, степени III – у 68,3% пациентов. В отсутствие клинических проявлений дисбактериоз степени I имел место у 28%, степени II – у 54% и нормальный состав кишечной микрофлоры – у 66,6% исследуемых.
Таким образом, при ДБ толстого кишечника дисбиоз был обнаружен у 88,9% пациентов, при этом у всех имели место симптомы кишечной диспепсии, в то время как у большинства больных с наличием нормального состава кишечной микрофлоры клинические проявления заболевания отсутствовали [59].
Клиническая картина и причины интоксикации при ДБ
Клиническая картина острой ДБ сопровождается болью, тошнотой, вздутием, задержкой стула, частым жидким стулом, нарушением мочеиспускания и рвотой. При остром паракишечном инфильтрате повышается температура, наблюдается выраженная интоксикация. Следует учитывать, что хронические запоры при ДБ сопровождаются болью и вздутием живота, развитием дисбактериоза, нарушениями обменных процессов в организме, токсическим отравлением, нарушениями иммунитета и т.д.
Клинические проявления неосложненного варианта ДБ толстой кишки и синдрома раздраженного кишечника (СРК) имеют много общего: меняющаяся локализация и выраженность болевых ощущений (чередующаяся с болезненными промежутками), нерегулярный стул, флатуленция, метеоризм, тенезмы, нормальные лабораторные показатели [60–62].
В исследовании C.L. Kvasnovsky и соавт. [58] показано, что интенсивность боли при ДБ в значительной степени связана с количеством Cyanobacterium, симптоматика заболевания – с чрезмерным ростом Pseudobutyrivibrio, Bifidobacterium и семейства Christensenellaceae, а общее биоразнообразие микробиома положительно коррелировало с фекальным кальпротектином, который также является показателем воспаления слизистой оболочки кишечника и последующей интоксикации.
Гиперэндотоксинемия является косвенным свидетельством снижения проницаемости стенки кишки. Вместе с этим множественные изменения в стенке кишки формируют новые типы межклеточного взаимоотношения, приводящего при ДБ к развитию острого или хронического неспецифического воспаления с нарушением структуры слизистой оболочки [63].
Установлено повышение уровня эндотоксина, которое тесно взаимосвязано с метаболической активностью кишечной микрофлоры: снижением общего уровня микробных метаболитов, выработки масляной кислоты и повышением анаэробного индекса [64].
При застое кишечного содержимого может быть отравление продуктами белкового обмена. Происходит их гниение и брожение, токсины поступают в кровь, и развивается кишечная аутоинтоксикация за счет индола, сероводорода, скатола, путресцина, кадаверина, вследствие чего возникают метеоризм, разбитость, слабость, быстрая утомляемость, головная боль, снижение аппетита, бессонница, депрессия [46, 65].
Различные этиологические и патогенетические факторы оказываются взаимосвязанными и взаимоотягощающими. Малое потребление пищевых волокон неизбежно ведет к нарушению кишечной флоры, а кишечный дисбактериоз является диагностически значимым критерием дивертикулита и достоверно ассоциирован с абдоминальной болью [38, 66, 67].
Дисбактериоз кишечника обычно связан с дефектами слизистой оболочки и локальной иммунной дисфункцией, и эти нарушения могут способствовать воспалению, ведущему к развитию дивертикулита [27, 68–70].
Диета при ДБ
В профилактике и лечении ДБ большое значение отводится диетотерапии. Причем диетотерапия должна назначаться как при бессимптомном течении болезни, так и при наличии клинических проявлений [1, 2, 42]. Согласно рекомендациям Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых больных ДБ ободочной кишки, терапевтическому лечению подлежат пациенты только с клинически выраженным дивертикулезом [42]. В клинических рекомендациях указано: «Лечение данной формы заболевания не отличается от лечения синдрома раздраженного кишечника, проводится в течение длительного времени с обязательным учетом индивидуальных особенностей и включает коррекцию диеты и назначение селективных спазмолитиков. Как правило, рекомендуется высокошлаковая диета с дополнительным введением в рацион нерастворимых растительных волокон (пшеничные отруби 20–32 г/сут, микрокристаллическая целлюлоза-200)» [26, 42, 62].
В отечественной литературе при лечении ДБ часто встречаются термины «высокошлаковая диета» и «бесшлаковая диета», что фактически подразумевает диету с высоким или низким содержанием пищевых волокон [42, 62, 71].
Соблюдение диеты является важнейшим фактором профилактики и лечения ДБ. С учетом рекомендованного адекватного уровня потребления пищевых волокон в количестве 30 г/сут и рекомендаций Роспотребнадзора [72] о поступлении пищевых волокон в количестве не менее 20 г/сут, в лечебных целях их количество может достигать 40 г и более, но не выше 60 г/сут, то есть основная задача диетотерапии при ДБ – довести потребление пищевых волокон до 40–50 г/сут.
Этиология, патогенез и клиническая картина ДБ определяют характер рекомендуемого специализированного питания, которое должно быть нацелено на решение следующих задач [20, 42, 73–76]:
- дополнительное насыщение рациона питания пищевыми волокнами (до 40–50 г/сут);
- обеспечение оптимальной пищевой и энергетической ценности рациона;
- купирование нутритивной недостаточности, характерной для лиц пожилого возраста;
- устранение витаминного и микроэлементного дисбаланса;
- улучшение детоксикационной функции печени и антиоксидантной защиты;
- восстановление и поддержание микробиома;
- для пациентов с ИМТ ≥ 30 кг/м² и низкой физической активностью требуются профилактика ожирения и снижение массы тела;
- укрепление и восстановление стенок тонкого и толстого кишечника;
- укрепление сосудистых стенок тонкого кишечника;
- уменьшение газообразования.
Для реализации поставленных задач необходимо соблюдать определенные диетологические рекомендации [73, 74, 77]. При бессимптомном течении заболевания рекомендуется придерживаться основного варианта диеты, обеспечивающего дополнительное употребление продуктов, содержащих пищевые волокна [1, 26, 42, 62].
При наличии жалоб, характерных для СРК, а также при остром течении болезни или обострении хронического течения следует использовать щадящую диету с постепенным добавлением растительных пищевых волокон более щадящего состава с соблюдением следующих рекомендаций [3, 71, 74, 78]:
- уменьшить потребление соли (< 6 г/сут);
- соблюдать водный режим;
- употреблять измельченные продукты, овощи – после термической обработки;
- следить за регулярностью приемов пищи и ее полноценностью (во избежание развития гипомоторной дискинезии кишечника);
- тщательно пережевывать пищу;
- придерживаться дробного питания (5–6 раз в сутки);
- употреблять маложирные или обезжиренные молочные продукты;
- исключить употребление фастфуда, трансжиров, пряностей;
- ограничить порции белковых блюд (мяса, рыба, творог) до 100 г на прием, так как большие порции могут приводить к газообразованию;
- исключить жареную пищу и продукты, усиливающие процессы брожения в кишечнике и стимулирующие желчеотделение;
- исключить газообразующие продукты (газированные напитки);
- увеличить потребление продуктов, содержащих пищевые волокна (при адекватном потреблении пищевых волокон продолжительность кишечного транзита уменьшается до 34 часов, масса фекалий увеличивается до 300 г в сутки и более, значительно снижается внутрикишечное давление);
- в период острой стадии заболевания и клинически выраженного воспалительного процесса в кишечнике следует ограничить употребление нерастворимой клетчатки, увеличить потребление белка до 1,5 г/кг массы тела;
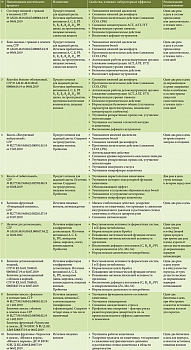
- обеспечить детоксикацию питанием (таблица).
При отсутствии противопоказаний введение в пищу большого (20–35 г/сут) количества отрубей, содержащих пектин, целлюлозу, гемицеллюлозу, лигнин, неперевариваемые полисахариды, альгинаты, позволяет увеличить объем каловых масс, уменьшить время их транзита и соответственно снизить внутриполостное давление. При этом следует учитывать, что лактулоза не оказывает положительного воздействия на внутриполостное давление [73]. Добавление растительной клетчатки (отрубей, зерновых) выше адекватного уровня потребления должно осуществляться постепенно в течение двух – четырех недель от 5–10 до 20 г/сут [73] вплоть до 20–35 г/сут [3, 42, 62], но не более рекомендованной Роспотребнадзором нормы [72].
Щадящую диету необходимо соблюдать кратковременно только в период обострения, а в период ремиссии – переходить на обычный рацион, следуя правилам здорового питания и уделяя особое внимание регулярности стула [74,78].
Эффективными диетическими средствами в терапии ДБ толстой кишки являются отруби. Пшеничные отруби грубого помола среди отрубей из других продуктов обладают максимальной способностью увеличивать объем стула и снижать внутриполостное давление [61, 73]. Однако увеличение их потребления может приводить к усилению абдоминальных болей [74]. В связи с этим следует уделять внимание разным видам пищевых растительных волокон, добавляя в рацион фрукты, овощи и зерновые (овсяные, льняные, гречневые, ячменные) [20, 61, 73, 74]. Использование пищевых волокон из семян подорожника, овса, льна благодаря высокому содержанию в них слизи обеспечивает их более мягкое действие и лучшую переносимость [26, 61, 62], их можно добавлять в супы, каши, напитки. При неосложненной форме ДБ рекомендуется их постоянный прием (с возможными перерывами в летне-осенний период, когда в рацион питания включается много свежих овощей, фруктов, зелени). Кроме этого, полезны чернослив, курага, инжир [74, 78].
Пациентам рекомендуется включать в рацион пшеничный хлеб из муки грубого помола, с отрубями, рассыпчатые каши из гречневой и льняной крупы и пшеницы и растительные масла, овощные супы на мясном бульоне, свекольные и морковные запеканки, при хорошей переносимости – отварные и сырые овощи и фрукты. Рекомендуются кисломолочные продукты (кефир, простокваша, сметана, ряженка). При абдоминальных болях, особенно в сочетании с метеоризмом, из рациона необходимо исключить пряности, грибные навары и грибы, цельное молоко, капусту, бобовые, кислые сорта ягод и фруктов, черный хлеб [61, 73].
Для профилактики стаза у пациентов с дивертикулитом необходимо следить за регулярностью стула, уделяя особое внимание употреблению продуктов, стимулирующих двигательную активность кишечника [74]: утром натощак воды с медом, отвара шиповника, киселей и компотов; овощных и фруктовых соков; вареных сухофруктов и ягод; тертой свеклы и моркови; рассыпчатых каш.
Для устранения запоров в первую очередь необходимо рекомендовать увеличение в рационе растительных волокон, достаточный прием жидкости (до 1500–2500 мл), увеличение физической активности. Из рациона исключаются вяжущие и задерживающие перистальтику кишечника пищевые продукты: нежные сорта белого хлеба, мучнистые супы, манная и рисовая каши, макароны, какао, шоколад, крепкий чай, черный чай, красное вино. Применение слабительных средств, действие которых основано на усилении моторики, противопоказано. Слабительные раздражающего действия у больных с дивертикулезом толстой кишки могут вызывать повышение внутрикишечного давления и провоцировать возникновение болей [61, 73].
При повышенном газообразовании необходимо исключить из рациона газированные напитки, взбитые сливки, кефир. Целесообразно ограничить продукты, стимулирующие газообразование: блюда с большим содержанием жира, цельное молоко, бобовые, брокколи, белокочанную, спаржевую и цветную капусту, орехи, сладкие яблоки, дыни, бананы, пшеничные ростки, макаронные изделия, артишоки, дрожжи, мед, сахар, лук-порей, горчицу, газированные напитки [73, 74, 78].
Существенную роль в лечении и профилактике заболевания играют качество и режим питания. Согласно современным рекомендациям [79], нутрициологическая профилактика и коррекция образа жизни являются базисной лечебной тактикой для пациентов с заболеваниями ЖКТ. Важную роль в этом процессе играет использование биологически активных компонентов лекарственных растений, нормализующих аппетит, улучшающих процессы секреции и всасывания, благоприятно влияющих на защитные процессы в слизистой ЖКТ, деятельность нервной и эндокринной систем, регулирующих процессы пищеварения [80, 81], так как обычные рационы питания, к сожалению, не полностью обеспечивают поступление в организм важнейших микронутриентов, необходимых для многих регуляторных процессов, которые нарушены при заболеваниях ЖКТ. Высокая актуальность применения лечебного и профилактического питания в лечении и предупреждении развития заболевания, а также предупреждении обострений определила применение специализированных пищевых продуктов диетического лечебного и диетического профилактического питания [82].
Практический подход к выборулечебного питания при ДБ
С целью соблюдения диетических рекомендаций, особенно в домашних условиях, разработаны специальные диетические продукты лечебного и профилактического питания (таблица).
- При бессимптомном течении ДБ и в период ремиссии, для профилактики обострения целесообразно включать в рацион продукты с адекватным содержанием пищевых волокон. Для этого могут быть рекомендованы отруби, мультизлаковые зерновые батончики, зерновые смеси с добавлением отрубей, в том числе отруби пшеничные, овсяные, ржаные, гречневые мелкого помола. Все продукты следует хорошо пережевывать, употреблять малыми порциями и запивать водой.
Для предотвращения развития и обострения ДБ у людей с избыточной массой тела целесообразно использовать в качестве перекусов специализированные продукты диетического профилактического питания «Батончик-мюсли с яблоком и семенем льна», «Батончик-мюсли с черникой и зеленым кофе», «Батончик-мюсли с фенхелем и зеленым чаем», являющиеся источником пищевых волокон. Регулярное употребление этих продуктов способствует нормализации стула, снижению уровня глюкозы в крови [76, 83]. Рекомендуемые для диетического питания фрукты и овощи (чернослив, курагу, инжир, свеклу, морковь) можно употреблять в виде сухофруктов или в виде фруктово-овощных батончиков, выпускаемых российской промышленностью [76] (батончики GET RAW «Чернослив и свекла», «Яблоко и морковь», «Яблоко и курага», которые следует рассматривать в качестве перекуса или десерта) [76].
- Вне зависимости от клинического течения ДБ, с учетом токсичности содержимого дивертикула, для снижения токсического влияния эндо- и экзотоксинов, образующихся в просвете кишечника и в особенности в дивертикуле, а также антиоксидантной защиты, обеспечения организма витаминами (С, B2, B6, PP), микроэлементами (Zn, Mn, Se), пищевыми волокнами, нормализации функции печени и цикла Кребса целесообразно использовать специализированный продукт диетического лечебного и диетического профилактического питания «Напиток для детоксикации». Этот продукт содержит природные коферменты и кофакторы I и II стадии метаболизма экзо- и эндобиотиков, витамины, микроэлементы, регуляторы цикла Кребса, антиоксиданты, гипоксанты, энерготоники, растворимые пищевые волокна, слизистые вещества, пребиотики и обеспечивает выраженную детоксикацию организма благодаря:
- восстановлению работы ферментных систем, I и II фазы метаболизма детоксикации;
- повышению антитоксической функции печени;
- повышению антиокислительной активности организма;
- восполнению дефицита витаминов и микроэлементов, участвующих в работе ферментных систем детоксикации.
Для снижения уровня эндогенной и экзогенной интоксикации рекомендован прием продукта «Напиток для детоксикации» один-два раза в день: утром на завтрак и днем в обед, курсом от трех до шести месяцев до нормализации маркеров интоксикации (аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), каталазы, билирубина, гамма-глутамилтрансферазы (ГГТ), щелочной фосфатазы, СРБ) и нормализации микробиома [84, 85].
Кроме этого, целесообразно использовать специализированные продукты профилактического питания – батончики зерновые «Детоксикационный» с разными вкусами, которые, кроме мультизлаков и повышенного содержания пищевых волокон, содержат детоксикационный премикс, обеспечивающий процессы детоксикации [65, 76].
- Вследствие изменения кишечного микробиома при ДБ лечебной мерой является коррекция дисбиоза, предполагающая комплексный подход и в первую очередь патогенетическое лечение основного заболевания с обязательным восстановлением нарушенных функций кишечника. При купировании моторно-эвакуационных расстройств кишечника нормализуется окислительно-восстановительный потенциал внутриполостной среды и, как следствие, баланс аэробных и анаэробных популяций микроорганизмов. Мероприятия по коррекции дисбиоза толстой кишки предусматривают использование пре-, про-, син- и метабиотиков. Пребиотики ферментируются кишечной микробиотой, генерируя различные метаболиты, играющие важную роль в восстановлении и функционировании микрофлоры, улучшают состояние слизистой оболочки, укрепляют защитные функции эпителия, нормализуют иммунный ответ [46, 86]. В связи с этим в диетотерапии целесообразно использовать специализированные лечебные продукты со свойствами пребиотиков, содержащие лактозу, олигополисахариды, пектин, инулин, другие пищевые волокна, в том числе специализированные лечебные диетические и профилактические продукты: Кисель «Желудочный нейтральный» ЛЕОВИТ, Кисель «Слабительный» ЛЕОВИТ, Напиток для детоксикации и Кисель «Общеукрепляющий» ЛЕОВИТ. Инулины и пектины содержатся также в специализированных продуктах лечебного диетического питания «Каша с травами и семенем льна» и «Суп-пюре овощной с травами и овсянкой» [87–90]. Эти продукты могут уже входить в состав меню для механического и химического щажения или употребляться самостоятельно один-два раза в течение дня.
- При остром течении болезни или обострении хронического течения целесообразно использовать лечебное питание, обеспечивающее поступление в организм необходимых нутриентов, соблюдение режимов химического и механического щажения, снижение альбуминемии, дробность, умеренность при приеме пищи, низкое содержание поваренной соли. Это достигается включением в рацион специализированных пищевых продуктов диетического лечебного и диетического профилактического питания ЛЕОВИТ GASTRO при болезнях ЖКТ:
- Суп-пюре овощной с травами и овсянкой, обладающий противовоспалительным действием, снижающий явления диспепсии;
- Каша овсяная с травами и семенем льна с обезболивающим, защитным действием, снижающая проявления диспепсии;
- Коктейль белково-облепиховый, способствующий эпителизации слизистой, повышающий уровень белка и альбумина в крови;
- Кисель желудочный нейтральный, снижающий диспепсические проявления и воспаление, улучшающий состав микробиома.
Эти продукты имеют повышенное содержание растворимых и нерастворимых пищевых волокон для нормализации моторно-эвакуаторной функции кишечника, способствуют уменьшению явлений диспепсии, значительному улучшению общего состояния пациента, уменьшению болей, снижению дискомфорта, снижению воспаления, концентраций в плазме крови АСТ, АЛТ, ГГТ, СРБ и скорости оседания эритроцитов (СОЭ), снижению уровня глюкозы в крови и холестерина, увеличению уровня альбумина в крови и повышению качества жизни [87, 90–92].
Лечебное питание употребляется как дополнение к диетическому меню в любой прием пищи или самостоятельно:
- на завтрак – Каша овсяная с травами и семенем льна;
- на второй завтрак – Кисель «Желудочный нейтральный»;
- на обед – Суп-пюре овощной с травами и овсянкой, Коктейль белково-облепиховый;
- на ужин – Каша овсяная с травами и семенем льна.
Перед сном при желании пациента применяется на выбор Коктейль белково-облепиховый или Кисель «Желудочный нейтральный» [76, 87–92].
В качестве дополнения допускается использование блюд оптимизированного состава для основных вариантов стандартных диет, применяемых в лечебном питании в медицинских организациях России, включая отварные или запеченные блюда из мяса, птицы, рыбы, творога, яиц, овощей, кисломолочные продукты [78].
- Для обеспечения адекватного потребления пищевых волокон в период обострения рекомендуется употреблять продукты лечебного питания, обеспечивающие щадящее воздействие – содержащие растворимые пищевые волокна: инулины, пектины, альгинаты. Можно рекомендовать Кисель «Слабительный», который постепенно к третьему дню употребления повышает частоту дефекации, уменьшает метеоризм, улучшает копрологические показатели и показатели кишечного микробиота [76]. Батончик фруктовый «Очищающий комплекс» является источником пищевых волокон благодаря содержанию фруктов и овощей (яблока, кураги, чернослива, моркови, сельдерея, свеклы) и обеспечивает улучшение моторно-эвакуаторной функции кишечника [76, 83, 93].
Заключение
ДБ имеет сложный патофизиологический механизм развития с формированием широкого спектра клинической картины. Заболевание сопровождается выраженными процессами воспаления, нарушениями в кишечном микробиоценозе, снижением иммунной функции слизистой кишечника, что обусловливает формирование выраженной интоксикации организма.
Важнейшим фактором эффективной терапии ДБ является диетотерапия с применением эффективных специализированных продуктов питания, содержащих комплекс компонентов, нормализующих обменные процессы в организме, снижающих интенсивность воспалительных, интоксикационных процессов, восполняющих дефицит важнейших микронутриентов и биологически активных веществ. В распоряжении врачей и пациентов в настоящее время имеется широкий арсенал диетологических мероприятий, которые направлены на повышение эффективности стандартной фармакотерапии и получение благоприятного исхода болезни. Соблюдение диеты пациентами достаточно сложный процесс, и, несмотря на это, отечественная промышленность выпускает широкий ассортимент специализированных диетических лечебных и профилактических продуктов питания, позволяющих повысить качество жизни пациентов с ДБ.
T.L. Pilat, PhD, O.N. Minushkin, PhD, Prof., L.B. Lazebnik, PhD, Prof.
Izmerov Research Institute of Occupational Heals, Moscow
Central State Medical Academy of Department of Presidential Affairs, Moscow
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Tatyana L. Pilat, tpilat@leovit.ru
A review of the literature is devoted to the importance of nutritional support in the treatment and prevention of diverticular disease (DD) of the intestine. The article presents modern data on the mechanisms of development of DD, risk factors for its formation. The role of dietary disorders in the disease, the significance of such nutritional disorders as a lack of dietary fiber in the diet, excessive consumption of red meat, excessive consumption of alcohol and smoking are described. Changes in the intestinal microbiocenosis, which form the development of dysbacteriosis, leading to inflammatory changes, impaired immune functions of the intestine, which is accompanied by severe intoxication of the body, are described in detail. A special place in the article is given to the principles of dietary support for patients with DD, the need for which is due to intoxication of the body, disturbances in the microbiocenosis, nutritional micronutrient deficiencies, etc. Detailed data are given on the main components of food products that play a key role in the prevention and treatment of patients with DD.
A special section of the article is devoted to the use and effectiveness of specialized dietary products for therapeutic and preventive nutrition of domestic production ("LEOVIT nutrio") and the features of their use in DD.
The authors provide information on the composition of dietary products, their detoxifying, anti-inflammatory, antioxidant, immunotropic and other activities that underlie clinical efficacy. A detailed description is given of the positive properties of domestic nutrition in DD, in particular, their ability to saturate the diet with dietary fiber, provide optimal nutritional and energy value of the diet, eliminate nutritional micronutrient deficiencies, improve the detoxification function of the liver, and restore intestinal microbiocenosis. The article provides detailed practical recommendations on the use of specialized dietary foods in DD.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.