Перспективы применения растворимых пищевых волокон в диетотерапии пациентов с заболеваниями сердечно-сосудистой системы
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить эффективность диетотерапии, обогащенной растворимыми ПВ (РПВ) у пациентов с гиперлипопротеидемией (ГЛП).
Материал и методы. В клинике ФГБУН «ФИЦ питания и биотехнологии» проведено открытое одноцентровое проспективное исследование. Оценивалась переносимость и эффективность диетотерапии, обогащенной РПВ, с суточным количеством ПВ в диете 22–35 г в день. Контроль эффективности проводился по динамике параметров функциональной активности сердечно-сосудистой системы (ССС), антропометрии и липидограммы.
Результаты. Исследование показало хорошую переносимость проведенных курсов диетотерапии с включением в нее растворимых пищевых волокон и в виде альгинатов (как в чистом виде, так и в виде биологически активных добавок к пище), и в виде волокна акации. Эффективность диетотерапии оценивалась прежде всего по динамике параметров липидограммы. Наиболее выраженное гиполипидемическое воздействие со статистически значимой редукцией всех ключевых параметров липидограммы: общий холестерин (ОХС), триглицериды (ТГ), холестерин липопротеинов низкой плотности и коэффициент атерогенности – выявлено у пациентов, получающих в дополнение к базовой диетотерапии РПВ в виде волокна акации с общим суточным количеством ПВ в диете 35 г. При этом именно на такой дозе применения ПВ зафиксирована в равной степени выраженности редукция исходного уровня и ОХС, и ТГ. Это обусловливает целесообразность применения ПВ в дозе 30–35 г в день при всех типах атерогенных дислипидемий: IIА, IIБ и IV.
Заключение. Резюмируя результаты исследования, можно сделать вывод, что обогащение базового антиатерогенного рациона нутриентами гиполипидемического действия сопровождалось выраженным оптимизирующим воздействием на показатели клинического статуса и параметры липидограммы крови, т.е. способствовало существенному усилению эффективности диетотерапии. Таким образом, в комплексе лечебных мероприятий пациентам с заболеваниями ССС для коррекции параметров липидограммы и других биомаркеров пищевого статуса целесообразно применение диетотерапии, обогащенной биологически активными веществами направленного гиполипидемического действия.
Цель – оценить эффективность диетотерапии, обогащенной растворимыми ПВ (РПВ) у пациентов с гиперлипопротеидемией (ГЛП).
Материал и методы. В клинике ФГБУН «ФИЦ питания и биотехнологии» проведено открытое одноцентровое проспективное исследование. Оценивалась переносимость и эффективность диетотерапии, обогащенной РПВ, с суточным количеством ПВ в диете 22–35 г в день. Контроль эффективности проводился по динамике параметров функциональной активности сердечно-сосудистой системы (ССС), антропометрии и липидограммы.
Результаты. Исследование показало хорошую переносимость проведенных курсов диетотерапии с включением в нее растворимых пищевых волокон и в виде альгинатов (как в чистом виде, так и в виде биологически активных добавок к пище), и в виде волокна акации. Эффективность диетотерапии оценивалась прежде всего по динамике параметров липидограммы. Наиболее выраженное гиполипидемическое воздействие со статистически значимой редукцией всех ключевых параметров липидограммы: общий холестерин (ОХС), триглицериды (ТГ), холестерин липопротеинов низкой плотности и коэффициент атерогенности – выявлено у пациентов, получающих в дополнение к базовой диетотерапии РПВ в виде волокна акации с общим суточным количеством ПВ в диете 35 г. При этом именно на такой дозе применения ПВ зафиксирована в равной степени выраженности редукция исходного уровня и ОХС, и ТГ. Это обусловливает целесообразность применения ПВ в дозе 30–35 г в день при всех типах атерогенных дислипидемий: IIА, IIБ и IV.
Заключение. Резюмируя результаты исследования, можно сделать вывод, что обогащение базового антиатерогенного рациона нутриентами гиполипидемического действия сопровождалось выраженным оптимизирующим воздействием на показатели клинического статуса и параметры липидограммы крови, т.е. способствовало существенному усилению эффективности диетотерапии. Таким образом, в комплексе лечебных мероприятий пациентам с заболеваниями ССС для коррекции параметров липидограммы и других биомаркеров пищевого статуса целесообразно применение диетотерапии, обогащенной биологически активными веществами направленного гиполипидемического действия.


Введение
Растет интерес к изучению возможностей влияния пищевых волокон на концентрации липидов крови. Установлены различные механизмы их воздействия на липидный обмен: связывание с желчью, подавление абсорбции глюкозы и липидов, увеличение производства короткоцепочечных жирных кислот (КЦЖК) и модуляция генов, связанных с липидным обменом. Кроме того, пищевые волокна (ПВ), классифицируемые как седьмое питательное вещество, являются безопасными в применении. По многочисленным литературным данным [1–2], ПВ могут быть использованы в качестве альтернативных добавок для коррекции нарушений обмена веществ в целом и липидного обмена в частности. Тем не менее для подкрепления этого предположения необходимо больше клинических данных, в том числе для изучения механизмов и направлений воздействия. Только полное понимание механизмов и соотношений доз каждого вида ПВ позволит применять их в лечении пациентов с гиперлипопротеидемией [3–6].
Исходя из описанного, в клинике ФГБУН «ФИЦ питания и биотехнологии» было проведено исследование, цель которого – оценить эффективность диетотерапии, обогащенной растворимыми ПВ (РПВ) у пациентов с гиперлипопротеидемией.
Материал и методы
Проведено открытое одноцентровое проспективное исследование в отделении сердечно-сосудистой патологии и диетотерапии ФГБУН «ФИЦ питания и биотехнологии».
Критерии включения:
- возраст не менее 18 и не более 85 лет;
- наличие избыточной массы тела или ожирения;
- патология сердечно-сосудистой системы: ишемическая болезнь сердца (ИБС) (постинфарктный кардиосклероз, стабильная стенокардия напряжения ФК I–III), выраженный системный атеросклероз, гиперлипопротеидемия;
- информированное согласие, подписанное прежде, чем какая-либо процедура исследования будет произведена.
Критерии невключения:
- беременность, кормление грудью;
- лечение каким-либо другим исследуемым препаратом в течение последних 30 дней перед включением в данное исследование;
- анемия;
- лихорадка;
- обострение хронического заболевания;
- хроническая почечная недостаточность;
- острая и/или декомпенсированная хроническая сердечно-сосудистая патология;
- сахарный диабет первого или второго типа, инсулинотерапия;
- применение биологически активных добавок (БАД) к пище.
В результате скрининга в исследование было включено 128 пациентов с заболеваниями сердечно-сосудистой системы и гиперлипопротеидемией. Отбирали в клиническую часть исследования по результатам клинико-инструментального обследования, анализа липидограммы крови, выявления основных факторов риска сердечно-сосудистых заболеваний (ССЗ), оценки риска фатальных и нефатальных сердечно-сосудистых осложнений по шкале SCORE, исключения/верификации субклинического и клинически значимого атеросклероза (по данным инструментальных методов обследования) и определения категории риска сердечно-сосудистых осложнений.
Основные критерии диагностики гиперлипопротеидемии (ГЛП): повышенный уровень в сыворотке крови общего холестерина (≥ 5,0 ммоль/л), триглицеридов (ТГ) (≥ 1,7 ммоль/л) и ХС ЛПНП (выше индивидуальных целевых параметров, определенных каждому пациенту согласно его категории риска сердечно-сосудистых осложнений).
В соответствии с программой GCP при проведении всех исследований было получено одобрение Комитета по этике ФГБУН «ФИЦ питания и биотехнологии» и информированное согласие каждого пациента на участие в исследовании.
Для изучения эффективности гиполипидемического действия разных источников РПВ исследование было проведено в три этапа.
Первый этап заключался в изучении эффективности применения РПВ в виде альгинатов (бурых морских водорослей). Исследование проведено с участием 40 больных с ССЗ, ожирением (Ож) и ГЛП, разделенных на две репрезентативные группы по 20 человек в каждой: основную и группу сравнения.
В основную группу (ОГ) вошли 17 женщин и 3 мужчины в возрасте от 18 до 66 лет, в группу сравнения (ГС) – 18 женщин и 2 мужчины в возрасте от 26 до 64 лет.
Все пациенты в течение трех недель исследования получали низкокалорийную диету (НКД). Больные ОГ дополнительно получали продукт, являющийся пищевым источником альгинатов – ламинарию гомогенизированную, по 50 г (две столовые ложки) два раза в день (на второй завтрак и полдник). Доза альгинатов составила 6 г в сутки. Общее количество ПВ – 26 г в день.
Второй этап состоял в оценке эффективности БАД – источника альгинатов. В исследовании также приняло участие 40 больных с ССЗ, Ож и гЛП, разделенных на две репрезентативные группы по 20 человек в каждой: основную и группу сравнения.
В ОГ включили 20 женщин с Ож и гЛП, в возрасте 54,4 ± 0,95 года, в гС – 20 женщин с Ож и гЛП, в возрасте 55,3 ± 0,83 года.
Все пациенты в течение трех недель исследования получали НКД. Больные ОГ на фоне НКД получали БАД, содержащую бурые морские водоросли – ламинарию, по две таблетке в день. Доза альгинатов составила 2 г в день. Общее количество ПВ в диете – 22 г. Третий этап – в оценке эффективности растворимого волокна акации (фибрегама). В нем приняло участие 48 больных с ССЗ, Ож и гЛП, разделенных на три репрезентативные группы.
Больные всех трех групп (по 16 человек в каждой группе) в течение трехнедельного периода исследований в стационарных условиях получали НКД с включением растворимого волокна акации, смеси РПВ и мальтодекстрина. Распределение больных по группам происходило лотерейно.
Первую группу составили 4 мужчины и 12 женщин в возрасте 55,9 ± 0,63 года, вторую группу – 3 мужчины и 13 женщин в возрасте 57,9 ± 2,33 года, третью группу – 2 мужчины и 14 женщин в возрасте 54,2 ± 0,63 года.
РПВ и смесь РПВ добавлялись к диете в количестве двух пакетиков в день (по 7,5 г каждом) для каждого пациента в третье блюдо в обед (компот или сок). Общее содержание ПВ в диете составило 35 г в день.
НКД – диета со значительным ограничением количества жиров и легкоусвояемых углеводов, нормальным содержанием белка и сложных углеводов, увеличенным количеством ПВ. Ограничивается поваренная соль (до 3–5 г/день). Блюда готовят в отварном, тушеном, запеченном, протертом и непротертом виде, на пару. Температура пищи – от 15 до 60–65 ºС. Свободная жидкость – 0,8–1,5 л. Ритм питания дробный, 4–6 раз в день.
Химический состав диеты: белки – 70–80 г (в том числе животные 40 г), жиры общие – 60–70 г (в том числе растительные 25 г), углеводы общие – 130–150 г, ПВ – 30 г, энергетическая ценность – 1350–1550 ккал в сутки (табл. 1).
Базовая фармакотерапия пациентов включала ингибиторы ангиотензинпревращающего фермента (АПФ) или блокаторы рецепторов ангиотензина II, бета-блокаторы, периферические антагонисты кальция пролонгированного действия, антагонисты альдостерона, аспирин. Гиполипидемические средства ни в виде лекарственных препаратов, ни в виде БАД к пище не назначались.
Всем пациентам до и после произведенного воздействия проведено комплексное клинико-инструментальное и лабораторное обследование, которое включало изучение динамики клинического статуса, уровня артериального давления (АД), частоты сердечных сокращений (ЧСС), антропометрических показателей, биохимического анализа крови.
Антропометрические параметры включали в себя оценку массы тела (МТ, кг) и индекса массы тела (ИМТ, кг/м2).
ИМТ рассчитывался по формуле Кетле:
ИМТ = масса тела (кг) / рост (м2).
Биохимические исследования проводили с использованием биохимического анализатора Konelab 30i фирмы ThermoClinicalLabsystems (Финляндия).
Исследователи оценивали содержание в сыворотке параметров липидограммы крови – уровни общего холестерина (ОХС, ммоль/л), ТГ (ммоль/л), липопротеидов высокой плотности (ХС ЛПВП, ммоль/л). Уровень липопротеидов очень низкой плотности (ХС ЛПОНП, ммоль/л) определяли расчетным способом, делением количества ТГ на коэффициент 2,2. Уровень липопротеидов низкой плотности (ХС ЛПНП, ммоль/л) определяли по формуле Фридвальда (при ТГ ≤ 4,5 ммоль/л) – вычитанием суммы ХС ЛПВП и ТГ/2,2 из количества ОХС. Коэффициент атерогенности (КА) определяли расчетным методом.
Статистическая обработка результатов исследований проводилась согласно общепринятым методам с использованием пакетов прикладных программ Statistica 10 и SAS JMP 11. При анализе основных характеристик пациентов, после проверки распределения на нормальность с учетом критерия Шапиро – Уилка, использовались параметрические критерии, и данные представлялись как среднее значение и ошибка среднего (M ± m). Достоверность различий между исследуемыми группами определяли с помощью t-критерия Стьюдента. Статистически значимыми считали отличия, соответствующие величине ошибки достоверности р < 0,05.
Результаты
Результаты исследования показали субъективно хорошую переносимость и безопасность всех вариантов проведенной диетотерапии. При этом каких-либо побочных эффектов и признаков непереносимости и аллергических реакций отмечено не было.
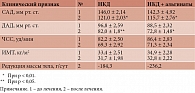
Результаты первого этапа исследования показали значительное улучшение клинического статуса пациентов под влиянием проведенной диетотерапии. В частности, у большинства больных уменьшились или исчезли головная боль, слабость, повышенная утомляемость, одышка при физической нагрузке, отеки ног к вечеру, ощущение перебоев в работе сердца. Однако процент больных, у которых отмечалась положительная динамика этих показателей, в ОГ был несколько выше по сравнению с гС (табл. 2).
Как видно из таблицы, уровень систолического АД (САД) статистически значимо снизился в процессе лечения у больных ОГ на 19%, а у больных ГС – на 18,0%, диастолического АД (ДАД) – на 18,0 и 17,0% соответственно. ЧСС в процессе лечения имела тенденцию к снижению у больных обеих групп. Степень снижения избыточной массы тела и ИМТ в процессе лечения больных ОГ и гС составляла 6 и 5,0%. Среднесуточная редукция массы тела для больных ОГ и гС равнялась соответственно 236 и 184 г. Анализ результатов биохимических исследований (табл. 3) показал, что включение продукта, источника альгинатов, в качестве дополнения к НКД способствовало статистически значимому (p < 0,05) снижению уровня ОХС в сыворотке крови на 21%, а в ГС – на 16% и статистически значимому (p < 0,05) снижению уровня ХС ЛПНП соответственно на 25 и 19%.
Концентрация в сыворотке крови ТГ и ХС ЛПОНП снизилась (на 13%) только у больных ОГ. Содержание в сыворотке крови ХС ЛПВП всех больных имело тенденцию к снижению. Величина КА снизилась у больных ОГ на 17%, а у пациентов ГС – на 11%.
Таким образом, включение источника альгинатов в антиатерогенную диету пациентов с ишемической болезнью сердца и гипертонической болезнью с умеренной гиперлипидемией способствовало усилению гиполипидемического действия рациона, что проявлялось более выраженным и статистически значимым снижением в сыворотке крови уровней ОХС и ХС ЛПНП.
Результаты оценки эффективности применения БАД – источника альгинатов также показали положительную динамику клинической симптоматики заболевания практически у всех больных, получавших источник альгинатов. Исчезли слабость, повышенная утомляемость, головная боль, головокружение, одышка при физической нагрузке, отеки ног к вечеру, ощущение перебоев в работе сердца; повысилась толерантность к физической нагрузке. У всех больных под влиянием диетотерапии уменьшились эмоциональная лабильность, раздражительность, улучшился сон.
На фоне улучшения общего состояния больных отмечено снижение АД. Как видно из табл. 4, уровень САД статистически значимо снизился в процессе лечения у больных, получавших модифицированную диету (ОГ – НКД + альгинаты) на 24%, а ДАД – на 20% соответственно. У больных ГС под влиянием НКД отмечалось снижение уровня этих показателей соответственно на 16 и 14%.
Редукция массы тела для больных ОГ и гС составила соответственно 7 и 6%.
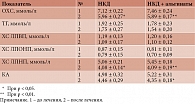
Динамика липидного спектра сыворотки крови больных под влиянием базовой и модифицированной диет представлена в табл. 5.
Из таблицы видно, что включение источника альгинатов в качестве дополнения к базисной диете способствовало статистически значимому (р < 0,05) снижению в сыворотке крови уровней ОХС и ХС ЛПНП на 20 и 35%. А у больных ГС редукция данных показателей составила 14 и 15% соответственно. Наряду с этим в ОГ и гС была выявлена тенденция к снижению в сыворотке крови уровней ТГ и ХС ЛПВП. У больных ОГ в процессе лечения КА статистически значимо (р < 0,05) снизился на 22%. А у больных ГС его величина уменьшалась на 12%.
Таким образом, результаты исследования показали, что использование источника альгинатов на фоне редуцированной по калорийности антиатерогенной диеты у больных ГЛП оказывает благоприятное воздействие на клиническую картину заболевания и клинико-инструментальные показатели, усиливает ее гиполипидемическое действие (способствует более выраженному и статистически значимому снижению в сыворотке крови уровня ОХС, ТГ, ХС ЛПНП и КА). Это подтверждает целесообразность их применения в диетотерапии всех типов ГЛП.
Результаты третьего этапа работы тоже показали значительное улучшение клинического статуса пациентов в результате проведенного курса диетотерапии, аналогичное результатам двух первых описанных исследований.
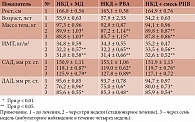
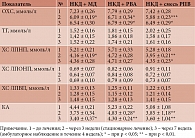
По данным табл. 6, под влиянием применения НКД с включением источников РПВ отмечено статистически значимое (р < 0,01) снижение массы тела и ИМТ в равной степени – на 6, 8 и 5%.
На фоне улучшения общего состояния больных отмечена нормализация АД. Статистически значимо уровень САД (р < 0,05) снизился в процессе лечения у больных, получавших на фоне диеты МД, растворимое волокно акации (РВА) и растительные ПВ, на 22%, а ДАД – на 16–20%.
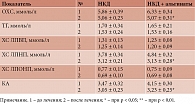
Анализ результатов биохимических исследований показал, что включение источников ПВ в качестве дополнения к НКД способствовало усилению ее гиполипидемического действия (табл. 7).
В частности, под влиянием применения диеты с включением мальтодекстрина (МД) через три и семь недель отмечалось статистически значимое снижение в сыворотке крови уровня ОХС на 14 и 13%, ХС ЛПНП – на 17 и 17%, КА – на 8 и 18% соответственно. Концентрация ТГ практически не изменялась, а концентрация ХС ЛПВП снижалась на 8% в стационарном периоде и повышалась до исходного значения после окончания амбулаторного периода.
В результате применения диеты, обогащенной РПВ, в стационарных и амбулаторных условиях было выявлено статистически значимое снижение в сыворотке крови уровней ОХС на 16 и 9%, ХС ЛПНП – на 20 и 16%, КА – на 16 и 24% соответственно. Содержание ТГ практически не изменялось, Уровень ХС ЛПВП снижался на 8% в стационарном периоде и повышался до исходного значения после амбулаторного лечения.
Под влиянием применения НКД с включением смеси РПВ в условиях стационара и в амбулаторных условиях отмечено статистически значимое снижение в сыворотке крови уровней ОХС на 21 и 13%, ХС ЛПНП – на 25 и 18%, КА – на 24 и 20%, ТГ – на 21 и 20% соответственно. Содержание ХС ЛПВП практически не изменялось в стационарном периоде и повышалось на 15% после окончания амбулаторного периода.
Таким образом, результаты проведенного исследования показали, что ежедневное включение 15 г РПВ, особенно в виде смеси ПВ, в антиатерогенную диету у пациентов с гЛП приводит к усилению ее гиполипидемического действия (более выраженному и статистически значимому снижению уровней в сыворотке крови ОХС, ТГ, ХС ЛПОНП, ХС ЛПНП и величины КА).
Обсуждение
Сердечно-сосудистые заболевания являются основной причиной смертности во всем мире. С 1990 по 2019 г. распространенность ССЗ удвоилась и наблюдался устойчивый рост смертности от ССЗ, увеличившейся с 12,1 млн человек в 1990 г. до 18,6 млн в 2019 г. Ожидается, что ССЗ останутся ведущей глобальной причиной смертности, что приведет примерно к 23 млн смертей в 2030 г. [7].
Что касается мер профилактики, то, по оценкам экспертов, ведение здорового образа жизни снижает риск инфаркта миокарда на 81–94% [8], в то время как применение только фармакотерапии приводит к снижению вероятности его развития на 20–30%. Соответственно, питание является важнейшим поведенческим фактором в предотвращении преждевременной смерти и инвалидности от ССЗ, превосходя физическую активность [9].
В последнее время, в качестве меры диетического воздействия с целью коррекции дислипидемии, одним из наиболее перспективных методов является обогащение рациона питания больных пищевыми волокнами. Недавний метаанализ трех рандомизированных контролируемых исследований показал, что добавление пищевой гелеобразующей вязкой растворимой клетчатки удваивает эффективность статинов [10]. Кроме того, данные перекрестного сечения NHANES (2003–2006) показали, что потребление цельного зерна, богатого ПВ, также способствует усилению эффективности терапии статинами [11].
Согласно методическим рекомендациям «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации», физиологическая потребность в ПВ для взрослого человека составляет 20–25 г в день (10 г/1000 ккал) [12]. В качестве источников углеводов рекомендуется употреблять преимущественно цельные злаки, овощи, фрукты и бобовые. Рекомендация основана на данных семи систематических обзоров, в ходе которых оценивали эффект более высокого уровня потребления цельных злаков, овощей, фруктов и бобовых по сравнению с более низким уровнем их потребления [13–15]. Полученные данные демонстрируют наличие корреляции между более высоким уровнем потребления цельных злаков (от 25–29 г ПВ в сутки) и снижением на 15–20% риска смерти от всех причин, ССЗ, ИБС, сахарного диабета второго типа и колоректального рака [14].
Согласно евразийским клиническим рекомендациям по питанию при ССЗ, в диете должно быть не менее 20–25 г ПВ в день (или 10 г на 1000 ккал), предпочтительно из цельнозерновых продуктов и круп. Более эффективно употреблять 30–45 г ПВ в сутки [16]. При ГЛП для эффективного контроля липидов и липопротеидов плазмы крови рекомендуется потреблять от 25 до 40 г ПВ, из них от 5 до 15 г растворимых волокон [17–20].
Все сказанное явилось основанием для проведения исследования по оценке переносимости и эффективности применения разных доз и разных источников РПВ у пациентов Российской Федерации в условиях реальной клинической практики.
Результаты проведенного исследования показали хорошую переносимость диетотерапии с включением в нее ПВ в виде альгинатов (в чистом виде и в виде БАД к пище), а также в виде волокна акации.
Эффективность диетотерапии оценивалась прежде всего по динамике параметров липидограммы. Наиболее выраженное гиполипидемическое воздействие со статистически значимой редукцией всех ключевых параметров липидограммы (ОХС, ТГ, ХС ЛПНП и КА) выявлено у пациентов, получающих в дополнение к базовой диетотерапии РПВ в виде волокна акации с общим суточным количеством ПВ в диете 35 г. При этом именно на такой дозе применения ПВ зафиксирована в равной степени выраженности редукция исходных уровней ОХС и ТГ. Это обусловливает целесообразность применения ПВ в дозе 30–35 г в сутки при всех типах атерогенных дислипидемий: IIА, IIБ иIV.
Заключение
Резюмируя результаты работы, можно сделать вывод, что обогащение базового антиатерогенного рациона нутриентами гиполипидемического действия сопровождалось выраженным оптимизирующим воздействием на показатели клинического статуса и параметры липидограммы крови, т.е. способствовало существенному усилению эффективности диетотерапии. Таким образом, в комплексе лечебных мероприятий для коррекции параметров липидограммы и других биомаркеров пищевого статуса пациентам с заболеваниями сердечно-сосудистой системы целесообразно применение диетотерапии, обогащенной биологически активными веществами направленного гиполипидемического действия.
Конфликт интересов. Авторы заявляют об отсутствии возможного конфликта интересов.
Благодарность. Авторы благодарят за помощь в подготовке материала для статьи ведущего научного сотрудника ФГБУН «ФИЦ питания и биотехнологии», д.м.н., проф. Погожеву Аллу Владимировну.
Финансирование. Источник финансирования – федеральный бюджет. Публикация подготовлена в рамках выполнения фундаментальной научно-исследовательской работы ФГБУН «ФИЦ питания и биотехнологии» № FGMF-2022-0005.
S.A. Derbeneva, O.Sh. Oynotkinova
Federal Research Centre for Nutrition, Biotechnology and Food Safety, Moscow, Russian Federation
Scientific Research Institute of Health Organization and Medical Management
Central State Medical Academy of the Office of the President of the Russian Federation
Federation Russian State Social University
Contact person: Svetlana A. Derbeneva, sderbeneva@yandex.ru
There is a growing interest in studying the effects of dietary fiber on blood lipid concentrations. Various mechanisms of their effect on lipid metabolism have been established. In addition, dietary fiber, classified as the seventh nutrient, is safe to use. According to numerous literature data, dietary fiber can be used as an alternative supplement to correct metabolic disorders in general and lipid metabolism in particular. Based on the above, a study was conducted at the clinic of the Federal State Budgetary Scientific Institution ‘Federal Research Center of Nutrition and Biotechnology’ to evaluate the effectiveness of diet therapy enriched with soluble dietary fiber in patients with hyperlipoproteinemia.
Material and methods. An open, single-center prospective study was conducted at the clinic of the Federal State Budgetary Scientific Institution ‘Federal Research Center of Nutrition and Biotechnology’. The tolerability and effectiveness of diet therapy enriched with soluble dietary fiber (SDF) was assessed, with a daily amount of SF in the diet from 22 to 35 g. The effectiveness was monitored based on the dynamics of the parameters of the functional activity of the cardiovascular system (CVS), anthropometry and lipidogram.
Results of the study showed good tolerability of the courses of diet therapy with the inclusion of SDF in it both in the form of alginates (in pure form and as a dietary supplement to food) and in the form of acacia fiber. The effectiveness of diet therapy was assessed, first of all, based on the dynamics of the lipidogram parameters. The most pronounced hypolipidemic effect with statistically significant reduction of all key lipidogram parameters (TC, TG, LDL-C and CA) was found in patients receiving, in addition to the basic diet therapy, RPV in the form of acacia fiber with a total daily amount of PV in the diet of 35 g. Moreover, it is at this dose of PV that an equally pronounced reduction in the initial level of both TC and TG was recorded. This determines the appropriateness of using PV at a dose of 30–35 g per day for all types of atherogenic dyslipidemia: IIA, IIB and IV.
Conclusion. Summarizing the results of the work, it can be concluded that enrichment of the basic antiatherogenic diet with nutrients of hypolipidemic action was accompanied by a pronounced optimizing effect on clinical status indicators and blood lipidogram parameters, i.e. contributed to a significant increase in the effectiveness of diet therapy. Thus, in a complex of therapeutic measures for patients with cardiovascular diseases, to correct lipidogram parameters and other biomarkers of nutritional status, it is advisable to use diet therapy enriched with biologically active substances with targeted hypolipidemic action.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.