Дисфункция щитовидной железы и вспомогательные репродуктивные технологии
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются вопросы влияния аутоиммунной патологии и дисфункции ЩЖ на исходы ВРТ, диагностики и ведения пациенток с патологией ЩЖ, планирующих беременность с помощью ЭКО/ИКСИ.
В статье рассматриваются вопросы влияния аутоиммунной патологии и дисфункции ЩЖ на исходы ВРТ, диагностики и ведения пациенток с патологией ЩЖ, планирующих беременность с помощью ЭКО/ИКСИ.
Нарушение функции щитовидной железы (ЩЖ) нередко встречается у женщин репродуктивного возраста и может приводить к патологическому течению беременности и родов. Распространенность субклинического гипотиреоза составляет около 5–7%, манифестного гипотиреоза – 0,2–4,5%, тиреотоксикоза – 0,3–1,0%. До 5–10% женщин репродуктивного возраста страдают аутоиммунным тиреоидитом [1].
О связи между репродуктивной системой и функцией ЩЖ стало известно еще в 1905 г., когда F. Kendle описал случай преждевременного полового созревания у пациентки с тяжелым гипотиреозом [2]. В дальнейшем была доказана ассоциация как гипотиреоза, так и гипертиреоза с репродуктивными нарушениями у женщин и мужчин [3].
Тиреоидные гормоны играют ключевую роль в росте и развитии организма, а также в функционировании практически всех органов и тканей. Гормоны ЩЖ непосредственно и опосредованно влияют на репродуктивную систему, рецепторы тиреоидных гормонов идентифицированы в стромальных и текальных клетках гранулезы яичников, в развивающихся и зрелых ооцитах. Тиреоидные гормоны потенцируют влияние гонадотропинов на синтез стероидов, совместно с фолликулостимулирующим гормоном оказывают стимулирующее воздействие на клетки гранулезы яичников, экспрессию рецепторов лютеинизирующего гормона, хорионического гонадотропина (ХГЧ) и подавление апоптоза [3]. Во время беременности тиреоидные гормоны способствуют закладке и развитию нервной, костной и других систем плода, дифференцировке и миграции нейроцитов, формированию отделов головного мозга. С учетом того что ЩЖ плода начинает функционировать после 12-й недели гестации, в первом триместре беременности потребности плода полностью покрываются тиреоидными гормонами матери. Для обеспечения более высокой потребности ЩЖ матери претерпевает ряд физиологических изменений, в частности увеличивается объем ЩЖ – на 10% у проживающих в регионах с достаточным потреблением йода, на 20–40% – в регионах с йодным дефицитом. Как правило, продукция трийодтиронина (Т3) и тироксина (Т4) возрастает на 30–50%, при этом для обеспечения возросшего биосинтеза гормонов ЩЖ суточная потребность в йоде также увеличивается практически вдвое [3].
Повышение функциональной активности ЩЖ в первом триместре беременности в первую очередь обусловлено стимулирующим действием ХГЧ, представляющего собой пептидный гормон, состоящий из двух субъединиц – α и β. Структурное сходство α-субъединицы ХГЧ и тиреотропного гормона (ТТГ) объясняет стимулирующий эффект ХГЧ на гипоталамо-гипофизарно-тиреоидную систему, что при беременности приводит к небольшому и кратковременному повышению концентрации свободного тироксина (св. Т4) и, как следствие, снижению уровня ТТГ, максимальное подавление которого в конце первого триместра соответствует пику концентрации ХГЧ. Кроме того, повышение уровня эстрогенов во время беременности сопровождается повышением тироксинсвязывающего глобулина (ТСГ), что приводит к повышению уровня общего Т4 и снижению содержания свободной фракции гормона в сыворотке крови вплоть до гипотироксинемии.
Изменение функциональной активности гипоталамо-гипофизарно-тиреоидной системы во время беременности и роль гормонов ЩЖ в развитии плода обусловливают необходимость определения специфических нормальных референсных значений ТТГ у беременных. При этом до сих пор в тиреоидологии остается дискутабельным вопрос о скрининге нарушений функции ЩЖ у беременных.
Эволюция представлений о норме ТТГ в период беременности менялась от принятых в течение многих лет референсных границ для общей популяции до триместр-специфических норм – до 2,5 мЕд/л в первом триместре и 3,0–3,5 мЕд/л во втором и третьем, широко принятых в 2005–2017 гг., и далее до популяционных специфических норм для беременных [4].
Манифестные формы нарушения функции ЩЖ ассоциируются с изменением менструальной функции и субфертильностью. В некоторых случаях проблемы с зачатием и вынашиванием могут сохраняться и после наступления стойкого эутиреоза, особенно у пациенток с аутоиммунной патологией ЩЖ. Согласно определению экспертов Международного комитета по мониторингу вспомогательных репродуктивных технологий, бесплодие – заболевание репродуктивной системы, характеризующееся неспособностью наступления клинической беременности после 12 месяцев и более регулярной половой жизни без предохранения [5]. В такой ситуации беременность может наступить в результате применения вспомогательных репродуктивных технологий (ВРТ), в первую очередь экстракорпорального оплодотворения (ЭКО) и интрацитоплазматической инъекции сперматозоида (ИКСИ).
Количество проведенных циклов ВРТ за последние три десятка лет увеличилось в девять раз. Россия по данному показателю занимает пятое место в мире [5].
Учитывая высокую распространенность аутоиммунной патологии ЩЖ у женщин репродуктивного возраста, особенно со сниженной фертильностью и бесплодием, которые планируют забеременеть с помощью ВРТ, эксперты Европейской тиреоидологической ассоциации (European Thyroid Association – ETA), исходя из результатов исследований, разработали в 2021 г. клинические рекомендации по диагностике и ведению патологии ЩЖ при использовании ВРТ [6].
Гипотиреоз, бесплодие и вспомогательные репродуктивные технологии
Манифестный гипотиреоз может быть причиной овуляторной дисфункции и недостаточности желтого тела с низким уровнем прогестерона. Различные формы нарушения менструального цикла определяются у 25–60% пациенток с гипотиреозом и только у 10% женщин без патологии ЩЖ [1]. При этом компенсация функции ЩЖ левотироксином натрия в большинстве случаев приводит к нормализации менструального цикла и соответственно фертильности.
Патогенетические механизмы при гипотиреозе связаны со снижением уровня глобулина, связывающего половые гормоны, и повышением активности ароматазы, что приводит к снижению содержания общего тестостерона и эстрадиола. При гипотиреозе гиперпродукция гипоталамусом тиреотропин-рилизинг гормона увеличивает секрецию не только ТТГ, но и пролактина. Возрастание уровня пролактина может влиять на пульсирующую секрецию гонадотропинов, обусловливая развитие синдрома гиперпролактинемического гипогонадизма при первичном гипотиреозе с различными формами нарушения менструального цикла, галактореей и снижением фертильности.
Хорошо известна ассоциация субклинического гипотиреоза с неблагоприятными исходами беременности, такими как спонтанное прерывание беременности, преэклампсия, отслойка плаценты, преждевременные роды, неонатальная смерть, как при спонтанно наступившей беременности, так и вследствие применения ВРТ [7, 8]. В связи с этим актуальным является оценка влияния терапии левотироксином натрия на исходы беременности при субклиническом гипотиреозе в зависимости от наличия аутоиммунной патологии ЩЖ и способов наступления беременности. Так, назначение левотироксина пациенткам с субклиническим гипотиреозом, планирующим беременность с помощью ВРТ, снижало риск спонтанного прерывания беременности и увеличивало шансы наступления не только беременности, но и родов [9, 10]. Метаанализ четырех рандомизированных плацебоконтролируемых исследований не показал положительного влияния заместительной терапии левотироксином субклинического гипотиреоза, развившегося вследствие аутоиммунного тиреоидита (АИТ), на частоту наступления беременности и живорождения, однако было отмечено значимое снижение риска прерывания беременности [11].
Таким образом, компенсация субклинического гипотиреоза целесообразна и рекомендуется всем планирующим беременность с помощью ВРТ [6].
Актуальными остаются вопросы дефиниции субклинического гипотиреоза во время беременности и нормального уровня ТТГ при планировании и ведении беременности, наступившей в результате применения ВРТ. В исследованиях уровень ТТГ > 3,5 мЕд/л ассоциировался с неблагоприятными исходами ВРТ, а назначение заместительной терапии левотироксином натрия при уровне ТТГ > 4,0 мЕд/л увеличивало число живорождений [7, 12].
Учитывая зависимость ТТГ от этнической принадлежности, уровня потребления йода в регионе проживания и других факторов, эксперты Американской и Европейской тиреоидологических ассоциаций рекомендуют для каждой популяции определять свои специфические триместр-зависимые нормы ТТГ [4, 6]. В отсутствие локальных норм верхняя граница референсного диапазона при планировании любой беременности, как спонтанной, так и после ВРТ, у женщин с исходно нормальной функцией ЩЖ соответствует принятой норме для общей популяции или меньше ее на 0,5 мЕд/л, то есть около 4,0 мЕд/л. Пациенткам с манифестным или субклиническим гипотиреозом, получающим заместительную терапию левотироксином натрия, рекомендуется достижение целевого уровня ТТГ < 2,5 мЕд/л в период планирования беременности до контролируемой стимуляции овуляции и в первом триместре беременности [4, 6].
Аутоиммунный тиреоидит и бесплодие
Аутоиммунный тиреоидит является одной из распространенных патологий ЩЖ и ведущей причиной развития первичного гипотиреоза. Распространенность АИТ в общей популяции зависит от пола, возраста, уровня потребления йода в регионе и, по некоторым оценкам, достигает 8–14% [3]. Встречаемость АИТ в десять раз выше среди женщин, при этом значимо выше среди пациенток с синдромом поликистозных яичников и бесплодием по сравнению с фертильными женщинами – 26,0 и 9,7% соответственно. Распространенность субклинического гипотиреоза вследствие АИТ также значимо выше у женщин с синдромом поликистозных яичников – от 10 до 25% [13]. Кроме того, АИТ ассоциируется с риском неблагоприятных исходов беременности, в частности ее прерывания, преждевременных родов [8]. Однако данные исследований противоречивы, а риск невынашивания может быть связан и с такими факторами, как возраст, уровень ТТГ, иная сопутствующая аутоиммунная патология, в том числе антифосфолипидный синдром.
Распространенность носительства антитиреоидных антител у женщин с бесплодием и нормальной функцией ЩЖ составляет около 10% [14]. У женщин, обращающихся в центры репродукции, положительные антитиреоидные антитела определяются чаще, чем в общей популяции. Патогенетические механизмы, лежащие в основе данных связей, остаются не до конца понятными, поскольку большая часть данных была получена в исследованиях in vitro и на животных [3, 8]. Обсуждается роль локального снижения Т3, антитиреоидных антител, выявленных в фолликулярной жидкости, и гипотезы овариальных фолликулов [15]. Кроме того, могут иметь значение ассоциированные с АИТ нарушения врожденного и приобретенного иммунитета.
В связи с этим представляется важным ответить на вопрос о возможности влияния аутоиммунной патологии при нормальной функции ЩЖ на исходы протоколов ВРТ, течение беременности и родов.
Ряд систематических обзоров и метаанализов были посвящены изучению связи между АИТ и результатами ЭКО/ИКСИ [8, 16–18]. На сегодняшний день не получено убедительных данных о влиянии АИТ, носительства антител к тиреоидной пероксидазе (АТ-ТПО) и/или антител к тиреоглобулину (АТ-ТГ) при эутиреозе на исходы ВРТ – имплантацию, число наступивших беременностей. Однако доказана ассоциация с риском самопроизвольного прерывания беременности в первом триместре и снижения частоты живорождения [8, 16]. В другом метаанализе не было показано повышения риска прерывания беременности после ИКСИ у носительниц тиреоидных аутоантител [17]. В метаанализе 14 исследований также не выявлено связи АИТ с вероятностью наступления беременности и неблагоприятными исходами беременности после ЭКО/ИКСИ [18]. Не установлена также ассоциация носительства антитиреоидных антител со сниженным овариальным резервом, числом живорождений, риском прерывания беременности и неонатальных осложнений [19]. На сегодняшний день наиболее убедительными представляются данные о риске прерывания беременности у пациенток с АИТ на фоне эутиреоза.
Еще одним спорным вопросом является влияние назначения левотироксина натрия на исходы ВРТ у эутиреоидных пациенток с положительными АТ-ТПО. В ретроспективном исследовании у носительниц АТ-ТПО ответ на стимуляцию яичников и исходы ЭКО был хуже. При этом назначение левотироксина натрия положительно влияло на результаты стимуляции яичников, однако не отразилось на количестве успешных имплантаций и беременностей после ЭКО [14]. В рандомизированном плацебоконтролируемом исследовании также не было показано связи между назначением левотироксина натрия носительницам АТ-ТПО и наступлением беременности, частотой выкидышей и живорождения после ВРТ [20].
Эксперты ETA не рекомендуют назначение левотироксина натрия женщинам в эутиреозе с положительными АТ-ТПО, планирующим беременность с помощью ВРТ [6].
Патология щитовидной железы на фоне контролируемой стимуляции яичников
Контролируемая стимуляция овуляции является важной частью протоколов ВРТ и сопровождается быстрым и значимым повышением уровня эстрадиола, сопоставимым с повышением во второй половине беременности. Как следствие, увеличивается уровень ТСГ, что может привести к снижению уровня св. Т4, последующей стимуляции гипофиза и повышению содержания ТТГ. Таким образом, контролируемая стимуляция яичников (КОС) может активировать гипоталамо-гипофизарно-тиреоидную ось вплоть до развития субклинического гипотиреоза.
Анализ изменения уровня тиреоидных гормонов на фоне контролируемой стимуляции яичников в рамках протокола ВРТ показал значимое увеличение уровня ТТГ после стимуляции и при наступлении беременности, при этом максимальное увеличение отмечалось у пациенток, исходно получавших заместительную терапию левотироксином натрия по поводу гипотиреоза [21–23]. Уровень св. Т4 при этом обычно менялся незначимо [21]. У трети эутиреоидных женщин после КОС значения ТТГ превышали 2,5 мЕд/л [22]. Высокий уровень ТТГ сохранялся длительное время и определялся у 51% пациенток с исходным гипотиреозом и 16% – с нормальной функцией ЩЖ на цикле ВРТ [23]. В связи с этим у женщин, получающих заместительную терапию левотироксином натрия, рекомендуется титрация дозы препарата до достижения целевого уровня ТТГ < 2,5 мЕд/л перед стимуляцией яичников [6]. Показано, что контролируемая стимуляция овуляции может приводить к развитию субклинического гипотиреоза [24]. Кроме того, в группе риска развития гипотиреоза на фоне стимуляции овуляции находятся пациентки с носительством антитиреоидных антител, в связи с чем в данной группе пациенток целесообразен контроль ТТГ после стимуляции овуляции.
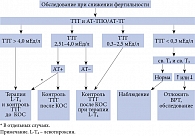
Таким образом, учитывая роль гормонов ЩЖ в функционировании репродуктивной системы, влияние манифестного и субклинического гипотиреоза на фертильность и исходы ВРТ, потенциальные риски, ассоциированные с аутоиммунной патологией ЩЖ, при обследовании бесплодной пары, планирующей беременность с помощью ВРТ, целесообразно исследование уровня ТТГ и АТ-ТПО (рисунок) [6]. При уровне ТТГ > 2,5 мЕд/л и отрицательном титре АТ-ТПО для исключения аутоиммунной патологии ЩЖ эксперты ETA рекомендуют проведение исследования на АТ-ТГ или ультразвукового исследования ЩЖ. Положительные АТ-ТПО ассоциируются с риском развития гипотиреоза после контролируемой стимуляции яичников и при беременности, а также с риском развития послеродового тиреоидита, что требует мониторинга функции ЩЖ у эутиреоидных лиц.
Заместительная терапия левотироксином показана всем женщинам с субклиническим гипотиреозом и уровнем ТТГ > 4,0 мЕд/л, планирующим беременность с помощью ВРТ, несмотря на наличие АТ-ТПО. Целевым уровнем ТТГ на фоне терапии левотироксином натрия при планировании беременности является уровень менее 2,5 мЕд/л.
Спорным вопросом при планировании и наступлении беременности остается терапия левотироксином натрия при уровне ТТГ от 2,5 до 4,0 мЕд/л. Учитывая слабую доказательную базу, эксперты ETA полагают возможным назначение малых доз левотироксина натрия (25–50 мкг) при планировании беременности с помощью ВРТ некоторым женщинам с положительными АТ-ТПО, особенно при наличии других факторов риска, таких как возраст более 35 лет, анамнез привычного невынашивания [6]. Данные факторы риска должны быть более четко определены в будущих контролируемых исследованиях.
При планировании заместительной терапии субклинического гипотиреоза преимущества могут иметь безлактозные формы левотироксина натрия, характеризующиеся большей стабильностью действующего вещества, что влияет на его биодоступность. Особенно это важно пациенткам с сопутствующей непереносимостью лактозы.
На сегодняшний день остается неоспоримой роль дисфункции и аутоиммунной патологии ЩЖ в различных аспектах женской репродуктивной дисфункции. Дисфункция и аутоиммунная патология ЩЖ непосредственно или опосредованно влияют на фертильность, течение и исходы беременности. Тем не менее, несмотря на большое количество проведенных за последнее десятилетие исследований, открытыми и актуальными остаются вопросы нормальных значений ТТГ при беременности, особенно при планировании ВРТ, и пороговых значений ТТГ для назначения левотироксина натрия с позиции влияния на исходы ВРТ, беременности и родов.
N.S. Martirosian, PhD, N.A. Petunina, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Narine S. Martirosian, narinarine@list.ru
Thyroid dysfunction, especially overt and subclinical hypothyroidism, is associated with menstrual dysfunction and decreased fertility. In some cases, problems with conception and pregnancy may persist even after euthyroidism restiration, especially in patients with thyroid autoimmunity. In such cases, pregnancy can occur as a result of the use of assisted reproductive technologies (ART), primarily in vitro fertilization (IVF) and intracytoplasmic sperm injection (ICSI). In recent years, a steady increase in the number of ART cycles has been observed worldwide. Subclinical hypothyroidism and thyroid autoimmunity are more common in women with infertility planning ART, especially with concomitant polycystic ovary syndrome. In 2021, experts from the European Thyroid Association (ETA) presented clinical guidelines for the diagnosis and management of thyroid pathology prior to and during ART cycle.
This article discusses the impact of autoimmune pathology and thyroid dysfunction on the outcomes of ART, diagnosis and management of patients with thyroid pathology planning pregnancy using IVF/ICSI.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.