Инновационные стратегии в борьбе с метаболическим синдромом: комплексный подход к успешной терапии
- Аннотация
- Статья
- Ссылки
- English
Известно, что у женщин и мужчин с метаболическим синдромом происходит изменение репродуктивной функции, усугубляющееся с возрастом. У молодых пациенток с ожирением нередко имеет место синдром поликистозных яичников. Возможно ли при этом решить вопрос деторождения без применения вспомогательных репродуктивных технологий и есть ли средства, улучшающие их результат? Что необходимо учитывать специалистам в комплексной терапии метаболического синдрома?
Известно, что у женщин и мужчин с метаболическим синдромом происходит изменение репродуктивной функции, усугубляющееся с возрастом. У молодых пациенток с ожирением нередко имеет место синдром поликистозных яичников. Возможно ли при этом решить вопрос деторождения без применения вспомогательных репродуктивных технологий и есть ли средства, улучшающие их результат? Что необходимо учитывать специалистам в комплексной терапии метаболического синдрома?
Термины «репродуктивный период», «генеративный период», «период плодовитости» применяются для обозначения периода жизни, в течение которого мужчина способен оплодотворить, а женщина зачать и родить, то есть периода сохранения способности организма к воспроизводству потомства. В демографии продолжительность репродуктивного периода определяется границами репродуктивного возраста. Для женщин это период от менархе до менопаузы. В России таковым считается период с 15 до 49 лет.
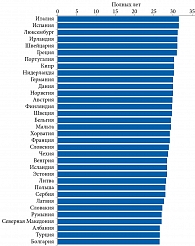
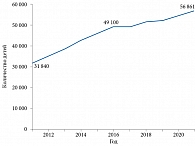
Давно известно возрастание рисков гестации, развития и рождения при естественной беременности у матерей старшего детородного возраста. Возраст матери также связан с шансами на естественное зачатие. Возраст женщины признан наиболее прогностическим фактором и при проведении вспомогательных репродуктивных технологий. Так, увеличение возраста матери, особо это относится к женщинам старше 35 лет, ассоциируется с повышенным риском анеуплоидии эмбриона, неудачной имплантации и выкидыша [1]. Несмотря на это, в последнее время наблюдается тенденция к увеличению среднего возраста женщины при рождении первого ребенка. По оценке Минтруда России, в 2021 г. он составлял 28 лет (публикация ТАСС от 15.10.2021), к 2030 г. может достичь 30 лет. Согласно данным Европейской экономической комиссии Организации Объединенных Наций, наибольший возраст среди первородящих отмечается в Италии и Испании – 31,6 года (рис. 1). По сообщению РБК, в 2021 г. в России женщины старше 40 лет родили 56,86 тыс. детей. Это максимальная цифра с 1990 г. (рис. 2). С 2008 г. количество рожденных детей в данной группе ежегодно увеличивается на 8%, или на 2,5 тыс., при этом чаще всего это вторые и третьи дети [2].
Если репродуктивному возрасту женщины уделяется много внимания, мужскому – значительно меньше.
Репродуктивный возраст мужчин – с 16 до 59 лет. Однако сперматозоиды в эякуляте остаются до преклонных лет. Известен факт, когда отцом стал 94-летний мужчина [3].
Длительное время оценивалась только мужская инфертильность (невозможность зачатия), без учета влияния качества сперматозоидов на формирование, зачатие, развитие плода и угрозы, возникающие во время беременности и родов.
На сегодняшний день доказано влияние возраста отца на исходы беременности, наступившей естественным путем или с применением вспомогательных репродуктивных технологий. Так, в работе J.L. Frattarelli и соавт. установлена значительно более высокая частота живорождений у мужчин моложе 50 лет по сравнению с мужчинами старше 50 лет – 56,0 против 41,3% [4]. Относительный риск составил 1,53 при 95%-ном доверительном интервале 1,02–1,23 (р < 0,01).
Позднее I. Robertshaw и соавт. обнаружили, что вероятность живорождения снижалась на 26% через каждые пять увеличения возраста мужчин при донорстве ооцитов в рамках вспомогательных репродуктивных технологий [5]. Пожилой возраст отца связан со снижением качества эмбрионов, показателей оплодотворения и наступления беременности и, следовательно, показателей наступления и развития физиологической беременности и живорождения [6]. Повышенный риск самопроизвольного выкидыша при возрасте отца старше 40 лет может быть обусловлен большим количеством генетических и эпигенетических аномалий спермы [7]. Кроме того, обнаружена ассоциация анеуплоидии отцовского происхождения с увеличением возраста отца [8]. Возраст более 50 лет был связан с более низкой частотой оплодотворения и повышенной частотой сегментарных аберраций [9], а также с повышенной частотой встречаемости фрагментации ДНК сперматозоидов [10].
В исследовании C. Farabet и соавт. установлено, что возраст мужчин 45 лет и более оказывал значительное влияние на совокупный результат вспомогательных репродуктивных технологий, при этом данный эффект был особенно выражен, если возраст женщин был старше 38 лет [11]. С учетом этих данных важно обратить внимание на высказывание д.м.н., профессора, врача акушера-гинеколога, хирурга В.Ф. Беженаря: «Первородящая женщина, пересекающая порог родильного дома в Петербурге, – это женщина, приближающаяся к 38–39 годам. Это женщина, у которой к этому возрасту уже накопился определенный спектр соматических и гинекологических проблем. И конечно, она представляет собой контингент уже с повышенным риском во время беременности и для самой женщины, и для ребенка» [12].
Какой же «багаж» нездоровья успевают накопить мужчина и женщина к периоду зачатия и каковы его причины?
Масштабы технического прогресса привели к резкому снижению затрат энергии человеком. Изменение метаболизма и отсутствие физической активности на фоне массового употребления фастфуда обусловливают распространение пандемии ожирения, являющегося компонентом метаболического синдрома. Избыточная масса тела и ожирение являются первой ступенью формирования инсулинорезистентности и триггером развития сахарного диабета 2 типа, артериальной гипертензии, ишемической болезни сердца, неалкогольной жировой болезни печени, синдрома обструктивного апноэ во сне, поражения опорно-двигательного аппарата, некоторых онкологических заболеваний, разных нарушений репродуктивной функции.
Инсулинорезистентность в большей или меньшей степени наблюдается у большинства лиц репродуктивного возраста. Это состояние, при котором снижается чувствительность жировой, мышечной и печеночной тканей к действию инсулина, что приводит к снижению синтеза гликогена, активации гликогенолиза и глюконеогенеза (нарушение толерантности к углеводам). Происходит физиологическое повышение и поддержание высокой секреторной активности β-клеток с формированием высокого уровня инсулина в крови. Инсулин – один из мощных анаболических гормонов. Максимальное количество рецепторов к нему находится на адипоците – жировой клетке. Как было отмечено ранее, в условиях снижения затрат энергии и увеличения потребления пищи развивается алиментарное, преимущественно висцеральное ожирение и формируется метаболический синдром.
Не всегда инсулинорезистентность является признаком нарушения метаболических процессов. Физиологическая инсулинорезистентность направлена на адаптацию организма при необходимости регулировать процессы запасания и расходования энергетических субстратов. В период пубертата на фоне большого количества соматотропного гормона гепатоцитами продуцируется много инсулиноподобного фактора роста 1, обеспечивающего в периферических тканях практически все физиологические эффекты соматотропного гормона. Инсулиноподобный фактор роста 1 имеет общую с инсулином систему передачи сигнала, и инсулин повышает его секрецию печенью. При недостаточности инсулиноподобного фактора роста 1 и высоком уровне соматотропного гормона развивается ожирение. Если в детском возрасте имеет место инсулинорезистентность, то в период пубертата высока вероятность формирования более выраженной инсулинорезистентности [13].
Хорошо известен факт физиологической инсулинорезистентности во сне, когда во время его медленной фазы отмечается самый низкий уровень утилизации глюкозы [14].
В период гестации происходит образование контринсулярных плацентарных гормонов: человеческого плацентарного гормона роста и плацентарного лактогена, а также адипокинов – цитокинов, вырабатываемых жировой тканью матери (лептина, адипонектина, фактора некроза опухоли α, интерлейкина 6 и др.) [6]. Кроме того, для обеспечения плода энергией у матери снижается утилизация глюкозы. Это приводит к формированию физиологической инсулинорезистентности, которая в норме прекращается после родоразрешения. При нерациональном питании, низкой физической активности и кишечном дисбиозе инсулинорезистентность сохраняется и после родов.
Гиперинсулинизм, инсулинорезистентность, нарушение толерантности к глюкозе, дислипидемия, абдоминальное ожирение, нарушение пуринового обмена и артериальная гипертензия являются компонентами метаболического синдрома, отражающего гипертрофию и дисфункцию жировой ткани. С возрастом наблюдается увеличение частоты встречаемости метаболического синдрома.
Инсулинорезистентность – это гиперинсулинемия в ответ на повышение гликемии. Изменяется нормальный метаболический ответ в органах-мишенях: происходит ослабление подавления глюконеогенеза в печени, липолиза в жировой ткани, нарушается инсулинзависимый транспорт глюкозы в клетки, подавляется синтез гликогена в мышцах и печени. Чувствительность к инсулину в тканях снижается, что приводит к компенсаторной гиперсекреции инсулина β-клетками островков Лангерганса поджелудочной железы. Этот каскад реакций формирует сахарный диабет 2 типа. При инсулинорезистентности в печени происходит постоянная активация липогенеза с формированием неалкогольной жировой болезни печени [15]. Гиперинсулинизм подавляет чувство насыщения и стимулирует аппетит. При данном состоянии пациент отдает предпочтение пище с высоким содержанием легкоусвояемых углеводов. Одновременно снижается мышечная активность, постоянно ощущается усталость. Инсулинорезистентность усиливается в отсутствие двигательной активности. Известно, что на скелетные мышцы приходится до 80% расхода полученной с пищей глюкозы [16], недостаточная физическая активность служит причиной дисбаланса поступления и расходования энергии.
Среди патофизиологических механизмов влияния гиперинсулинемии на организм следует выделить повышение выработки активных форм кислорода и конечных продуктов гликирования, стимуляцию клеточной пролиферации, истощение и дисфункцию β-клеток поджелудочной железы [17], повышение выработки жирных кислот и триглицеридов печенью (основной источник дислипидемии при инсулинорезистентности), экспрессию провоспалительных цитокинов, задержку Na и воды.
Ключевым механизмом развития инсулинорезистентности является митохондриальная дисфункция [16], способствующая эктопическому накоплению липидов и их метаболитов.
Именно инсулинорезистентность связана с нарушением фертильности как у женщин, так и у мужчин, которая усугубляется с увеличением возраста и веса. Высокие показатели индекса массы тела в 25–50% случаев ассоциированы с бесплодием [18]. У женщин с ожирением отмечаются нарушение менструального цикла, овариальная дисфункция, ановуляция, неполноценная лютеиновая фаза, гиперандрогения, у мужчин – андрогенодефицит, приводящий к снижению фертильности [19, 20].
Клинические проявления гиперинсулинемии и инсулинорезистентности разнообразны – от акне и снижения фертильности до формирования предиабета с переходом в дальнейшем в сахарный диабет 2 типа.
Что можно рекомендовать пациентам на фоне рационального питания и адекватной физической нагрузки для достижения максимального результата?
Комплекс Витажиналь® Инозит благодаря входящим в его состав компонентам обеспечивает антиоксидантное, липолитическое и повышающее чувствительность клеток к инсулину воздействие.
Мио-инозитол (инозит) принимает участие в регуляции углеводного и жирового обмена, включая стероидный метаболизм. Наибольшее его количество определяется в головном мозге, жировой ткани, почках, легких, яичниках и семенниках. Инозит может синтезироваться в почках [21] и поступать с пищей. Максимальное его количество содержится в бобах, орехах, кукурузе и фруктах. Мио-инозитол активно всасывается клетками кишечника Na+-зависимым образом. На этот процесс оказывают влияние качество продуктов (снижение содержания витаминов и микронутриентов), липидный состав пищи, длительный прием антибиотиков и частое употребление кофе. При наличии факторов, снижающих усвоение мио-инозитола, требуется дополнительный прием данного вещества.
Мио-инозитол поддерживает внутриклеточное образование вторичных мессенджеров инсулина, таких как фосфо-мио-инозитол-3-фосфат и инозитол-фосфатгликан, уменьшает высвобождение жирных кислот из жировой ткани, подавляя активность аденилил-циклазы [22]. Он является вторичным мессенджером фолликулостимулирующего гормона, включаясь в опосредованные последним пути регуляции пролиферации и созревания клеток гранулезы фолликула, модулирует продукцию антимюллерова гормона, воздействуя на созревание, транспорт яйцеклетки и обеспечение качества эмбриона [23]. У трансгенных мышей уменьшение концентрации мио-инозитола в придатках яичка приводило к снижению фертильности [24]. В сперматозоидах мио-инозитол выступает в роли вторичного мессенджера, модулируя внутриклеточные уровни Ca2+, которые участвуют в выработке аденозин-3-фосфата и регуляции окислительного метаболизма митохондрий [25].
Получены данные о способности добавок мио-инозитола улучшать состояние репродуктивной функции при синдроме поликистозных яичников. Так, ежедневное употребление 2000 мг мио-инозитола субфертильными женщинами с синдромом поликистозных яичников способствовало нормализации менструального цикла через три месяца у 24,3%, через шесть месяцев – у 53,6%. Спонтанная овуляция наступала через три месяца у 38,6%, через шесть месяцев – у 72,1% [26]. Максимальный ответ на применение мио-инозитола отмечен у женщин с ожирением и гиперинсулинемией: восстановление овуляции у 61,7%, наступление беременности у 23,4% [27].
Необходимо отметить положительное влияние мио-инозитола на липидный профиль. Через шесть месяцев его применения на фоне уменьшения инсулинорезистентности уровень липопротеинов высокой плотности увеличился на 0,1 ммоль/л (р < 0,05), уровень липопротеинов низкой плотности уменьшился с 3,50 ± 0,80 до 3,00 ± 1,20 ммоль/л (р < 0,05), триглицеридов – с 2,30 ± 1,50 до 1,75 ± 1,80 ммоль/л (р < 0,05) [28].
Прием мио-инозитола также способствует повышению уровня адипонектина, что позволяет регулировать аппетит [29].
У женщин с ожирением, инсулинорезистентностью, гиперинсулинемией, синдромом поликистозных яичников очень высокая распространенность гестационного сахарного диабета. Однако применение при беременности метформина, ведущего препарата для лечения инсулинорезистентности, в России на данный момент времени не разрешено. У женщин, планирующих беременность, прием метформина отменяется.
Известно, что беременность ассоциируется с физиологической инсулинорезистентностью, поэтому большой интерес могут представлять результаты работ, в которых оценивались возможности мио-инозитола в данной популяции. В исследовании на самках мышей с метаболическим синдромом и ожирением продемонстрировано, что применение мио-инозитола снижало прибавку веса, гликемию натощак, улучшало показатели сердечно-сосудистой системы и нормализовало уровень инулина [30]. R. D’Anna и соавт. выявили снижение риска развития гестационного сахарного диабета более чем в два раза у принимавших мио-инозитол [31]. В систематическом обзоре и метаанализе результатов четырех рандомизированных клинических исследований (586 беременных с факторами риска развития гестационного сахарного диабета) продемонстрирована меньшая частота развития гестационного сахарного диабета и более низкие показатели перорального теста на толерантность к глюкозе у принимавших мио-инозитол по сравнению с использовавшими плацебо [32]. S.G. Vitale и соавт. наблюдали 223 женщин с избыточным весом, которые в течение всей беременности и трех недель послеродового периода принимали мио-инозитол [33]. В группе мио-инозитола по сравнению с группой плацебо было отмечено снижение частоты развития гестационного сахарного диабета и артериальной гипертензии во второй половине беременности.
При проведении экстракорпорального оплодотворения у пациенток, применявших мио-инозитол, фиксировалось достоверное снижение продолжительности стимуляции и доз применяемых гонадотропных препаратов [34].
Добавление мио-инозитола к комбинированным оральным контрацептивам предотвращало прибавку веса, повышение индекса массы тела и улучшало метаболический профиль у лиц в возрасте от 17 до 19 лет с синдромом поликистозных яичников [35].
Во все протоколы по улучшению репродуктивной функции включена фолиевая кислота (водорастворимый витамин В9), при дефиците которой происходит изменение биосинтеза S-аденозилметионина, что приводит к формированию пороков развития плода. Речь, в частности, идет о дефектах нервной трубки (spina bifida и анэнцефалия), пороке сердца, дефектах формирования неба (волчья пасть, заячья губа), врожденной аномалии центральной нервной системы, поражении органов зрения, а в отдаленном периоде о расстройствах аутистического спектра и синдроме дефицита внимания [36]. Кроме того, дефицит фолатов во время беременности обусловливает развитие эндотелиальной дисфункции, индукцию окислительного стресса, активацию апоптоза и метилирования ДНК [37]. Гипергомоцистеинемия, развивающаяся у беременных на фоне дефицита фолатов, повышает риск сосудистых нарушений и невынашивания беременности.
Фолиевая кислота является коферментом в нескольких ключевых метаболических реакциях. Она необходима для метилирования ДНК, синтеза пуриновых и пиримидиновых оснований, аминокислот (метионина, серина, гистидина), белков, холина для обезвреживания гомоцистеина, стимуляции пластических процессов в тканях, эритропоэза, эпигенетических процессов эмбриогенеза [38]. Предполагается, что фолиевая кислота обладает антиоксидантным, противоопухолевым, кардио- и нейропротекторным свойствами [39]. Дополнительный прием фолиевой кислоты снижает повышенную концентрацию гомоцистеина, наблюдаемую у женщин с синдромом поликистозных яичников, предотвращает развитие гомоцистеинемии, положительно влияет на показатели гликемического, воспалительного и окислительного стресса и увеличивает общую антиоксидантную способность глутатиона [40].
Мио-инозитол в сочетании с фолиевой кислотой путем эпигенетического воздействия на метилирование ДНК предотвращает формирование врожденных дефектов, увеличивает количество беременностей.
Согласно данным систематического обзора 12 рандомизированных клинических исследований с участием 985 пациенток, у женщин с синдромом поликистозных яичников, принимавших фолиевую кислоту в дозе 400–800 мг и мио-инозитол в дозе 2000–4000 мг в течение 8–24 недель, достоверно отмечено восстановление метаболического профиля (снижение уровня триглицеридов, общего холестерина плазмы, глюкозы, лептина, инсулинорезистентности и индекса массы тела), эндокринного профиля (снижение уровня тестостерона, лютеинизирующего гормона, пролактина, инсулина, индекса инсулинорезистентности (HOMA-IR), соотношения лютеинизирующего и фолликулостимулирующего гормонов, улучшение результатов перорального теста на толерантность к глюкозе), функции яичников (восстановление менструального цикла (эффективнее метформина), спонтанной овуляции, уменьшение объема поликистозных яичников), а также улучшение результатов вспомогательных репродуктивных технологий (снижение дозы и продолжительности стимуляции, значительное повышение качества ооцитов, снижение числа незрелых ооцитов, повышение количества эмбрионов высокого качества) [41].
Витамин D является стероидным прогормоном, который вырабатывается в организме, а также может поступать с пищей. В последние годы во всем мире регистрируется практически тотальный его дефицит. Витамин D выполняет метаболические и эндокринные функции, участвует в обмене Ca. При недостатке витамина D изменение содержания Ca2+ внутри или вне клетки приводит к нарушению активности глюкозных транспортеров 4, работы β-клеток поджелудочной железы, секреции инсулина и способствует развитию инсулинорезистентности [42]. Дефицит витамина D усугубляет инсулинорезистентность, воспаление, дислипидемию, гиперандрогению, снижает фертильность. У женщин с синдромом поликистозных яичников наблюдаются более низкие уровни 25(ОН)D, что коррелирует с более выраженными метаболическими нарушениями [43].
Назначение или добавление к проводимой терапии витамина D оказывает положительный эффект на нормализацию/регуляцию менструального цикла, развитие фолликулов, показатели HOMA-IR, общего тестостерона, липопротеинов низкой плотности [44], глюкозы и инсулина в крови натощак, индекса количественной оценки чувствительности к инсулину (QUICKI). Как следствие, у пациентов улучшаются антропометрические показатели – уменьшаются окружность талии (маркера висцерального ожирения) и масса тела.
Гликемические эффекты витамина D более выражены при ежедневном приеме низких доз по сравнению с периодическим приемом высоких доз [45]. Ежедневное применение комплекса Витажиналь® Инозит, содержащего 600 МЕ витамина D в одном саше (суточная доза – до четырех саше), способствует лучшему гликемическому контролю.
Хром, кофактор олигопептида хромодулина, – микроэлемент, который улучшает чувствительность тканей к инсулину и облегчает транспорт глюкозы в клетки. При его дефиците развиваются метаболический синдром, гиперинсулинемия, гипергликемия, а также нарушается липидный обмен. У пациентов с сахарным диабетом 2 типа зафиксировано снижение уровня глюкозы в крови и гликированного гемоглобина, чего не наблюдается у здоровых людей [46]. Вероятно, у данного микроэлемента существует глюкозозависимый механизм действия. Дефицит хрома в плазме крови выявлен у женщин репродуктивного возраста с синдромом поликистозных яичников [47]. Применение у таких пациенток пиколината хрома в течение шести месяцев способствовало снижению индекса массы тела (p < 0,001), гликемии натощак (p = 0,007), уровня инсулина натощак (p < 0,001), свободного тестостерона (р = 0,001), значительно увеличивало шансы возникновения овуляции (p = 0,011) и регулярных менструаций (p = 0,002) – почти в два раза после пяти месяцев лечения [48]. В ходе проведения метаанализа результатов пяти рандомизированных клинических исследований установлено достоверное снижение HOMA-IR (p < 0,001) при использовании пищевых добавок с хромом [49].
Усиленный антиоксидантный эффект комплекса Витажиналь® Инозит обеспечивает флавоноид эпигаллокатехин-3-галлат – основной компонент экстракта листьев зеленого чая. Катехины применяются для улучшения обмена веществ, профилактики онкологических заболеваний и репродуктивных нарушений. Все вышеперечисленные состояния характеризуются высоким уровнем окислительного стресса. При проведении метаанализа результатов 68 рандомизированных клинических исследований с участием лиц с синдромом поликистозных яичников, в том числе подростков, выявлены лабораторные изменения, подтверждающие наличие окислительного стресса при данном заболевании, особенно если оно сочетается с избыточной массой тела [50]. Применение эпигаллокатехин-3-галлата на экспериментальных моделях способствовало улучшению показателей фертильности [51]. У пациенток с синдромом поликистозных яичников и ожирением эпигаллокатехин-3-галлат уменьшал массу тела, уровень инсулина натощак и тестостерона [52], а также восстанавливал нарушенную рецептивность эндометрия и его способность реагировать на действие прогестерона за счет активации транскрипционных генов репродукции HOXA 10 и HOXA 11 [53].
Поликомпонентность Витажиналь® Инозита обеспечивает влияние на метаболические и гормональные параметры у пациентов с нарушенной фертильностью. Снижение проявлений гиперандрогении, в том числе нормализация состояния кожи, волос, улучшение переносимости комбинированных оральных контрацептивов, особенно у подростков, позволяют применять Витажиналь® Инозит в разных возрастных группах.
Синергизм действия компонентов комплекса обеспечивает сокращение риска развития осложнений метаболического синдрома. Изменение пищевого поведения (снижение тяги к сладкому) позволяет соблюдать правила рационального питания и более уверенно достигать нормальных показателей индекса массы тела. Активное влияние на уровень глюкозы в крови и гликированного гемоглобина предотвращает прогрессирование предиабета в сахарный диабет. Совокупное положительное влияние на липидный профиль способствует профилактике развития и прогрессирования сосудистых изменений. Очень важно, что Витажиналь® Инозит можно использовать на этапах подготовки к беременности, ее планирования и ведения.
Получены данные о снижении рисков у пациенток с гестационным сахарным диабетом при применении витаминно-минеральных комплексов. Отмечено, что использование таких комплексов позволяет достигать наилучших результатов при подготовке и проведении вспомогательных репродуктивных технологий, а также в комплексной терапии женщин и подростков с синдромом поликистозных яичников, особенно при непереносимости метформина.
Витажиналь® Инозит можно применять отдельно или в сочетании с другими препаратами для лечения метаболических нарушений как у взрослых, так и у подростков. Рекомендованная схема приема – от двух до четырех саше в день, что дает возможность восполнения профилактической дозы витамина D, суточной потребности в мио-инозитоле, фолиевой кислоте и хроме. При выраженном дефиците витамина D допускается увеличение дозы.
Комбинация компонентов Витажиналь® Инозита позволяет поддерживать и улучшать здоровье начиная с подросткового возраста. Разнонаправленность его действия оказывает влияние практически на все системы организма и, как следствие, на качество жизни.
A.N. Oranskaya, PhD
Federal State Budgetary Educational Institution ‘Russian University of Medicine’ of the Ministry of Health of the Russian Federation
Consultative and Diagnostic Department of GBUZ ‘City Clinical Hospital No. 52 of the Moscow City Health Department’
Contact person: Alevtina N. Oranskaya, anor2004@list.ru
The multiplicity of clinical manifestations of metabolic syndrome and the incompletely studied pathogenesis require the search for optimal therapy for this condition.
It is known that women and men with metabolic syndrome have a change in reproductive function, which worsens with age. Polycystic ovary syndrome often occurs in young obese patients. Is it possible to solve the issue of childbearing without the use of assisted reproductive technologies and are there any means to improve their result? What should specialists consider in the complex therapy of metabolic syndrome?
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.