Влияние хирургического лечения эндометриом яичников на состояние овариального резерва у пациенток с бесплодием
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить влияние хирургического лечения эндометриом на качество ооцитов и эмбриогенез в программах ВРТ у пациенток с бесплодием.
Материал и методы. Показатели эмбриогенеза исследованы у 45 пациенток, ранее перенесших операцию по поводу односторонней эндометриомы яичника и получавших лечение методом ЭКО/ИКСИ. Больные были разделены на группы в зависимости от результатов лечения бесплодия. Всем участницам исследования выполнены протоколы ЭКО/ИКСИ с раздельным подсчетом антральных фолликулов в яичниках, раздельным забором яйцеклеток в маркированные чаши Петри, а также раздельным культивированием полученных после оплодотворения эмбрионов. Впоследствии было установлено, что группы обследованных больных сопоставимы по основным показателям овариального резерва: возрасту, уровню антимюллерова гормона в сыворотке крови, количеству антральных фолликулов в яичниках (р > 0,05).
Результаты. В отличие от интактного яичника оперированный яичник характеризуется меньшим числом растущих фолликулов, полученных яйцеклеток и количеством эмбрионов (р < 0,001). Достоверные различия в количестве бластоцист высокого качества, происходящих из оперированного и интактного яичников, отсутствуют.
Цель исследования – оценить влияние хирургического лечения эндометриом на качество ооцитов и эмбриогенез в программах ВРТ у пациенток с бесплодием.
Материал и методы. Показатели эмбриогенеза исследованы у 45 пациенток, ранее перенесших операцию по поводу односторонней эндометриомы яичника и получавших лечение методом ЭКО/ИКСИ. Больные были разделены на группы в зависимости от результатов лечения бесплодия. Всем участницам исследования выполнены протоколы ЭКО/ИКСИ с раздельным подсчетом антральных фолликулов в яичниках, раздельным забором яйцеклеток в маркированные чаши Петри, а также раздельным культивированием полученных после оплодотворения эмбрионов. Впоследствии было установлено, что группы обследованных больных сопоставимы по основным показателям овариального резерва: возрасту, уровню антимюллерова гормона в сыворотке крови, количеству антральных фолликулов в яичниках (р > 0,05).
Результаты. В отличие от интактного яичника оперированный яичник характеризуется меньшим числом растущих фолликулов, полученных яйцеклеток и количеством эмбрионов (р < 0,001). Достоверные различия в количестве бластоцист высокого качества, происходящих из оперированного и интактного яичников, отсутствуют.




Актуальность
Эндометриоз считается одним из наиболее распространенных заболеваний, ассоциированных с бесплодием. Около 10% женщин репродуктивного возраста страдают эндометриозом. Среди пациенток с бесплодием частота выявления заболевания достигает 50% [1, 2]. Актуальность проблемы восстановления репродуктивной функции у больных эндометриозом обусловлена высокой распространенностью эндометриоза. Не случайно важной задачей остается создание максимально эффективной для восстановления фертильности тактики ведения пациенток с эндометриозом на фоне бесплодия [2, 3]. Высказывается мнение, что причиной достаточно низкой частоты восстановления фертильности при эндометриозе как в естественных циклах, после хирургических и медикаментозных методов лечения, так и с использованием программ вспомогательных репродуктивных технологий (ВРТ) является многофакторность процессов, приводящих к бесплодию у женщин с эндометриозом [4]. Сложное взаимодействие между генетическим профилем, гормональной активностью, менструальным циклом, воспалительными и иммунологическими факторами определяет фенотипическую картину эндометриоза [5].
До сих пор в литературе нет однозначных ответов на вопросы, каковы причины снижения овариального резерва при эндометриозе и насколько велико влияние хирургии яичников на снижение овариального резерва при эндометриозе.
J.Y. Kim и соавт., сравнив группы женщин, перенесших хирургическую резекцию эндометриом и зрелых кистозных тератом яичников, обнаружили, что уровни антимюллерова гормона (АМГ) в сыворотке крови до операции у женщин с тяжелым эндометриозом значительно ниже, чем у женщин с тератомами [6].
Имеется много противоречивых публикаций о потенциальном вреде как от наличия эндометриомы, так и от ее хирургического лечения для овариального резерва оперированного яичника [7, 8]. Результаты ряда исследований показали, что оперативная лапароскопия превосходит простую диагностическую лапароскопию по частоте спонтанной беременности [2, 9–11]. Результаты двух исследований не продемонстрировали разницы в показателях беременности между оперированными и интактными эндометриомами перед ЭКО [12, 14]. Нет однозначных доказательств и по поводу удаления эндометриом до ЭКО. В доступной литературе не учитывается размер эндометриомы и вопрос удаления крупных эндометриом перед ЭКО рассматривается индивидуально для предотвращения перфорации эндометриомы и обеспечения лучшего доступа для извлечения ооцитов [15–18].
Цель исследования – оценить степень влияния наличия эндометриомы яичника и ее хирургического лечения на количество фолликулов, качество ооцитов и эмбрионов, полученных в программах ВРТ, у больных, имевших в анамнезе хирургическое лечение по поводу односторонней эндометриомы.
Материал и методы
Для оценки влияния хирургического лечения эндометриом на количество фолликулов, качество ооцитов и количество эмбрионов, полученных в программах ВРТ, была сформирована группа из 45 пациенток, которым ранее проводилось хирургическое лечение по поводу односторонней эндометриоидной кисты яичника. Возраст женщин, включенных в протокол ЭКО/ИКСИ, составил 28–43 года (средний возраст – 33 (30; 36) года). Длительность бесплодия варьировала от одного до 12 лет (в среднем 3 (2; 6) года). 27 (60%) из 45 пациенток имели первичное, а 18 (40%) – вторичное бесплодие. В анамнезе 18 пациенток с вторичным бесплодием имели место следующие исходы предыдущих беременностей: потери беременности на ранних сроках – 9 (50%), роды – 6 (33%), искусственное прерывание беременности на сроке до 12 недель беременности – 3 (17%) пациентки. Уровень АМГ в сыворотке крови у исследуемых пациенток составил 1,8 (2,8; 4,2) нг/мл, сывороточного фолликулостимулирующего гормона (ФСГ) – 7,9 (4,2; 9,8) МЕ/л.
При выполнении циклов ЭКО/ИКСИ ведение больных осуществлялось в соответствии со стандартным клиническим протоколом [19]. Данные о наличии в анамнезе операций по поводу эндометриомы одного из яичников получены из выписных эпикризов с протоколами оперативных вмешательств и результатами гистологического исследования, подтвердившими наличие эндометриоидной кисты яичника. За месяц до назначения контролируемой овариальной стимуляции яичников пациенткам выполнялись ультразвуковое исследование (УЗИ) органов малого таза с подсчетом количества антральных фолликулов в яичниках, стандартное общеклиническое и гормональное обследование. Режим и доза гонадотропинов подбирались индивидуально в зависимости от возраста, уровня ФСГ сыворотки крови на третий день менструального цикла, уровня АМГ сыворотки, ультразвукового подсчета числа антральных фолликулов, а также результатов предшествовавших циклов стимуляции.
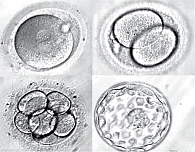
Пункцию фолликулов правого и левого яичников выполняли раздельно с размещением пунктата в маркированных («оперированный яичник» и «интактный яичник») чашах Петри. Подсчет полученных яйцеклеток и оценку эмбрионов также осуществляли раздельно. Качество эмбрионов анализировали на основании степени их фрагментации. К эмбрионам высокого качества относили типы A и B. Эмбрионы культивировали в индивидуальных каплях на одноступенчатой среде CSM (Irvine) при сниженной концентрации О2 5% в условиях инкубатора PLANER (Origio, Дания) до пятого-шестого дня развития (рис. 1). Оценку оплодотворения проводили через 18 часов после процедуры ЭКО или ИКСИ, оценку дробления – на второй и третий день культивирования. Эмбрионы для переноса или криоконсервации отбирали на пятый день развития по морфологическим критериям Гарднера: тип A – эмбрион отличного качества без ануклеарных (безъядерных) фрагментов (4А), тип B – эмбрион хорошего качества с содержанием ануклеарных фрагментов до 20% (4В). Основные клинические, анамнестические, а также статистические данные представлены в табл. 1.
Среднее число фолликулов в интактном яичнике составило 8,91 ± 3,35, в оперированном – 6,51 ± 2,75, медианные значения 7 (4; 8) и 9 (6; 10) соответственно (р < 0,001) (рис. 2). Среднее количество полученных яйцеклеток из оперированного ранее яичника составило 3,51 ± 2,4, значение медианы 4 (2; 5), из интактного яичника – 4,96 ± 2,7, медиана 5 (3; 6), что значимо меньше (р < 0,001).
При анализе полученных данных выявлено достоверное негативное влияние эндометриомы яичника на овариальный резерв, оцененный по количеству антральных фолликулов в яичнике и яйцеклеток, полученных из оперированного и интактного яичников при стимуляции овуляции и пункции.
Общее число полученных эмбрионов из пораженных и интактных яичников составило 48,9 и 51,1% соответственно, общее число эмбрионов незначительно превышало таковое из интактного яичника. Среднее число полученных эмбрионов первого и второго типа из оперированного яичника составило 1,62 ± 1,4, медиана 2 (1; 3), из интактного яичника – 2,0 ± 1,35, медиана 2 (1; 3). Статистически значимой разницы между полученными результатами из оперированного и интактного яичников не установлено.
В данном исследовании общее число эмбрионов было несколько выше в интактном яичнике. Отсутствие разницы между количеством высококачественных эмбрионов, полученных из интактного и оперированного ранее яичника, свидетельствует о том, что на качество эмбрионов наличие эндометриомы и/или хирургическое лечение по поводу эндометриоза яичников не оказывают существенного негативного влияния.
В течение года беременность наступила у 23 (51,1%) из 45 женщин, у 22 (48,9%) беременность не наступила (p > 0,05). В зависимости от исходов циклов ЭКО/ИКСИ 45 женщин были разделены на две группы. В первую группу вошли 23 (51%) пациентки, у которых в ходе лечения наступила беременность, во вторую – 22 (49%) женщины, у которых беременность не наступила. Из 23 пациенток первой группы беременность завершилась родами у 16 (69%), у 7 (31%) произошла потеря беременности на ранних сроках (до 12 недель).
Проанализирована зависимость исходов ЭКО-/ИКСИ-циклов от возраста пациенток, уровня сывороточного АМГ и диаметра кисты яичника во время предшествующего хирургического лечения. Сравнительные данные пациенток двух групп представлены в табл. 2.
Из данных, представленных в табл. 2, следует, что между группами пациенток с наступившей беременностью (первая группа) и пациенток, у которых беременность не наступила (вторая группа), нет значимых различий по возрасту (p = 0,47), количеству лет бесплодия (р = 0,06), уровню АМГ в сыворотке крови (р = 0,23), диаметру кисты яичника во время хирургического лечения (р = 0,57).
Проведен анализ зависимости исходов циклов ЭКО/ИКСИ от группы препаратов для гормономодулирующей терапии, которую пациентки получали до вступления в программы ВРТ (табл. 3).
В исследовании значимой зависимости исхода лечения бесплодия от типа гормональных препаратов не обнаружено (р = 1,0, хи-квадрат).
В настоящее время исследование продолжается.
Обсуждение
На основании полученных результатов можно сделать вывод, что наличие эндометриомы и хирургическое лечение по поводу эндометриоза яичников не оказывают достоверного негативного влияния на качество эмбрионов, полученных в программах ВРТ. При сравнительном исследовании между бластоцистами хорошего и отличного качества, полученными из яичника, оперированного по поводу эндометриоза, и интактного яичника, статистически значимая разница отсутствует. Однако хирургическое лечение по поводу эндометриоза яичников у пациенток с бесплодием значимо снижает количество антральных фолликулов и ооцитов, полученных из оперированного яичника, и соответственно ухудшает показатели лечения бесплодия с помощью ВРТ. Лапароскопическая цистэктомия эндометриом яичников снижает овариальный резерв у пациенток с бесплодием. При этом наблюдается значимое изменение уровней АМГ, ФСГ и количества антральных фолликулов в оперированном яичнике.
По данным литературы, существует множество контраверсий по поводу необходимости хирургического лечения эндометриоза яичников перед использованием программ ВРТ у женщин с бесплодием. Однозначного мнения о влиянии оперативного лечения на исходы ВРТ не существует.
Несомненно, хирургическое лечение необходимо при наличии болевого синдрома [20]. A. Garsia-Velasco и E. Somigliana (2009) предложили использовать определенные маркеры для определения необходимости хирургического лечения перед применением методов ВРТ. По мнению авторов, хирургическое лечение обязательно:
- при быстром росте эндометриомы и наличии подозрительных включений внутри капсулы кисты при УЗИ;
- болевом синдроме;
- предполагаемом риске разрыва кисты во время беременности;
- невозможности доступа к фолликулам в здоровой яичниковой ткани во время пункции.
Следует также обратить внимание на важный момент при выборе тактики ведения пациенток, в анамнезе которых имеет место хирургическое лечение по поводу эндометриоза яичников. Назначая лечение таким больным, предпочтение следует отдавать консервативным методам. Кроме того, необходимо максимально минимизировать любые факторы риска в отношении кровоснабжения яичников и сохранить нормальную овариальную ткань [21, 22].
В литературе содержится немало аргументов против хирургического лечения эндометриоза яичников перед использованием ВРТ. По крайней мере это относится к хирургической эксцизии стабильных (не имеющих быстрого роста и подозрительных включений по данным УЗИ) эндометриом небольших размеров [23, 24]. Согласно имеющимся данным, у больных, оперированных независимо от диаметра кисты, в 50% случаев снижена ответная реакция на стимуляцию гонадотропинами в оперированном ранее яичнике, в 13% случаев в этом яичнике отсутствует рост фолликулов [25].
В метаанализе L. Muzzii и соавт. (2014) показано, что при подсчете числа антральных фолликулов в оперированном и интактном яичниках число фолликулов в пораженном яичнике значительно ниже [26].
Согласно результатам двух контрастных исследований, число наступивших беременностей у пациенток, которым выполнены хирургическое лечение и ВРТ, значительно выше, чем у больных, которым выполнено только хирургическое лечение либо только ВРТ или лечение не проводилось [27, 28].
Заключение
Как известно, сегодня не существует способов, позволяющих радикально излечить эндометриоз. Нет и универсального или однозначного стандартизованного подхода, идеально подходящего для всех больных. У пациенток с бесплодием и эндометриозом яичников, особенно на фоне сниженного овариального резерва, крайне важен персонифицированный подход к выбору метода лечения. План лечения должен быть сугубо индивидуальным с учетом возраста, состояния овариального резерва, стадии эндометриоза, длительности бесплодия, хирургического анамнеза, наличия мужского фактора бесплодия. Вопрос хирургического лечения эндометриом необходимо тщательно анализировать, поскольку не исключены потенциальное снижение овариального резерва и ухудшение репродуктивных исходов.
Имеющиеся на сегодняшний день доказательства не подтверждают необходимость удаления мелких эндометриом, поскольку это не влечет за собой улучшение исходов в лечении бесплодия. В большинстве случаев во время хирургического лечения предпочтительна энуклеация капсулы эндометриомы, а не коагуляция или вапоризация капсулы кисты. При этом электрохирургия должна быть сведена к минимуму во избежание дополнительной термической травмы овариальной ткани. У больных со сниженным овариальным резервом хирургическое лечение по поводу эндометриоза яичников целесообразно проводить методом цистэктомии с максимально бережным отношением к ткани яичника. Интраоперационный гемостаз предпочтительно осуществлять без использования хирургических энергий, чтобы не допустить дополнительной термической травмы овариальной ткани, с помощью современных гемостатических матриц [29].
Особого отношения требуют пациентки с билатеральными эндометриомами, а также больные, имеющие в анамнезе хирургические вмешательства на яичниках. В этих случаях необходим персонифицированный подход с консультацией репродуктолога и хирурга. При сниженном овариальном резерве и наличии эндометриомы оценивают очередность вмешательств – хирургия или забор ооцитов.
В практической работе важно помнить об основных моментах, связанных с преодолением бесплодия у пациенток с эндометриозом. Речь, в частности, идет о максимально бережном отношении к ткани яичника во время хирургического лечения с целью сохранения овариального резерва, уменьшении риска рецидивов своевременным и полноценным назначением гормономодулирующей терапии, отказе от повторных операций на яичниках, своевременном направлении женщин с эндометриозом в центры ВРТ.
V.F. Bezhenar, PhD, Prof., N.S. Kuzmina, A.S. Kalugina, PhD, Prof.. S.Yu. Kruglov, A.G. Gramatikova, A.B. Gabdulla, Ye.S. Kulneva
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Natalya S. Kuzmina, dok.kuzmina@gmail.com
Relevance. Ovarian endometriosis is one of the urgent problems in the treatment of patients with infertility. The issues of the influence of endometriosis, as well as surgical treatment of endometriomas on the results of the use of assisted reproductive technologies (ART) in patients with infertility in recent years have been repeatedly discussed in the world literature. There is an opinion about a decrease in the ovarian reserve after surgical treatment of ovarian endometriosis, however, it is also known about the negative effect of endometriosis itself on the ovarian reserve. There is no standardized management tactics for patients with endometrioma and infertility. In each case of infertility in the presence of ovarian endometriosis, especially with the reduced ovarian reserve, the personalized approach to the choice of treatment tactics is necessary. The personalized approach to overcoming infertility in this contingent of patients is formed by organ-sparing surgical treatment in combination with hormone-modulating therapy of ovarian endometriosis and ART methods.
The aim of the study was to evaluate the effect of surgical treatment of endometriomas on the quality of oocytes and embryogenesis in ART programs in patients with infertility.
Material and methods. The parameters of embryogenesis were studied in 45 patients who had previously undergone surgery for unilateral ovarian endometrioma and were treated with IVF/ICSI. The patients were divided into groups depending on the results of infertility treatment. All the study participants underwent IVF/ICSI protocols with separate counting of antral follicles in the ovaries, with separate collection of eggs into labeled Petri dishes, as well as with separate cultivation of embryos obtained after fertilization. Subsequently, it was found that the groups of examined patients were comparable in terms of the main indicators of the ovarian reserve: age, the level of anti-muller hormone in the blood serum, the number of antral follicles in the ovaries (p > 0.05).
Results. In contrast to the intact ovary, the operated ovary is characterized by a smaller number of growing follicles, obtained eggs and the number of embryos (p < 0.001). There are no significant differences in the number of high-quality blastocysts originating from the operated and intact ovary.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.