Возможности некоторых современных биомаркеров в прогнозировании неблагоприятных сердечно-сосудистых событий у больных ишемической болезнью сердца и хронической болезнью почек
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследовании участвовали 80 пациентов с ИБС и ХСН ФК I–III, 40 из которых страдали ХБП. Наряду с общеклиническим обследованием иммуноферментным методом в сыворотке крови определяли концентрацию sST2, NT-proBNP, галектина 3 и цистатина С. Развитие неблагоприятных сердечно-сосудистых событий оценивали в течение года. Для определения чувствительности и специфичности уровней биомаркеров в стратификации риска развития неблагоприятных событий использовали ROC-анализ.
Результаты. Пациенты были разделены на две равные группы в зависимости от наличия ХБП. В обеих группах все одинарные модели характеризовались хорошей предикторной способностью. Лучшими прогностическими свойствами в группе больных ИБС, ХСН и ХБП обладала двойная модель NT-proBNP + галектин 3 (площадь под ROC-кривой (AUC) – 0,977). Специфичность составила 96,3%, чувствительность – 92,3%. В группе пациентов без ХБП для прогнозирования неблагоприятных сердечно-сосудистых событий в течение года оптимальной оказалась двойная модель sST2 + цистатин С (AUC – 0,965). Специфичность составила 97%, чувствительность – 85,7%.
Заключение. Для прогнозирования неблагоприятных сердечно-сосудистых событий у больных ИБС, ХСН ФК I–III и ХБП достаточно использовать двойную биомаркерную модель NT-proBNP + галектин 3, в отсутствие ХБП – двойную модель sST2 + цистатин С.
Материал и методы. В исследовании участвовали 80 пациентов с ИБС и ХСН ФК I–III, 40 из которых страдали ХБП. Наряду с общеклиническим обследованием иммуноферментным методом в сыворотке крови определяли концентрацию sST2, NT-proBNP, галектина 3 и цистатина С. Развитие неблагоприятных сердечно-сосудистых событий оценивали в течение года. Для определения чувствительности и специфичности уровней биомаркеров в стратификации риска развития неблагоприятных событий использовали ROC-анализ.
Результаты. Пациенты были разделены на две равные группы в зависимости от наличия ХБП. В обеих группах все одинарные модели характеризовались хорошей предикторной способностью. Лучшими прогностическими свойствами в группе больных ИБС, ХСН и ХБП обладала двойная модель NT-proBNP + галектин 3 (площадь под ROC-кривой (AUC) – 0,977). Специфичность составила 96,3%, чувствительность – 92,3%. В группе пациентов без ХБП для прогнозирования неблагоприятных сердечно-сосудистых событий в течение года оптимальной оказалась двойная модель sST2 + цистатин С (AUC – 0,965). Специфичность составила 97%, чувствительность – 85,7%.
Заключение. Для прогнозирования неблагоприятных сердечно-сосудистых событий у больных ИБС, ХСН ФК I–III и ХБП достаточно использовать двойную биомаркерную модель NT-proBNP + галектин 3, в отсутствие ХБП – двойную модель sST2 + цистатин С.
![Таблица 1. Клинико-демографическая характеристика пациентов, Ме [Q25; Q75], абс. (%)](/upload/resize_cache/iblock/3c5/195_350_1/Oranzhereeva1.jpg)
![Таблица 2. Лабораторные показатели пациентов, включенных в исследование, Ме [Q25; Q75]](/upload/resize_cache/iblock/116/195_350_1/Oranzhereeva2.jpg)



Введение
Хроническая сердечная недостаточность (ХСН), одной из главных причин которой является ишемическая болезнь сердца (ИБС), широко распространена в мире. Согласно результатам исследования ЭПОХА-ХСН, в России насчитывается свыше 3 млн пациентов с ХСН [1]. Большинство пациентов с ХСН страдают сопутствующей патологией, в частности хронической болезнью почек (ХБП). В мире распространенность ХБП составляет 11–26% [2]. ХСН имеют более четверти больных ХБП, а с ухудшением функции почек частота СН значительно увеличивается, достигая 65–70% у пациентов с терминальной стадией почечной недостаточности [3]. ХСН является постоянной угрозой для пациентов с ХБП. В свою очередь накапливаемые при ХБП креатинин и другие соединения, характеризующиеся кардиотоксичностью, приводят к чрезмерной активации ренин-ангиотензиновой системы, гиперкоагуляции, задержке натрия и воды, повышению артериального давления, анемии. СН отрицательно влияет на перфузию почек и ускоряет прогрессирование почечной недостаточности. Таким образом формируется порочный круг взаимоотягощения и прогрессирования обоих заболеваний. Именно поэтому у коморбидных пациентов с ХБП значительно возрастает риск СН и смерти из-за сердечно-сосудистых заболеваний (ССЗ).
Концепция кардиоренального синдрома требует своевременной и точной оценки функции сердца у пациентов с ХБП с сопутствующими ССЗ с целью определения рисков прогрессирования ХСН [3]. Ранняя диагностика и прогноз помогают управлять течением болезни и оптимизировать проводимую терапию.
В настоящее время для диагностики и оценки прогноза у больных ХСН широко применяются биомаркеры фиброза и ремоделирования миокарда. Продолжается поиск наиболее информативных и экономичных биомаркеров для прогнозирования развития неблагоприятных сердечно-сосудистых событий у пациентов с ХСН и сопутствующей ХБП.
Еще в 2008 г. были опубликованы работы E. Braunwald, который предложил классифицировать биомаркеры СН на основании главных патофизиологических детерминант, таких как растяжение миокарда, повреждение миоцитов, ремоделирование матрикса и воспаление, почечная дисфункция [4]. Не случайно в данной работе нами использованы группы биомаркеров с различными свойствами: NT-proBNP, маркеры ремоделирования, фиброза и воспаления sST2, Gal-3 и маркер почечного повреждения CysС. Их прогностическую значимость оценивали у больных ИБС и ХСН функционального класса (ФК) I–III с наличием или отсутствием сопутствующей ХБП.
Цель – оценить возможности одинарных и комбинированных моделей с использованием биомаркеров sST2, NT-proBNP, Gal-3 и CysС в прогнозировании риска развития неблагоприятных сердечно-сосудистых событий в течение года у больных ИБС, ХСН ФК I–III и ХБП.
Материал и методы
Обследовано 80 пациентов обоего пола (медиана (Ме) возраста – 65 [61,5; 66] лет) с ИБС (стенокардия напряжения/постинфарктный кардиосклероз), ХСН ФК I–III. Пациенты были разделены на две группы в зависимости от наличия ХБП. Первую группу составили 40 пациентов с сопутствующей ХБП (Ме возраста – 65 [63; 66] лет), вторую (группу сравнения) – 40 пациентов без сопутствующей ХБП (Ме возраста – 64 [59,5; 66] года). Все пациенты подписали информированное согласие на участие в исследовании. Контролем служили показатели 20 условно здоровых пациентов с Ме возраста 61 [57; 64] год. Исследование одобрено комитетом по этике Российского университета медицины (протокол от 17 ноября 2022 г. № 11-22). Все пациенты последовательно были госпитализированы в кардиологические отделения Федерального государственного казенного учреждения «Центральный клинический военный госпиталь» (ФГКУ ЦКВГ) в плановом порядке.
Диагноз ИБС, ХСН и ХБП устанавливали на основании действующих на момент проведения исследования клинических рекомендаций [3, 5, 6]. Наличие ХСН подтверждалось данными анамнеза и физического обследования с использованием шкалы оценки клинического состояния (ШОКС) при ХСН, а также результатов эхокардиографии и уровня NT-proBNP > 125 нг/мл в начале исследования [3]. Снижение скорости клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2 у пациентов сохранялось три месяца и более. В процессе исследования соблюдались положения Хельсинкской декларации и принципы Надлежащей клинической практики (Good Clinical Practice).
Критериями невключения были острый инфаркт миокарда (ОИМ), острое нарушение мозгового кровообращения (ОНМК), острое почечное повреждение, COVID-19, перенесенные менее чем за шесть месяцев до включения в исследование, сахарный диабет, онкологические заболевания, ХБП стадии V. Все пациенты получали лечение в соответствии с современными клиническими рекомендациями. Клинико-демографическая характеристика пациентов, включенных в исследование, представлена в табл. 1 и была опубликована ранее [7, 8].
Стандартное обследование включало осмотр, оценку по ШОКС, клинический и биохимический анализы крови, анализ мочи. Методом иммуноферментного анализа (ELISA) в сыворотке крови определяли уровень sST2 (Critical Diagnostics Presage ST2 Assay, США), Gal-3 (RayBio Human Galectin-3 ELISA Kit, США), NT-proBNP (Biomedica, Австрия) и CysC (набор RD191009100 Human Cystatin C ELISA, США). Все иммуноферментные исследования проводили с использованием микропланшетного ридера Infinite F50 и программного обеспечения Magellan Tracker (Tecan Austria GmbH, Австрия).
Всем больным выполнены электрокардиография, тест шестиминутной ходьбы (ТШХ), эхокардиография с определением основных структурно-функциональных параметров сердца и выраженности диастолической дисфункции. СКФ рассчитывали по формуле CKD-EPI [6]. Все исследования выполнялись в лаборатории и отделении функциональной диагностики ФГКУ ЦКВГ.
Статистическая обработка полученных результатов проводилась с помощью программ IBM SPSS Statistics 12 и MedCalc Software 22.023. Данные представляли в виде Me и квартильного размаха (Q25–Q75 – 25-й и 75-й процентили). Нормальность распределения определяли с помощью тестов Колмогорова – Смирнова и Шапиро – Уилка. Для оценки однородности дисперсий переменных проводили тест Левена. Групповые сравнения двух разрядов данных осуществлялись непараметрическим методом Манна – Уитни. При анализе качественных признаков анализировали таблицы сопряженности с использованием критерия χ2 Пирсона. Для определения чувствительности и специфичности изучаемых биомаркеров в прогнозировании риска развития неблагоприятных событий использовали ROC-анализ (Receiver Operator Characteristic) с построением ROC-кривых и расчетом площади под кривой (AUC), показатель которой 0,70 считался значимым. Для всех видов анализа значимыми считали различия при р < 0,05.
Результаты
Пациенты обеих групп были сопоставимы по основным клинико-демографическим показателям, однако у пациентов первой группы с ХБП в анамнезе чаще регистрировался ОИМ (р = 0,020), у большинства пациентов отмечалась ХСН ФК Ш (р = 0,028). Количество баллов по ШОКС было значимо больше (р = 0,006), а расстояние ТШХ значимо меньше (р = 0,049), чем в группе сравнения. В табл. 2 представлены основные лабораторные показатели обследуемых пациентов. Концентрации всех изучаемых биомаркеров в обеих группах были значимо выше, чем в группе сравнения (р = 0,0000 для всех биомаркеров), в которой Ме уровня sST2 составила 19,3 [18,25; 21,15] нг/мл, Gаl-3 – 6,55 [4,9; 7,2] нг/мл, CysC – 0,756 [0,676; 0,775] нг/мл. Между первой и второй группами выявлены значимые различия концентрации Gаl-3 (р = 0,036) и CysC (р = 0,0000), которая оказалась выше у больных ХБП. Первая группа отличалась от группы сравнения наличием анемии (р = 0,007), более выраженной креатининемией (р = 0,0000) и снижением СКФ (р = 0,0000).
В течение года проспективного наблюдения у ряда пациентов обеих групп отмечались неблагоприятные сердечно-сосудистые события, к которым относили развитие острого коронарного синдрома (ОКС), ОНМК, пароксизмов фибрилляции предсердий (ФП), прогрессирование ХСН более чем на один ФК, смерть от всех причин. В первой группе у пациентов с ИБС, ХСН и ХБП было зарегистрировано 13 (32,5%) неблагоприятных событий, а в группе сравнения – 7 (17,5%), хотя различия были незначимы (р = 0,197). Зафиксированы один летальный исход в первой группе, декомпенсация ХСН у четырех больных первой группы и двух пациентов группы сравнения, ОКС у трех больных первой группы и двух пациентов группы сравнения, ОНМК у двух и одного пациента соответственно, пароксизм ФП у трех и двух пациентов соответственно.
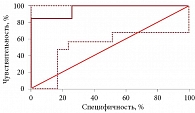
Для оценки роли sST2, Gal-3, NT-proBNP и CysС в прогнозировании риска развития неблагоприятных сердечно-сосудистых событий в обеих группах был проведен ROC-анализ, продемонстрировавший высокую предсказательную ценность всех изучаемых биомаркеров (табл. 3). Оценка предсказательной способности мультимаркерных моделей в первой группе (ИБС, ХСН и ХБП) показала, что лучшими из них являются NT-proBNP + Gal-3, sST2 + NT-proBNP + Gal-3 и NT-proBNP + CysC + Gal-3 с одинаковой площадью под ROC-кривой (AUC) – 0,977 (табл. 4). Именно поэтому с учетом предиктивной ценности и экономической выгоды для оценки риска развития неблагоприятных сердечно-сосудистых событий в течение года у данной категории больных лучше использовать двойную модель NT-proBNP + Gal-3 (рис. 1). Хорошими альтернативными моделями считаются NT-proBNP + CysС (AUC – 0,963), sST2 + Gal-3 (AUC – 0,963), sST2 + NT-proBNP (AUC – 0,957) и sST2 + CysС (AUC – 0,952).
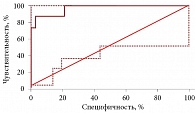
Результаты ROC-анализа мультимаркерных моделей и их прогностической способности в отношении риска развития неблагоприятных событий в группе сравнения представлены в табл. 5. В этой группе наибольшую ценность для прогнозирования риска развития неблагоприятных сердечно-сосудистых событий в течение года представляют мультимаркерные модели sST2 + NT-proBNP + CysС + Gal-3, sST2 + CysС + Gal-3, sST2 + NT-proBNP + CysС и sST2 + CysС с одинаковой AUC – 0,965. В связи с этим с экономической точки зрения достаточно пользоваться двойной биомаркерной моделью sST2 + CysС (рис. 2). Отдельно определять Gal-3 и NT-proBNP нецелесообразно, поскольку имеются модели с лучшей прогностической способностью. Достаточно сильной прогностической ценностью характеризуются модели NT-proBNP + CysС и NT-proBNP + CysС + Gal-3 (AUC – 0,944).
Обсуждение
Работ, посвященных диагностической и прогностической роли различных биомаркеров у пациентов с ХСН и сопутствующей патологией, достаточно много. Однако биомаркеры отличаются уровнем прогностической значимости. Ранее разработанный Барселонский калькулятор риска сердечной недостаточности (BCN Bio-HF Calculator) позволяет стратифицировать риск смерти у больных ХСН на основании 11 показателей (пола, возраста, ФК ХСН, фракции выброса левого желудочка, СКФ, проводимой терапии и др.). Кроме того, NT-proBNP служит биомаркером растяжения миокарда, sST2 – маркером фиброза и ремоделирования, высокочувствительный сердечный тропонин отражает выраженность повреждения кардиомиоцитов [9, 10]. С помощью данного калькулятора можно оценить трехлетний прогноз и ожидаемую продолжительность жизни пациента с ХСН. Действительно, согласно результатам нашего исследования, sST2 и NT-proBNP у обследуемых больных ХСН имеют важное прогностическое значение для оценки риска развития неблагоприятных сердечно-сосудистых событий, что подтверждают данные ROC-анализа (см. табл. 4).
Недавние клинические исследования подтвердили эффективность прогнозирования у лиц с ХСН с помощью биомаркерных моделей [11–14]. В работе M. Barutaut и соавт. описаны результаты успешного использования мультимаркерных моделей sST2, NT-proBNP и Gal-3 для прогнозирования вероятности развития неблагоприятных событий при ХСН [11]. В силу широкой распространенности ХБП у пациентов с ССЗ одной из задач нашей работы было создание моделей прогнозирования рисков неблагоприятных сердечно-сосудистых событий у особой группы пациентов – с ХСН и ХБП.
Биомаркер sST2 хорошо зарекомендовал себя как предиктор неблагоприятного прогноза у пациентов с ХСН: AUC у больных первой группы составила 0,915 (0,782–0,979), р < 0,0001, в группе сравнения – 0,879 (0,737–0,960), р < 0,0001, что указывает на его важное место в мультимаркерных моделях прогнозирования ХСН. В нашей работе он присутствует как наиболее важный компонент эффективных моделей как в группе пациентов с ХБП, так и в группе сравнения.
Прогностическая роль биомаркера почечного повреждения CysC при ХСН менее изучена, однако он также показал прогностические способности как при ХБП, так и в ее отсутствие: AUC в первой группе – 0,910 (0,777–0,977), р < 0,0001, в группе сравнения – 0,900 (0,733–0,940), р < 0,0001. У больных без ХБП наиболее оптимальной с прогностической и экономической точки зрения оказалась мультимаркерная модель sST2 + CysC. Вместе с тем по сравнению с моделью sST2 + NT-proBNP статистически значимых различий не выявлено (р = 0,147).
В обеих группах при сравнении ROC-кривых одиночные модели продемонстрировали меньшую прогностическую ценность, чем мультимаркерные. В группе сравнения различия эффективности одиночной модели Gal-3 и мультимаркерных моделей достигли статистической значимости: р = 0,009 для sST2 + CysС, sST2 + NT-proBNP + CysС, sST2 + CysС + Gal-3, sST2 + NT-proBNP + CysС + Gal-3, р = 0,010 для NT-proBNP + CysС, р = 0,016 для CysС + Gal-3. Таким образом, отдельно определять Gal-3 в группе пациентов с ИБС и ХСН без ХБП нецелесообразно.
Наиболее прогностически значимыми моделями в первой группе были NT-proBNP + Gal-3, sST2 + NT-proBNP + Gal-3 и NT-proBNP + CysC + Gal-3. При сравнении ROC-кривых данных моделей статистически значимой разницы не выявлено (р = 1,000 при всех парных сравнениях). Исходя из этого, наиболее экономически выгодным для оценки риска развития неблагоприятных событий в течение года у пациентов с ИБС, ХСН и ХБП может считаться применение двойной модели NT-proBNP + Gal-3.
Gal-3 присутствует в почках и способствует тубулоинтерстициальному фиброзу, который увеличивается с прогрессированием заболевания почек и снижением СКФ [15, 16], что наблюдалось у пациентов первой группы (с ХБП). Ме СКФ у них была значимо ниже, чем в группе сравнения (р = 0,0000). Повреждение почек может оказывать провоспалительное и профиброзное действие через путь Gal-3, со временем приводя к ремоделированию и дисфункции сердца, прогрессированию СН [17, 18]. Изучению особенностей галектинемии при кардиоренальном синдроме и ХСН посвящен ряд работ отечественных авторов [19, 20]. Согласно данным нашего исследования, Ме Gal-3 на фоне ХСН и ХБП была значимо выше, чем в отсутствие ХБП (р = 0,036).
В группе сравнения лучшей прогностической способностью характеризовались модели sST2 + NT-proBNP + CysС + Gal-3, sST2 + CysС + Gal-3, sST2 + NT-proBNP + CysС и sST2 + CysС с одинаковой AUC – 0,965. При этом значимые различия между ними отсутствовали (р = 1,000 при сравнении всех моделей, кроме моделей sST2 + CysС + Gal-3 и sST2 + CysС, где р = 0,366). Именно поэтому в качестве оптимальной прогностической модели с учетом экономической выгоды у больных ИБС и ХСН без документированной ХБП можно рассматривать модель sST2 + CysС.
Заключение
При оценке риска развития неблагоприятных событий в течение года у пациентов с ХСН ишемического генеза и ХБП могут быть использованы мультибиомаркерные модели. Оптимальной для пациентов с ИБС, ХСН и ХБП является двойная модель NT-proBNP + Gal-3, включающая, помимо широко рекомендованного маркера биомеханического стресса NT-proBNP, маркер фиброза и ремоделирования Gal-3. У больных ИБС и ХСН в отсутствие подтвержденного диагноза ХБП в моделях прогнозирования в качестве предиктора неблагоприятного прогноза может быть использован CysС в сочетании с sST2. Вместе с тем необходимо продолжить исследования в данном направлении с привлечением большего количества пациентов.
Авторы заявляют об отсутствии конфликта интересов.
Работа выполнена без задействования грантов и финансовой поддержки от общественных, некоммерческих и коммерческих организаций.
Проведение исследование одобрено комитетом по этике Российкого университета медицины (протокол от 17 ноября 2022 г. № 11–22).
В процессе исследования соблюдались положения Хельсинкской декларации и принципы Надлежащей клинической практики (Good Clinical Practice).
V.N. Oranzhereeva, O.L. Belaya, Ye.V. Kovalenko, L.I. Markova, O.I. Tereshchenko, Z.V. Kuropteva
N.A. Semashko Scientific and Educational Institute of Clinical Medicine of the Russian University of Medicine
N.M. Emanuel Institute of Biochemical Physics of the RAS
Contact person: Olga L. Belaya, olgabelaya64@gmail.com
Aim to evaluate the capabilities of single and combined models using biomarkers sST2, NT-proBNP, galectin 3 and cystatin C in predicting the risk of adverse cardiovascular events within 1 year in patients with coronary artery disease with FC I–III CHF and CKD.
Material and methods. In 80 patients with coronary artery disease with FC I–III CHF, 40 of whom suffered from CKD, along with a general clinical examination, the concentrations of sST2, NT-proBNP, galectin 3 and cystatin C were determined in the blood serum using the enzyme immunoassay method. Development of unfavorable cardiovascular events Patient events were assessed over a 1-year period. ROC analysis was used to determine the sensitivity and specificity of biomarker levels in stratifying the risk of adverse events.
Results. The patients were divided into 2 groups of 40 patients depending on the presence of CKD. In both groups, all single models had good predictive ability. The dual model NT-proBNP + galectin 3 had the best prognostic properties in the group of patients with IHD with CHF and CKD (AUC – 0.977), specificity – 96.3%, sensitivity – 92.3%. In the group of patients without CKD, the dual model sST2 + cystatin C was optimal for predicting adverse cardiovascular events within 1 year (AUC – 0.965), specificity – 97%, sensitivity – 85.7%.
Conclusion. To predict adverse cardiovascular events in patients with coronary artery disease with FC I–III CHF and the presence of CKD, it is enough to use the double biomarker model NT-proBNP + galectin 3, in the absence of CKD – the double model sST2 + cystatin C.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


