количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Эффективное и безопасное управление сахарным диабетом 2 типа – результат индивидуализации сахароснижающей терапии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №5 (48)
- Аннотация
- Статья
- Ссылки
- English
Авторы обсуждают вопрос выбора гипогликемического препарата у пациентов с сахарным диабетом 2 типа, исходя из критериев эффективности, частоты развития гипогликемии и влияния на сердечно-сосудистую систему, в качестве стартовой терапии в дебюте заболевания и «второго» терапевтического агента для интенсификации сахароснижающей терапии. Показано, что у пациентов с исходно высоким уровнем гликированного гемоглобина препаратом выбора при инициации терапии, а также при интенсификации терапии на фоне недостижения контроля монотерапией метформином может быть препарат сульфонилмочевины длительного действия (например, глимепирид) благодаря высокой сахароснижающей активности, низкому риску развития гипогликемии и устойчивому продолжительному эффекту. Анализ данных продолжительных клинических исследований не подтверждает гипотезу о значительных преимуществах применения ингибиторов дипептидилпептидазы-4 по сравнению с препаратами сульфонилмочевины в отношении сердечно-сосудистой системы.
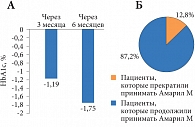
Рис. 1. Результаты исследования PERSIST: динамика уровня HbA1c по сравнению с исходным значением (А), контроль приверженности пациентов лечению через 6 месяцев после начала терапии (Б)
![Рис. 2. Исследование эффективности вилдаглиптина и глимепирида у пациентов, не достигших компенсации СД 2 типа на фоне монотерапии метформином [12]](/upload/resize_cache/iblock/7d5/195_350_1/7d528c4cd501a1e425ee7b06c8143731.jpg)
Рис. 2. Исследование эффективности вилдаглиптина и глимепирида у пациентов, не достигших компенсации СД 2 типа на фоне монотерапии метформином [12]
![Рис. 3. Особенности дизайна исследования E. Ferrannini и соавт. [12]: схема назначения глимепирида](/upload/resize_cache/iblock/e8b/195_350_1/e8b0e33938544362b619587788f1903b.jpg)
Рис. 3. Особенности дизайна исследования E. Ferrannini и соавт. [12]: схема назначения глимепирида
![Рис. 4. Особенности дизайна исследования R. Arechavaleta и соавт. [14]: схема назначения глимепирида](/upload/resize_cache/iblock/993/195_350_1/9933a623fc1980ffd083203c770856a1.jpg)
Рис. 4. Особенности дизайна исследования R. Arechavaleta и соавт. [14]: схема назначения глимепирида
![Рис. 5. Особенности дизайна исследования S. Srivastava и соавт. [16]: схема назначения глимепирида](/upload/resize_cache/iblock/b99/195_350_1/b99aa1badb6c19b73c83de47bbf56068.jpg)
Рис. 5. Особенности дизайна исследования S. Srivastava и соавт. [16]: схема назначения глимепирида
![Рис. 6. Эффективность ситаглиптина и глимепирида у пациентов с СД 2 типа с недостаточным контролем сахарного диабета на фоне монотерапии метформином (по данным S. Srivastava и соавт. [16]): А, Б – динамика уровня HbA1c по сравнению с исходными данными; В](/upload/resize_cache/iblock/e82/195_350_1/e825ca6ea22644b1308758f86bd198c4.jpg)
Рис. 6. Эффективность ситаглиптина и глимепирида у пациентов с СД 2 типа с недостаточным контролем сахарного диабета на фоне монотерапии метформином (по данным S. Srivastava и соавт. [16]): А, Б – динамика уровня HbA1c по сравнению с исходными данными; В
![Рис. 7. Частота сердечно-сосудистых осложнений на фоне приема саксаглиптина и плацебо по результатам исследования SAVOR-TIMI 53 [20]](/upload/resize_cache/iblock/b15/195_350_1/b15ccc2ff45409d031bf350fea8adea3.jpg)
Рис. 7. Частота сердечно-сосудистых осложнений на фоне приема саксаглиптина и плацебо по результатам исследования SAVOR-TIMI 53 [20]
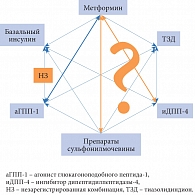
Рис. 8. Рациональные комбинации сахароснижающих препаратов
Среди большого количества таблетированных гипогликемических средств выраженным сахароснижающим действием и заметным влиянием на уровень гликированного гемоглобина (HbA1c) в сочетании с высоким профилем безопасности характеризуются только метформин, препараты сульфонилмочевины и глиптины. По поводу места определенного класса препаратов в алгоритме терапии больных сахарным диабетом (СД) 2 типа ведутся активные дискуссии, причем чаще всего предметом обсуждения становятся степень эффективности, частота развития гипогликемии и влияние лекарственных средств на сердечно-сосудистый риск пациентов.
Согласно позиции экспертов Американской диабетической ассоциации (American Diabetes Association, ADA) и Европейской ассоциации по изучению сахарного диабета (European Association for the Study of Diabetes, EASD) в отношении стратегии выбора гипогликемических препаратов, алгоритм терапии должен учитывать последовательно пять основных критериев: эффективность, частоту и тяжесть эпизодов гипогликемии, влияние на массу тела, частоту развития побочных эффектов и стоимость лечения. При этом целесообразность назначения того или иного класса препаратов оценивается по совокупности преимуществ и недостатков его применения у конкретного пациента [1].
Эффективность бигуанидов (метформина) и препаратов сульфонилмочевины доказана в крупномасштабных исследованиях и подтверждена годами активного применения в мировой клинической практике. Снижение уровня HbA1c на фоне монотерапии препаратами этих групп сопоставимо и достигает 1–2%. Но если метформин на протяжении многих лет остается «золотым стандартом» в лечении пациентов с СД 2 типа, то применение препаратов сульфонилмочевины иногда ограничивается по причине возможного риска развития гипогликемии.
В этой связи благодаря снижению уровня HbA1c на 0,5–1,0% [2] на фоне монотерапии ингибиторами дипептидилпептидазы-4 (иДПП-4) в отсутствие высокой частоты развития побочных эффектов, в том числе гипогликемии, а также отрицательного влияния на состояние сердечно-сосудистой системы, применение глиптинов представляется клинически привлекательным. При этом ряд клинических исследований продемонстрировал относительно невысокую эффективность монотерапии иДПП-4 в достижении целевых показателей гликемии. Так, F.X. Pi-Sunyer и соавт. изучали эффективность монотерапии вилдаглиптином в течение 24 недель у пациентов с впервые выявленным СД 2 типа и средним уровнем HbA1c 8,4%. За этот период на фоне лечения вилдаглиптином уровень HbA1c снизился на 0,7% (p < 0,001), а целевого значения HbA1c достигли лишь 30% пациентов [3]. В похожем исследовании P. Aschner и соавт. оценивали эффективность иДПП-4 ситаглиптина по сравнению с плацебо у 740 пациентов с СД 2 типа и средним уровнем HbA1c 8%. В результате через 24 недели терапии уровень HbA1c удалось снизить на 0,79% (p < 0,001), при этом целевого значения HbA1c достиг 41% пациентов [4]. Данные этих исследований показывают относительно невысокую эффективность иДПП-4 в достижении целевых параметров углеводного обмена у пациентов со значительно повышенным уровнем HbA1c (более 8%).
Как показано в ходе клинических исследований, препараты сульфонилмочевины длительного действия характеризуются высокой эффективностью. Так, данные исследования D. Schade и соавт., которое продолжалось 22 недели и включало 247 пациентов, из которых 80 человек с исходным средним уровнем HbA1c 9,1% получали глимепирид, показали значительно более высокую эффективность глимепирида по сравнению с плацебо: снижение уровня HbA1c составило 1,4% (p < 0,001). За весь период исследования эпизодов гипогликемии не зафиксировано [5]. Результаты работы D. Schade и соавт. были подтверждены через 10 лет в исследовании в условиях реальной клинической практики, когда X.-H. Guo и соавт. оценивали эффективность глимепирида в качестве стартовой сахароснижающей терапии у пациентов с СД 2 типа. Через 16 недель снижение уровня HbA1c составило 1,7% (8,6 ± 1,6% в начале исследования и 6,9 ± 0,9% в конце; p < 0,001), что позволило говорить о достижении целевого гликемического контроля (HbA1c < 7%) в группе лечения глимепиридом. Частота эпизодов гипогликемии в группе пациентов, получавших глимепирид, была минимальной и составила 3,1%. Корреляция между частотой возникновения гипогликемии и дозой препарата отсутствовала: у пациентов, принимавших глимепирид в дозе 1, 2 и 4 мг, частота гипогликемии составила 8,1, 0 и 2,5% соответственно. Исследователи считают, что высокая частота подтвержденной гипогликемии у пациентов, принимавших 1 мг глимепирида, может быть объяснена высокой чувствительностью к глимепириду у лиц с впервые выявленным СД 2 типа [6]. Таким образом, в ходе клинических исследований была доказана эффективность и безопасность монотерапии препаратами сульфонилмочевины длительного действия (глимепиридом) в качестве стартовой терапии у пациентов с исходно высоким уровнем HbA1c в дебюте заболевания, поскольку эта схема лечения позволяет добиться целевой компенсации СД при низком риске развития гипогликемии.
Одним из самых актуальных представляется вопрос выбора препарата для интенсификации сахароснижающей терапии, особенно в связи с недавним пересмотром сроков и показаний к интенсификации сахароснижающей терапии. Согласно современным алгоритмам специализированной медицинской помощи больным СД, при недостижении целей терапии в течение 6 месяцев необходимо добавление дополнительного терапевтического агента, в качестве которого могут выступать препараты из группы иДПП-4 или препараты сульфонилмочевины [2]. Учитывая высокую значимость проблемы выбора «второго» препарата, проведено большое количество исследований, посвященных применению иДПП-4 и препаратов сульфонилмочевины у пациентов с декомпенсированным СД 2 типа на фоне монотерапии метформином.
В 20-недельном исследовании G. Charpentier и соавт. оценивали эффективность применения глимепирида у пациентов, не достигших полной компенсации СД 2 типа на фоне монотерапии метформином, в сравнении с монотерапией метформином или глимепиридом. Итоговое снижение уровня HbA1c в группе комбинированной терапии составило 0,74 ± 0,96% (p < 0,001), в то время как на фоне монотерапии метформином и глимепиридом было отмечено повышение уровня HbA1c на 0,07% (p < 0,001) и 0,27% (p < 0,001) соответственно, что свидетельствовало о высокой эффективности комбинированной терапии. Помимо этого, у пациентов, получавших комбинацию метформина и глимепирида, выявлено значительное снижение уровня гликемии натощак и постпрандиальной гликемии, соответственно на 1,8 ± 2,2 и 2,6 ± 3,9 ммоль/л (p < 0,001) [7]. Частота гипогликемии у пациентов, получавших глимепирид, метформин и их комбинацию, составила 13, 11 и 22% соответственно. Анализируя полученные данные, следует обратить внимание на то, что исходное среднее значение HbA1c 6,42% (менее 6,5%) после назначения глимепирида, который в данном исследовании титровался сразу с 2 мг и до 6 мг, снизилось до 5,68% (p < 0,001). Известно, что столь низкие целевые значения HbA1c допустимы лишь для молодых пациентов, без серьезных сопутствующих заболеваний и склонности к гипогликемическим реакциям, с небольшой длительностью СД. Подчеркнем, что определение верхней границы диапазона HbA1c 6% неправомерно в случае развития гипогликемических реакций. На наш взгляд, достижение уровня HbA1c 5,68% в данном исследовании было неоправданно жесткой целью гликемического контроля для большинства пациентов, участвовавших в нем и получавших дополнительно к метформину глимепирид. Во многом указанные факторы предрасполагают к повышению риска гипогликемии и объясняют полученные результаты. Помимо этого, агрессивная тактика титрации дозы, применяемая в данном исследовании, противоречит рутинной практике, не соответствует современным требованиям, предъявляемым к терапии больных СД 2 типа, и не поддерживается многими практикующими эндокринологами.
В ходе российского обсервационного исследования с участием 279 пациентов с СД 2 типа, в котором оценивали эффективность и безопасность применения глимепирида в сочетании с метформином на протяжении 6 месяцев, были получены данные, отличающиеся от результатов работы G. Charpentier и соавт. Через 6 месяцев терапии отмечено достоверное улучшение основных параметров углеводного обмена: снижение уровня HbA1c (с 7,9 ± 0,6 до 6,9%; p < 0,001), гликемии натощак (с 8,3 ± 1,4 до 6,1 ммоль/л; p < 0,001) и постпрандиальной гликемии (с 10,4 ± 2,0 до 7,3 ммоль/л; p < 0,001). К концу исследования 57% пациентов удалось достичь уровня HbA1c < 7%. При этом исследование показало, что комбинация метформина и глимепирида обладает хорошим профилем безопасности: в частности, после завершения титрации дозы глимепирида частота симптоматической гипогликемии составила 6,1%. Подробный анализ выявил полное отсутствие эпизодов тяжелой и бессимптомной гипогликемии и наличие единичных случаев ночной гипогликемии, частота всех эпизодов суммарно составила менее 1% за весь период наблюдения (р < 0,001). У 93% пациентов не отмечено ни одного эпизода гипогликемии, при этом более чем у половины из них достигнуто целевое значение HbA1c (р < 0,001) [8].
Итак, в исследовании G. Charpentier и соавт. у пациентов с исходно низким уровнем HbA1c (6,42%) наблюдался высокий риск гипогликемии (22%) на фоне значимого сахароснижающего эффекта (снижение уровня HbA1c на 0,74 ± 0,96%) комбинированной терапии метформином и глимепиридом. А в российском обсервационном исследовании, где исходный уровень HbA1c у пациентов составил 7,9 ± 0,6%, отмечались высокий уровень безопасности (частота гипогликемии 6,1%) и более высокая эффективность комбинации метформина и глимепирида (снижение HbA1c на 1,1%). Сопоставление результатов этих двух исследований позволяет говорить об увеличении потенциального риска гипогликемии при применении глимепирида в комбинации с метформином у лиц с незначительно повышенным уровнем HbA1c, с одной стороны, и о снижении риска гипогликемии при применении глимепирида в комбинации с метформином у пациентов с исходно высоким уровнем HbA1c – с другой.
Применение фиксированной комбинации метформина и глимепирида также сопровождается улучшением гликемического контроля у пациентов и низким риском гипогликемии, что было продемонстрировано в наблюдательном многоцентровом исследовании PERSIST [9], целью которого была оценка приверженности терапии фиксированной комбинацией глимепирида и метформина в течение 6 месяцев у пациентов с СД 2 типа. Через 6 месяцев 87,2% пациентов продолжили терапию, что сопровождалось улучшением контроля гликемии и привело к статистически значимому снижению уровня HbA1c (7,17% по сравнению с исходным 8,92%; р < 0,001). Только 3,06% пациентов прекратили лечение из-за недостаточной эффективности терапии (рис. 1). Частота гипогликемии составила 2,98%, причем эпизодов гипогликемии, квалифицируемых как серьезные нежелательные явления, отмечено не было.
Существуют данные схожих по дизайну исследований, в которых изучали эффективность комбинации метформина с глиптинами. Их результаты продемонстрировали менее выраженный гипогликемический эффект такой комбинации по сравнению с терапией метформином в сочетании с глимепиридом. Так, в работе E. Bosi и соавт. на фоне интенсификации терапии вилдаглиптином изменение уровня HbA1c по сравнению с группой плацебо-контроля составило 1,1% (p < 0,001). Однако в группе с исходным значением HbA1c 7,9–8,5% целевого уровня HbA1c через 24 недели терапии достигли 31,4% пациентов, а в группе с исходным значением HbA1c > 8,5% – всего 16,3%. Более значимые результаты получены в группе с исходным уровнем HbA1c < 7,9%, где целевых значений гликемии достигли 54,4% пациентов [10]. В похожем исследовании B. Charbonnel и соавт. [11] с применением ситаглиптина у пациентов, не достигших контроля СД на фоне монотерапии метформином (HbA1c 7,96 ± 0,81%), снижение уровня HbA1c за 24 недели составило 0,65% (p < 0,001). При этом менее половины (47%) участников исследования достигли целевого значения HbA1c < 7%. Результаты данных исследований позволяют сделать вывод о невысокой сахароснижающей активности иДПП-4 у пациентов со значительно повышенным уровнем HbA1c на фоне монотерапии метформином.
Согласно современным подходам к лечению СД 2 типа, для обеспечения должного контроля недостаточно доказательств эффективности проводимого лечения – необходимы данные, подтверждающие высокий профиль безопасности того или иного терапевтического вмешательства. В связи с этим, помимо контроля стандартных показателей углеводного обмена, обязателен контроль частоты и тяжести гипогликемии, являющейся, как известно, самостоятельным механизмом, приводящим к ухудшению состояния углеводного обмена и развитию осложнений СД 2 типа.
Ряд сравнительных исследований, проведенных с использованием глимепирида и иДПП-4 в качестве препаратов для интенсификации сахароснижающей терапии у пациентов, не достигающих компенсации СД 2 типа на фоне приема метформина, показал эффективность глимепирида в качестве терапевтического агента, достоверно снижающего уровень HbA1c, однако параллельно с этим выявил и риск гипогликемии. Так, в исследовании E. Ferrannini и соавт. 2789 пациентов, не достигших контроля заболевания при монотерапии метформином, были рандомизированно распределены на 2 группы: лечения глимепиридом или вилдаглиптином в течение 52 недель. Среднее значение HbA1c на старте исследования составило 7,3% в обеих группах. Через 52 недели амплитуда снижения HbA1c оказалась одинаковой в обеих группах: -0,44% (p < 0,001) в группе приема вилдаглиптина и -0,53% (p < 0,001) в группе применения глимепирида, при этом максимальное снижение HbA1c (до 6,6%) было достигнуто у пациентов, получавших глимепирид, на 16-й неделе терапии и сохранялось примерно на том же уровне до конца исследования (рис. 2) [12]. Частота гипогликемии в группе пациентов, получавших глимепирид, составила 16,2%. Отметим, что в этом исследовании вновь применялась довольно агрессивная методика титрования дозы глимепирида. Увеличение дозы глимепирида на 1 мг производилось начиная с 4-й недели и было обязательным для всех пациентов при определении уровня глюкозы плазмы натощак > 6,2 ммоль/л (рис. 3). При этом известно, что у пациентов с СД 2 типа уровень глюкозы плазмы натощак сильно варьирует, зависит от количества углеводов, принятых накануне вечером, и определяется ночной продукцией глюкозы печенью [13], влияние на которую оказывает только метформин, но не глимепирид. В связи с этим увеличение дозы глимепирида вряд ли можно расценивать как клинически оправданный шаг для снижения повышенного уровня глюкозы плазмы натощак (> 6,2 ммоль/л).
В еще одном похожем исследовании R. Arechavaleta и соавт. изучали эффективность интенсификации терапии ситаглиптином в сравнении с глимепиридом. Амплитуда снижения HbA1c через 30 недель в группах глимепирида и ситаглиптина составила -0,54 и -0,47%, частота эпизодов гипогликемии – 22 и 7% соответственно (p < 0,001). Отметим, что у пациентов из группы лечения глимепиридом в начале исследования был невысокий уровень HbA1c – 7,49 ± 0,74%, а критерием включения в исследование был уровень HbA1c 6,5–9,0% [14] (рис. 4).
В двухлетнем международном исследовании B. Gallwitz и соавт. оценивали эффекты глимепирида и линаглиптина у пациентов с декомпенсированным СД 2 типа на фоне монотерапии метформином. Средний уровень HbA1c у пациентов из группы приема глимепирида составлял 7,7%, в том числе 21% пациентов имели HbA1c < 7%, а 46% пациентов – уровень HbA1c в диапазоне от 7 до 8%. К концу исследования эффективность интенсификации терапии в группе глимепирида и линаглиптина была расценена как равная. Анализ числа гипогликемических реакций выявил достоверно меньшую их частоту в группе приема линаглиптина, чем в группе приема глимепирида (7% по сравнению с 36%; p < 0,0001) [15]. Однако в этой связи следует обратить внимание на такую особенность дизайна исследования, как критерии включения по уровню HbA1c: 6,5–10,0% у пациентов на фоне монотерапии метформином и 6,0–9,0% у больных, получающих метформин в комбинации с любым другим гипогликемическим препаратом. Даже если не учитывать того, что в исследовании не был применен принцип индивидуализации целей лечения, возникает сомнение в необходимости интенсификации сахароснижающей терапии у пациентов с исходным HbA1c в диапазоне 6,0–7,0%. Кроме того, в данной работе, как и в исследовании E. Ferrannini и соавт., титрование дозы глимепирида производилось по уровню глюкозы плазмы натощак > 6,1 ммоль/л, определяемом при самоконтроле. Напомним: в целом общепринято, что добавление к терапии препаратов сульфонилмочевины или увеличение их дозы осуществляется для коррекции гликемических параметров в прандиальном состоянии, с учетом механизма действия препарата. Необходимость титрования дозы глимепирида определяется показателями постпрандиальной гликемии и гликемии в течение дня, а не уровнем глюкозы плазмы натощак.
Таким образом, углубленный анализ дизайна трех сравнительных исследований [12, 14, 15] позволил выявить особенности, которые могли привести к увеличению частоты побочных эффектов, в первую очередь гипогликемии, имея в виду гипогликемический потенциал препаратов сульфонилмочевины. Общим недостатком этих исследований следует признать относительно невысокий исходный уровень HbA1c (в среднем 7,3, 7,5 и 7,7% соответственно) и неоправданно быстрое наращивание дозы глимепирида. Примечательно, что в схожем по дизайну прямом сравнительном исследовании, проведенном S. Srivastava и соавт., у пациентов с высоким исходным уровнем HbA1c (8,2 и 8,3%), принимавших глимепирид и ситаглиптин, была показана более высокая эффективность глимепирида при сходном профиле безопасности [16] (рис. 5, 6), что подтверждает нашу гипотезу.
В этой связи вызывает интерес исследование M. Nauck и соавт., которое было посвящено сравнению влияния глимепирида и аналога глюкагоноподобного пептида-1 (ГПП-1) лираглутида на состояние углеводного обмена у пациентов с недостаточной компенсацией СД на фоне монотерапии метформином, исходное значение HbA1c в среднем составило 8,4%. Снижение уровня HbA1c было сопоставимым у пациентов, получающих лираглутид и глимепирид (-0,6 и -0,5% соответственно; p < 0,001), и не отмечалось у пациентов, продолжавших монотерапию метформином (+0,3%; p < 0,001), при этом были выявлены эпизоды нетяжелой гипогликемии как в группе приема лираглутида, так и в группе приема глимепирида (5 и 24% соответственно; p < 0,0001). К окончанию исследования (через 26 недель терапии) целевое значение HbA1c < 6,5% было достигнуто лишь у 14,5% пациентов, а HbA1c < 7,0% – у 23,5% больных СД, получавших глимепирид. При этом дизайн и протокол исследования не требовали индивидуализации целей терапии, что на современном этапе является неотъемлемым условием выбора терапевтической стратегии. Отметим полное отсутствие тяжелых гипогликемических реакций в данном исследовании, что, предположительно, обусловлено исходно высоким уровнем HbA1c (8,4%) у пациентов [17].
Таким образом, в исследованиях с участием пациентов, у которых исходное значение HbA1c составляло 7,9% и более [5, 6, 8, 17], тяжелых гипогликемических реакций не наблюдалось вовсе, а частота эпизодов гипогликемии была значительно ниже, чем в других упомянутых исследованиях, в которых исходный уровень HbA1c был невысоким, что подтверждает хороший профиль безопасности глимепирида на фоне качественной компенсации СД 2 типа. Данные, полученные в ходе большинства исследований, свидетельствуют о более высокой частоте развития гипогликемии на фоне приема глимепирида по сравнению с иДПП-4 и аналогами ГПП-1. Однако сравнительный анализ дизайна и результатов этих исследований позволяет подчеркнуть, что для формирования индивидуальных целей терапии необходима оценка степени исходной гипергликемии и уровня HbA1c. Все ведущие диабетические сообщества признают оправданным персональный подход и указывают на важность индивидуализации целей и тактики сахароснижающей терапии, которые требуются и в повседневной клинической практике. При значительном повышении уровня HbA1c требуется мощное терапевтическое вмешательство, которое обеспечивает назначение глимепирида, при этом риск гипогликемии оказывается минимальным, а целевая коррекция углеводных параметров – достижимой. Использование иДПП-4 более приемлемо у пациента с умеренным повышением HbA1c, преимущественной постпрандиальной гипергликемией или при склонности к гипогликемии в анамнезе. Учитывая сложный многофакторный механизм регуляции углеводного обмена, в каждом клиническом случае необходимо учитывать риски и преимущества применения того или иного препарата и принимать решение на основании полной клинической картины, не ограничиваясь уровнем HbA1c или глюкозы плазмы натощак.
Конечной целью любого подхода, который используется для нормализации гликемии, является снижение частоты и темпов развития поздних осложнений СД 2 типа. В связи с этим отсутствие отрицательного влияния терапии на состояние миокарда и сердечно-сосудистую систему в целом является очень важной характеристикой препарата, применяющегося у пациента с СД 2 типа. По этой же причине весьма ценно наличие у гипогликемического препарата кардиопротективного плейотропного эффекта. Данные анализа предварительных исследований, не связанных с сердечно-сосудистыми прямыми конечными точками, свидетельствовали о положительном влиянии иДПП-4 на состояние миокарда больных СД 2 типа [18].
Однако недавно проведенные исследования не подтвердили наличие данного эффекта. Так, в исследование EXAMINE, проводившееся в 49 странах мира, было включено 5380 пациентов, рандомизированных в группы приема иДПП-4 алоглиптина либо плацебо в двойном слепом режиме в дополнение к стандартной (базовой) терапии СД 2 типа на фоне факторов риска острых сердечно-сосудистых осложнений. Первичная конечная точка (показатель частоты сердечно-сосудистой смерти, инфаркта миокарда и инсульта) с одинаковой частотой отмечалась у пациентов, получавших алоглиптин и плацебо (11,3 и 11,8% соответственно; p < 0,001). У пациентов, принимавших алоглиптин, уровень HbA1c был ниже, чем в группе плацебо: средняя величина изменения по отношению к исходному значению составила -0,33 и +0,03% соответственно (p < 0,001). Частота гипогликемии и других побочных эффектов в обеих группах была сходной. Первичная цель исследования EXAMINE, заключавшаяся в том, чтобы продемонстрировать безопасность иДПП-4 алоглиптина для сердечно-сосудистой системы, была достигнута, однако положительное влияние препарата на состояние сердечно-сосудистой системы (вторичная цель), а значит и его кардиопротективные преимущества, доказать не удалось [19].
Более крупное, двухлетнее многоцентровое рандомизированное плацебоконтролируемое исследование IV фазы SAVOR-TIMI 53 (Saxagliptin assessment of vascular outcomes recorded in patients with diabetes mellitus trial) [20] включало более 16 тысяч пациентов с СД 2 типа, исходным уровнем HbA1с 6,5–12,0% и сердечно-сосудистыми заболеваниями в анамнезе или несколькими факторами риска их развития. Первичная конечная точка исследования – составной показатель частоты сердечно-сосудистой смерти, несмертельного инфаркта миокарда и несмертельного ишемического инсульта – наблюдалась у 7,3% пациентов, получавших саксаглиптин, и у 7,2% пациентов в группе приема плацебо (отношение рисков (ОР) 1,00; p = 0,99 для оценки превосходства и p < 0,001 для оценки не меньшей эффективности). Частота достижения вторичной конечной точки (сердечно-сосудистая смерть, инфаркт миокарда, инсульт или госпитализация вследствие сердечной недостаточности, нестабильной стенокардии или коронарной реваскуляризации) также была примерно одинаковой в обеих группах и составила 12,8% в группе лечения саксаглиптином и 12,4% в группе приема плацебо (ОР = 1,02; p = 0,66) (рис. 7). Что касается показателей контроля уровня гликемии, к концу лечения у пациентов в группе приема саксаглиптина степень достижения уровня HbA1c < 7% была выше: 36,2% в сравнении с 27,9% в группе плацебо (p < 0,001). Однако в группе лечения саксаглиптином достоверно больше пациентов, чем в группе плацебо, перенесли хотя бы один эпизод гипогликемии (15,3% в сравнении с 13,4%; p < 0,001), несмотря на то что значительной разницы по частоте госпитализаций вследствие гипогликемии не отмечалось. Неприятной находкой в этом исследовании стало не объясненное патогенетически, но статистически достоверное увеличение частоты госпитализаций по поводу сердечной недостаточности в группе пациентов, принимавших саксаглиптин (3,5% в сравнении с 2,8% в группе плацебо).
Сахароснижающий эффект иДПП-4, показанный в обоих исследованиях, был весьма умеренным – -0,3% при исходном HbA1c 8,0% за двухлетний период терапии в исследовании SAVOR-TIMI 53 в группе пациентов, принимавших саксаглиптин, и за 36 месяцев лечения в исследовании EXAMINE в группе приема алоглиптина. Авторы исследования SAVOR-TIMI 53 пришли к выводу, что комплексная терапия больных СД 2 типа с применением саксаглиптина является эффективной и безопасной, однако доказать превосходство терапии саксаглиптином в отношении влияния на сердечно-сосудистую систему над другими видами сахароснижающей терапии им не удалось.
В ходе исследования VIVIDD (Vildagliptin in Ventricular Dysfunction Diabetes – Вилдаглиптин при сахарном диабете и дисфункции желудочков) проверяли гипотезу о возможной протективной роли иДПП-4 в лечении пациентов с СД 2 типа и сопутствующей хронической сердечной недостаточностью (ХСН). Пациенты были рандомизированы в группы лечения вилдаглиптином (n = 128) и плацебо (n = 126). Известно, что контролировать метаболические и гемодинамические показатели у таких пациентов особенно сложно, прогноз становится очень неблагоприятным при достижении III и IV стадий ХСН. При оценке динамики ключевых параметров состояния миокарда и гормонально-метаболических характеристик больных с I и II стадиями ХСН было показано нейтральное влияние вилдаглиптина, что позволило говорить о безопасности его применения у таких пациентов, однако подтвердить наличие кардиопротективного действия вилдаглиптина не удалось. Состояние пациентов, имевших более выраженные нарушения, соответствующие III стадии ХСН, характеризовалось другими тенденциями. В рамках исследования VIVIDD было установлено ухудшение показателей гемодинамики, объема и функции миокарда левого желудочка у пациентов с СД 2 типа (HbA1c 6,5–10,0%) в сочетании с сердечной недостаточностью III функционального класса по классификации NYHA (New York Heart Association – Нью-Йоркская ассоциация кардиологов). У больных, получавших вилдаглиптин, отмечено значительное увеличение конечно-диастолического (р = 0,007) и конечно-систолического объема левого желудочка (р = 0,06), а также показателя ударного объема (p = 0,002). При этом смертность от любых причин также была выше в группе лечения вилдаглиптином (11 случаев на фоне приема вилдаглиптина против 4 в группе плацебо) [21]. Первый анализ полученных данных не позволяет делать окончательные выводы – слишком малочисленна и неоднородна была группа пациентов, включенных в исследование VIVIDD, однако очевидно, что применять иДПП-4 у пациентов с СД и выраженной сочетанной ХСН (III функционального класса по NYHA) нужно с осторожностью.
Таким образом, результаты проведенных исследований не позволяют говорить о значительных преимуществах применения иДПП-4 по сравнению с препаратами сульфонилмочевины в отношении сердечно-сосудистой системы. В достижении должного уровня гликемического контроля иДПП-4 демонстрируют высокий уровень безопасности, особенно в отношении гипогликемических эпизодов, однако вместе с этим и не столь высокую эффективность по достижению целевого уровня HbA1c у больных с СД 2 типа в стадии декомпенсации. Дополнительное положительное влияние иДПП-4 на состояние сердечно-сосудистой системы, которое было заявлено на основании результатов ряда метаанализов и данных экспериментальных работ, не подтверждено данными продолжительных клинических исследований. В этой связи представляют интерес выводы, которые сделали эксперты Немецкого института по оценке качества и эффективности в здравоохранении (German Institute for Quality and Efficiency in Health Care, IQWiG) [22]. Они предположили, что только один препарат из группы иДПП-4, ситаглиптин, возможно, имеет минимальные преимущества перед другими препаратами, традиционно применяющимися для лечения больных СД 2 типа. Однако и это предположение высказывается лишь в отношении применения ситаглиптина у больных СД с нормальной массой тела, тогда как у остальных пациентов дополнительных преимуществ применения ситаглиптина и других иДПП-4, по-видимому, нет. В настоящее время нет доказательств и дополнительного преимущества использования иДПП-4 в монотерапии по сравнению с препаратами сульфонилмочевины, метформином и в комбинации с инсулином. Частота симптоматической гипогликемии в группе лечения ситаглиптином в комбинации с метформином была ниже, чем при использовании глимепирида в комбинации с метформином, однако пациенты в группе лечения ситаглиптином чаще прекращали лечение по причине развития нежелательных явлений, связанных с приемом препарата.
Результаты проведенных исследований не дают ответа на вопрос, какой препарат эффективнее и безопаснее, а значит, предпочтительнее для пациентов с СД 2 типа как в монотерапии, так и в составе комбинации, поскольку нет доказательств неоспоримого преимущества одного препарата перед другим (рис. 8), особенно если мы говорим о влиянии на микро- и макрососудистые осложнения СД. По этой причине в настоящее время невозможно унифицировать подход к терапии больных СД 2 типа и дать однозначные рекомендации в отношении выбора препаратов. Это еще раз подтверждает правильность индивидуального, персонализированного подхода к управлению СД 2 типа, который лежит в основе современных клинических рекомендаций и заключается в комплексной оценке всех метаболических и гемодинамических параметров, коморбидных состояний, индивидуальных клинических особенностей и определяет выбор тактики лечения каждого пациента. Мы должны учитывать не только потенциальную противодиабетическую эффективность предпочтительной стратегии, но и данные по всей шкале безопасности, а также доказательную базу по динамике патологических процессов на уровне органов-мишеней, снижению микро- и макрососудистых рисков на фоне проводимой терапии.
1. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. 2012. Vol. 35. № 6. P. 1364–1379.
2. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Вып. 6 / Российская ассоциация эндокринологов; под ред. И.И. Дедова, М.В. Шестаковой. М.: Информполиграф, 2013. 119 с.
3. Pi-Sunyer F.X., Schweizer A., Mills D., Dejager S. Efficacy and tolerability of vildagliptin monotherapy in drug-naive patients with type 2 diabetes // Diabetes Res. Clin. Pract. 2007. Vol. 76. № 1. P. 132–138.
4. Aschner P., Kipnes M.S., Lunceford J.K. et al. Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes // Diabetes Care. 2006. Vol. 29. № 12. P. 2632–2637.
5. Shade D.S., Jovanovic L., Schneider J. A placebo-controlled, randomized study of glimepiride in patients with type 2 diabetes mellitus for whom diet therapy is unsuccessful // J. Clin. Pharmacol. 1998. Vol. 38. № 7. P. 363–641.
6. Guo X.H., Lv X.F., Han P. Efficacy and safety of glimepiride as initial treatment in Chinese patients with Type 2 diabetes mellitus // Curr. Med. Res. Opin. 2013. Vol. 29. № 3. P. 169–174.
7. Charpentier G., Fleury F., Kabir M. et al. Improved glycaemic control by addition of glimepiride to metformin monotherapy in Type 2 diabetic patients // Diabet. Med. 2001. Vol. 18. № 10. P. 828–834.
8. Глинкина И.В., Королева А.В., Зилов А.В. Эффективность и безопасность свободной комбинации глимепирида и метформина у пациентов с сахарным диабетом 2 типа в условиях реальной клинической практики: наблюдательная программа // Эффективная фармакотерапия. Эндокринология. 2012. № 2. С. 16–21.
9. Javaz S.A., Soewondo P., Wang E., Admane K. PERSIST study: High rates of glimepiride-metformin treatment persistence in everyday practice leads to effective glycemic improvements among type 2 diabetes patients // ADA 2012. Poster 1124.
10. Bosi E., Camisasca R.P., Collober C. et al. Effects of vildagliptin on glucose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin // Diabetes Care. 2007. Vol. 30. № 4. P. 890–895.
11. Charbonnel B., Karasik A., Liu J. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes inadequately controlled with metformin alone // Diabetes Care. 2006. Vol. 29. № 12. P. 2638–2643.
12. Ferrannini E., Fonseca V., Zinman B. et al. Fifty-two-week efficacy and safety of vildagliptin vs. glimepiride in patients with type 2 diabetes mellitus inadequately controlled on metformin monotherapy // Diabetes Obes. Metab. 2009. Vol. 11. № 2. P. 157–166.
13. Аметов А.С. Сахарный диабет 2 типа. Проблемы и решения. М.: ГЭОТАР-Медиа, 2011. 720 с.
14. Arechavaleta R., Seck T., Chen Y. et al. Efficacy and safety of treatment with sitagliptin or glimepiride in patients with type 2 diabetes inadequately controlled on metformin monotherapy: a randomized, double-blind, non-inferiority trial // Diabetes Obes. Metab. 2011. Vol. 13. № 2. P. 160–168.
15. Gallwitz B., Rosenstock J., Rauch T. et al. 2-year efficacy and safety of linagliptin compared with glimepiride in patients with type 2 diabetes inadequately controlled on metformin: a randomised, double-blind, non-inferiority trial // Lancet. 2012. Vol. 380. № 9840. P. 475–483.
16. Srivastava S., Saxena G.N., Keshwani P., Gupta R. Comparing the efficacy and safety profile of sitagliptin versus glimepiride in patients of type 2 diabetes mellitus inadequately controlled with metformin alone // J. Assoc. Physicians. India. 2012. Vol. 60. March. P. 27–30.
17. Nauck M., Frid A., Hermansen K. et al. Long-term efficacy and safety comparison of liraglutide, glimepiride and placebo, all in combination with metformin in type 2 diabetes: 2-year results from the LEAD-2 study // Diabetes Obes. Metab. 2013. Vol. 15. № 3. P. 204–212.
18. Patil H.R., Al Badarin F.J., Al Shami H.A. et al. Meta-analysis of effect of dipeptidyl peptidase-4 inhibitors on cardiovascular risk in type 2 diabetes mellitus // Am. J. Cardiol. 2012. Vol. 110. № 6. P. 826–833.
19. White W.B., Cannon C.P., Heller S.R. et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes // N. Engl. J. Med. 2013. Vol. 369. № 14. P. 1327–1335.
20. Scirica B.M., Bhatt D.L., Braunwald E. et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus // N. Engl. J. Med. 2013. Vol. 369. № 14. P. 1317–1326.
21. McMurray J. et al. The Vildagliptin in Ventricular Dysfunction Diabetes (VIVIDD) trial HFC 2013. Abstract 99. 2013. May, 27 // www.escardio.org/congresses/hf2013/congress-to-you/Pages/vildagliptin-shows-no-adverse-effect-ejection-fraction-diabetic-patients-with-heart-failure.aspx
22. Germany’s IQWIG takes tough line on DPP-4 inhibitors in first retrospective benefit assessment // http://www.ihs.com/products/global-insight/industry-economic-report.aspx?id=1065980788
Effective and safe management of type 2 diabetes as a result of tailored hypoglycemic therapy
T.Yu. Demidova
Ya.M. Pakhomov, F.T. Abayeva
State Budgetary Educational Institution for Continuing Professional Education ‘Russian Medical Academy of Postgraduate Education’, Endocrinology and Diabetology Department
Sanofi Russia
Contact person: Tatyana Yulyevna Demidova, t.y.demidova@gmail.com
The authors discuss the choice of antidiabetic agent for the initial treatment of new-onset type 2 diabetes and for therapy intensification basing on the efficacy criteria, hypoglycemic episodes frequency and cardiovascular effects of the agents. In patients with high initial HbA1c, long acting sulphonylurea (e.g. glimepiride) is characterized by good glucose lowering activity, low risk of hypoglycemia, sustained effect and may be recommended as a first-choice agent for initial diabetes treatment and as second drug in case of uncontrolled diabetes on metformin therapy. Analysis of the results of long-term studies of dipeptidyl peptidase-4 inhibitors has not demonstrated their superiority over sulphonylureas in terms of cardiovascular risk.
Новости на тему
01.07.2022 11:00:00
16.06.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.