Эффективность фебуксостата у пациентов с умеренным снижением функции почек: результаты пилотного исследования
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить влияние максимальных доза фебуксостата на вероятность достижения целевого уровня МК и функцию почек у пациентов с подагрой и ХБП С3.
Материал и методы. В ретроспективное наблюдательное исследование были включены лица старше 18 лет с диагнозом «подагра» и уровнем МК в сыворотке крови более 360 мкмоль/л. Из 112 пациентов, которым впервые был назначен фебуксостат, была сформирована выборка, в которую вошли 29 (32,5%) больных с ХБП С3.
Стартовая доза фебуксостата – 80 мг/сут. При недостижении целевого уровня МК в сыворотке доза увеличивалась до 120 мг/сут.
Период наблюдения составлял не менее шести месяцев (26 недель).
Лабораторные исследования включали клинический анализ крови, определение сывороточного уровня глюкозы, креатинина, мочевой кислоты, трансаминаз, креатинфосфокиназы до начала и по окончании наблюдения.
Оценивалась динамика значений сывороточного уровня МК, креатинина и скорости клубочковой фильтрации (СКФ) в зависимости от достижения целевого уровня МК.
Результаты. Прием фебуксостата ассоциировался с достоверным снижением сывороточного уровня МК (503,02 ± 147,10 vs 283,70 ± 70,10 мкмоль/л, Δ МК – -227,3 [-313,3; -108,0] мкмоль/л, p < 0,0001), креатинина (131,4 ± 24,5 vs 117,8 ± 21,5 мкмоль/л, p = 0,03), а также с тенденцией к нарастанию СКФ (49,9 ± 8,6 vs 54,9 ± 14,5 мл/мин/1,73 м2, p = 0,1). Из 29 пациентов целевого уровня МК достиг 21 (72%). Увеличение средних значений расчетной СКФ было зафиксировано во всех группах, но статистически значимых различий не получено. Была также установлена обратная корреляционная зависимость между Δ МК и Δ СКФ (R = 0,49, p < 0,05).
Заключение. Прием фебуксостата в максимальной дозе может считаться эффективным и безопасным способом лечения подагры у пациентов с умеренно сниженной функцией почек. Возможность фебуксостата замедлять прогрессирование ХБП у таких больных зависит от выраженности уратснижающего эффекта препарата, однако это должно быть подтверждено в более крупных исследованиях.
Цель – оценить влияние максимальных доза фебуксостата на вероятность достижения целевого уровня МК и функцию почек у пациентов с подагрой и ХБП С3.
Материал и методы. В ретроспективное наблюдательное исследование были включены лица старше 18 лет с диагнозом «подагра» и уровнем МК в сыворотке крови более 360 мкмоль/л. Из 112 пациентов, которым впервые был назначен фебуксостат, была сформирована выборка, в которую вошли 29 (32,5%) больных с ХБП С3.
Стартовая доза фебуксостата – 80 мг/сут. При недостижении целевого уровня МК в сыворотке доза увеличивалась до 120 мг/сут.
Период наблюдения составлял не менее шести месяцев (26 недель).
Лабораторные исследования включали клинический анализ крови, определение сывороточного уровня глюкозы, креатинина, мочевой кислоты, трансаминаз, креатинфосфокиназы до начала и по окончании наблюдения.
Оценивалась динамика значений сывороточного уровня МК, креатинина и скорости клубочковой фильтрации (СКФ) в зависимости от достижения целевого уровня МК.
Результаты. Прием фебуксостата ассоциировался с достоверным снижением сывороточного уровня МК (503,02 ± 147,10 vs 283,70 ± 70,10 мкмоль/л, Δ МК – -227,3 [-313,3; -108,0] мкмоль/л, p < 0,0001), креатинина (131,4 ± 24,5 vs 117,8 ± 21,5 мкмоль/л, p = 0,03), а также с тенденцией к нарастанию СКФ (49,9 ± 8,6 vs 54,9 ± 14,5 мл/мин/1,73 м2, p = 0,1). Из 29 пациентов целевого уровня МК достиг 21 (72%). Увеличение средних значений расчетной СКФ было зафиксировано во всех группах, но статистически значимых различий не получено. Была также установлена обратная корреляционная зависимость между Δ МК и Δ СКФ (R = 0,49, p < 0,05).
Заключение. Прием фебуксостата в максимальной дозе может считаться эффективным и безопасным способом лечения подагры у пациентов с умеренно сниженной функцией почек. Возможность фебуксостата замедлять прогрессирование ХБП у таких больных зависит от выраженности уратснижающего эффекта препарата, однако это должно быть подтверждено в более крупных исследованиях.

Введение
Подагра – хроническое аутовоспалительное системное тофусное заболевание, которое характеризуется отложением кристаллов моноурата натрия в различных органах и тканях и развитием связанного с ним воспаления у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами [1–3].
Подагра – наиболее часто встречающийся воспалительный артрит у взрослых [4], распространенность которого продолжает увеличиваться в течение последних десятилетий [5, 6].
Известно, что повышение уровня мочевой кислоты (МК) связано с риском возникновения не только подагры, но и других метаболических нарушений и заболеваний, в том числе хронической болезни почек (ХБП) [7], что необходимо учитывать при назначении терапии.
Основным методом лечения подагры, в том числе при ХБП, является назначение уратснижающих препаратов. В Российской Федерации, как и в большинстве стран мира, зарегистрированы два из трех доступных ингибиторов ксантиноксидазы – аллопуринол и фебуксостат. Помимо уратснижающего действия оба препарата потенциально способны замедлять прогрессирование ХБП, что может быть опосредовано снижением МК в сыворотке крови ниже определенного уровня [8, 9]. Необходимо отметить, что далеко не все исследователи подтверждают нефропротективный эффект данных препаратов [10, 11]. Указывается также, что у разных препаратов он может различаться. При этом именно фебуксостат может быть оптимальным у пациентов с подагрой и гиперурикемией при снижении скорости клубочковой фильтрации (СКФ) [12, 13]. Преимуществом фебуксостата является преобладание печеночного метаболизма (около 70%) над почечной элиминацией, что позволяет активно использовать его без коррекции дозы у лиц с подагрой и умеренным снижением СКФ. Основание – выводы исследований фазы III. Так, у пациентов с исходным сывороточным уровнем МК более 480 мкмоль/л и сниженной функцией почек целевой уровень МК через три месяца приема фебуксостата в дозе 80 мг/сут был достигнут у 44%, в дозе 120 мг/сут – у 45%, в дозе 240 мг/сут – у 60%, тогда как прием низких доз аллопуринола не позволил достичь данной конечной точки [14].
Тем не менее остается неясным вопрос: связано ли предполагаемое благоприятное влияние фебуксостата на функцию почек с возможностью достижения целевого уровня МК?
Целью настоящего исследования стала оценка эффективности терапии максимальными дозами фебуксостата у пациентов с ХБП С3.
Материал и методы
Проведено ретроспективное когортное наблюдательное исследование. Из 112 пациентов с подагрой, находившихся под наблюдением в Научно-исследовательском институте ревматологии им. В.А. Насоновой в период с 2022 по 2024 г. в рамках фундаментального научного исследования «Разработка междисциплинарной персонализированной модели оказания помощи пациентам с аутовоспалительными дегенеративными заболеваниями (остеоартрит, остеопороз, саркопения, подагра, пирофосфатная артропатия) и мультиморбидностью (ожирение, сердечно-сосудистые заболевания)» № государственной регистрации 1021051403074-2 РК 122040400050-6, были отобраны 29 со сниженной функцией почек (СКФ от 30 до 60 мл/мин/1,73 м2), которым впервые был назначен фебуксостат.
Критерии включения в исследование:
- пациенты обоего пола в возрасте старше 18 лет с установленным диагнозом «подагра» (классификационные критерии Американской коллегии ревматологов и Европейской ассоциации ревматологов 2015 г.);
- пациенты, не принимавшие ранее фебуксостат и иные уратснижающие препараты как минимум на протяжении двух недель до включения в исследование;
- сывороточный уровень МК более 360 мкмоль/л;
- подписанное информированное согласие.
Критерии невключения:
- наличие противопоказаний, перечисленных в инструкции по применению фебуксостата [15];
- некорригируемая артериальная гипертензия, хроническая сердечная недостаточность третьей стадии и выше по классификации Нью-Йоркской ассоциации сердца, ишемическая болезнь сердца, стенокардия, постинфарктный кардиосклероз, безболевая ишемия миокарда, ишемическая кардиомиопатия, операции на сердце (аортокоронарное шунтирование, эндоваскулярное стентирование и др.), ишемический инсульт, транзиторная ишемическая атака;
- наличие любых других воспалительных заболеваний суставов;
- повышение уровня аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (АСТ) более чем в два раза.
Всем пациентам назначался фебуксостат в начальной дозе 80 мг/сут, которая при недостижении целевого уровня МК в сыворотке крови менее 360 мкмоль/л увеличивалась до 120 мг/сут.
Период наблюдения охватывал не менее шести месяцев (26 недель) непрерывного применения фебуксостата, по истечении которых проводилось повторное обследование.
Исходно оценивались антропометрические параметры: рост, масса тела, индекс массы тела (ИМТ) по формуле Кетле, наличие подкожных тофусов, сопутствующих заболеваний.
Лабораторные исследования включали клинический анализ крови, определение сывороточного уровня глюкозы, креатинина, МК, АСТ, АЛТ, креатинфосфокиназы (КФК). Они проводились до начала и по завершении 26 недель терапии фебуксостатом. СКФ рассчитывали с помощью уравнения CKD-EPI [16].
Профилактическая противовоспалительная терапия была обязательной и включала колхицин, нестероидные противовоспалительные препараты (НПВП) или низкие дозы глюкокортикоидов (ГК). Пациентам, имевшим противопоказания к назначению всех противовоспалительных препаратов, они не назначались. Выбор препарата для профилактики приступов артрита осуществлялся при помощи алгоритма, разработанного в Научно-исследовательском институте ревматологии им. В.А. Насоновой [17].
Анализировались изменения средних значений сывороточного уровня МК, креатинина и СКФ и вероятность достижения целевого уровня МК у всех пациентов и отдельно у достигших/не достигших целевого уровня МК.
Статистическая обработка полученных данных проводилась на персональном компьютере с использованием методов параметрической и непараметрической статистики, прикладных программ Statistica 12.0 (StatSoft. Inc., США). Для качественных признаков представлены абсолютные и относительные величины (n, %), для количественных – медиана, 25-й и 75-й перцентили, M ± SD. При сравнении двух независимых групп по количественным признакам применяли критерий Манна – Уитни, по качественным – χ2. В случае сопоставления зависимых групп использовали критерий Вилкоксона. Различия считали статистически значимыми при р < 0,05. Для отдельных параметров был проведен корреляционный анализ Спирмена.
Результаты
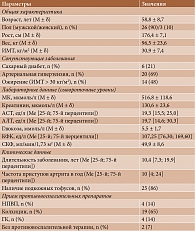
Как было отмечено ранее, из 112 пациентов с подагрой, которым впервые был назначен фебуксостат, была сформирована выборка из 29 (32,5%) лиц с ХБП С3. Клиническая характеристика этих больных представлена в табл. 1.
Из 29 пациентов терапию фебуксостатом в дозе 80 мг/сут получали 11 (38%), в дозе 120 мг/сут – 18 (62%).
С целью профилактики приступов артрита пациенты преимущественно получали колхицин (65%), значительно реже – НПВП и ГК (по 14%).
Через шесть месяцев терапии проанализированы изменения средних значений сывороточного уровня МК, креатинина и расчетной СКФ и вероятность достижения целевого уровня МК.
Длительный прием фебуксостата ассоциировался с достоверным снижением сывороточного уровня МК (с 503,02 ± 147,10 до 283,70 ± 70,10 мкмоль/л, Δ МК – -227,3 [-313,3; -108,0] мкмоль/л, p < 0,0001), креатинина (с 131,4 ± 24,5 до 117,8 ± 21,5 мкмоль/л, p = 0,03), а также с увеличением СКФ (с 49,9 ± 8,6 до 54,9 ± 14,5 мл/мин/1,73 м2), однако изменения не были значимыми (p = 0,1). Из 29 пациентов с умеренным снижением расчетной СКФ целевого уровня МК достиг 21 (72%). Среди достигших целевого уровня МК препарат в дозе 80 мг/сут получали 9 (43%) пациентов, в дозе 120 мг/сут – 12 (57%).
Далее были проанализированы пациенты, достигшие и не достигшие целевого уровня МК при приеме фебуксостата (табл. 2).
Был также проведен корреляционный анализ между Δ МК в сыворотке крови и Δ СКФ. В результате установлено наличие обратной корреляционной зависимости (R = 0,49, p < 0,05).
За время наблюдения ни у одного пациента не было зафиксировано развития нежелательных реакций, послуживших причиной отмены препарата.
Кроме того, была оценена гепатотоксичность длительной терапии фебуксостатом. Так, не было обнаружено значимых различий сывороточных уровней АЛТ (20,0 [14,0; 32,8] против 19,7 [14,6; 30,3] ед/л исходно и спустя шесть месяцев соответственно) и АСТ (19,3 [15,5; 25,0] против 21 [18,0; 30,2] ед/л) (р > 0,1 во всех случаях). Ни в одном случае не было зафиксировано более чем полуторакратного превышения нормативных значений данных показателей.
Обсуждение
Данное пилотное исследование – единственное, проведенное в Российской Федерации, и одно из немногих, в котором оценивалась эффективность приема фебуксостата в максимальных дозах у пациентов с подагрой и умеренным снижением функции почек (СКФ 30–60 мл/мин/1,73 м2) в отношении достижения целевого уровня МК и изменения показателей почечной функции.
В нашей работе целевого уровня МК удалось достичь у 72% пациентов. Полученные результаты согласуются с результатами других исследований. Так, в работе M.A. Becker и соавт., в которой фебуксостат назначался пациентам с предшествующей неэффективностью аллопуринола, уровень МК менее 360 мкмоль/л через 52 недели от начала терапии фебуксостатом в дозе 80–120 мг/сут сохранялся у 67% [18]. В работе Y. Shibagaki и соавт. прием фебуксостата на протяжении 24 недель способствовал стойкому снижению сывороточного уровня МК менее 6 мг/дл у 70% лиц с ХБП С3B–5 [19]. Аналогичные данные получены F. Borghi и соавт. [20]. Еще в трех исследованиях у пациентов с подагрой фебуксостат более эффективно снижал и поддерживал целевые сывороточные уровни МК, чем аллопуринол, в том числе при наличии легких и умеренных нарушений функции почек, причем различия в эффективности препаратов в большей степени проявлялись в субгруппах с ХБП [14, 21, 22].
Таким образом, наша работа подтвердила высокую вероятность достижения целевого уровня МК у пациентов с умеренным снижением функции почек. Полученные результаты сопоставимы с результатами другого нашего исследования, в котором определялась возможность достижения целевого уровня МК при проведении терапии фебуксостатом у пациентов, стратифицированных в зависимости от функции почек. Так, целевого уровня МК в сыворотке крови достигли 84%, при ХБП С0–1, С2, С3, С4 – 83, 89, 82 и 81% соответственно [23]. Средние значения расчетной СКФ в цитируемой выше статье через шесть месяцев лечения относительно исходных увеличились во всех группах, но значимые различия зарегистрированы лишь у пациентов с ХБП С0–1 (р = 0,002).
Согласно данным нашего исследования, у пациентов, принимавших фебуксостат, снижение расчетной СКФ не зависело от достижения или недостижения уровня МК менее 360 мкмоль/л, хотя эти изменения и не были статистически достоверными. Скорее всего, это связано с небольшим количеством пациентов (n = 29) и длительностью наблюдения.
Основная проблема подобных исследований у пациентов с подагрой заключается в невозможности формирования контрольной группы с учетом наличия прямых показаний к началу приема уратснижающих препаратов сразу после постановки диагноза [24].
В связи со сказанным ранее важен сам факт увеличения СКФ, причем довольно значительное (Δ расчетная СКФ – 7,0 [1,5; 11,1] мл/мин/1,73 м2, то есть на 10% относительно исходного показателя) и почти полное отсутствие снижения указанного показателя (у 2 (7%) пациентов). Подтверждением наших данных могут быть данные одного из самых крупных проспективных рандомизированных исследований с участием пациентов с ХБП С3 и гиперурикемией. Было показано, что прием фебуксостата в дозе 40 мг/сут в течение 104 недель по сравнению с применением плацебо достоверно уменьшал скорость снижения функции почек за счет контроля уровня МК. Анализ подгрупп продемонстрировал значительную пользу фебуксостата у пациентов без протеинурии (р = 0,005) и при концентрации креатинина в сыворотке крови ниже медианы (p = 0,009) [25].
Хотя мы не выявили статистически значимых различий в динамике СКФ между пациентами, достигшими и не достигшими целевых показателей МК, Δ СКФ было в пользу достигших целевого уровня. Кроме того, средние значения МК у пациентов, не достигших целевого уровня МК в сыворотке крови, были очень близки к нему – 383,6 ± 25,0 мкмоль/л. Аналогичные результаты были представлены X. Liu и соавт. Так, через шесть месяцев терапии прием фебуксостата ассоциировался с достижением целевого уровня МК в 96,4% случаев, в то время как прием аллопуринола – в 37,5% случаев. Через шесть месяцев расчетная СКФ в группе фебуксостата увеличилась с 28,45 до 30,65 мл/мин/1,73 м2, в группе аллопуринола снизилась с 28,06 до 24,39 мл/мин/1,73 м2. Линейный регрессионный анализ показал, что снижение сывороточного уровня МК достоверно было связано с увеличением расчетной СКФ и уменьшением протеинурии [26]. Принципиально важно, что продемонстрированная в нашем исследовании положительная динамика СКФ коррелировала с тем, насколько выраженным было снижение уровня МК относительно исходного.
Хотелось бы также отметить отсутствие нежелательных эффектов, подтверждающих возможность назначения препарата в максимальной дозе при ХБП.
За время наблюдения ни у одного пациента не было выявлено развития нежелательных реакций. Кроме того, длительный прием препарата не приводил к значимому увеличению сывороточного уровня АЛТ и АСТ.
Заключение
Результаты данного пилотного исследования эффективности приема максимальных доз фебуксостата пациентами с подагрой и умеренным снижением СКФ весьма обнадеживают в отношении возможности контроля подагры. Так, частота достижения целевого уровня МК составила 72% при хорошей переносимости терапии. Впечатляющей представляется и обратно коррелирующая со снижением урикемии динамика показателей СКФ, что свидетельствовало о стабилизации функции почек и нефропротективном потенциале фебуксостата.
Несмотря на ограничения, наиболее значимым из которых следует признать довольно малое число рекрутированных в исследование пациентов, полученные результаты предопределяют необходимость проведения более крупных исследований, направленных на оценку влияния на почечную функцию у пациентов с подагрой отдельных препаратов, потенциально способных замедлить прогрессирование ХБП.
Источники финансирования
Работа выполнена в рамках фундаментальной научной темы «Разработка междисциплинарной персонализированной модели оказания помощи пациентам с аутовоспалительными дегенеративными заболеваниями» № 1021051403074-2.
Авторы не получали гонорар за статью.
M.S. Yeliseyev, PhD, M.N. Chikina, PhD, O.V. Zhelyabina
V.A. Nasonova Research Institute of Rheumatology
Contact person: Maksim S. Yeliseyev, elicmax@yandex.ru
Treatment of gout involves the need to take into account concomitant diseases, including chronic kidney disease (CKD). Febuxostat in patients with gout and CKD and an initial decrease in renal function is considered as the drug of choice, but it is unclear whether its expected beneficial effect on renal function is related to achieving the target level of uric acid (UA) in blood serum.
The aim was to evaluate the effect of the maximum dose of febuxostat on the probability of achieving the target UA level and kidney function in patients with gout and stage three CKD.
Material and methods. The retrospective observational study included persons over the age of 18 with a diagnosis of gout and a serum UA level of more than 360 mmol/l. Of the 112 patients who were first prescribed febuxostat, a sample was formed, which included 29 (32.5%) patients with stage III CKD.
The starting dose of febuxostat was 80 mg/day, and if the target serum UA level was not reached, the dose increased to 120 mg/day.
The follow-up period was at least six months (26 weeks).
Laboratory tests included clinical blood analysis, determination of serum levels of glucose, creatinine, uric acid, transaminases, creatine phosphokinase before and after follow-up.
The dynamics of serum UA, creatinine, and glomerular filtration rate (GFR) values were evaluated.
Results. Febuxostat administration was associated with a significant decrease in serum UA (503.02 ± 147.10 vs 283.70 ± 70.10 mmol/l, Δ UA – -227.3 [-313.3; -108.0] mmol/l, p < 0.0001), creatinine (131.4 ± 24.5 vs 117.8 ± 21.5 mmol/l, p = 0.03), as well as the tendency to increase GFR (49.9 ± 8.6 vs 54.9 ± 14.5 ml/min/1.73 m2, p = 0.1). Of the 29 patients, the target level of UA reached 21 (72%). An increase in the average values of the calculated GFR was recorded in all groups, but no statistically significant differences were obtained. An inverse correlation was also established between Δ UA and Δ GFR (R = 0.49, p < 0.05).
Conclusion. Taking febuxostat at the maximum dose can be considered an effective and safe way to treat gout in patients with moderately reduced renal function. The ability of febuxostat to slow the progression of CKD in such patients depends on the severity of the urate-lowering effect of the drug, but it should be confirmed by larger studies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.