Терапия подагры при сниженной функции почек
- Аннотация
- Статья
- Ссылки
- English
Уратснижающая терапия подагры способна нивелировать патогенное действие мочевой кислоты, предотвращая развитие и прогрессирование хронической болезни почек. Однако у пациентов со сниженной функцией почек ее выбор должен быть более тщательным. Важно подобрать не только оптимальный уратснижающий препарат, но и режим его дозирования. В данной популяции определенные сложности вызывает также установление целей лечения и методов оценки его эффективности.
При наличии патологии почек наиболее перспективными представляются ингибиторы ксантиноксидазы.
Уратснижающая терапия подагры способна нивелировать патогенное действие мочевой кислоты, предотвращая развитие и прогрессирование хронической болезни почек. Однако у пациентов со сниженной функцией почек ее выбор должен быть более тщательным. Важно подобрать не только оптимальный уратснижающий препарат, но и режим его дозирования. В данной популяции определенные сложности вызывает также установление целей лечения и методов оценки его эффективности.
При наличии патологии почек наиболее перспективными представляются ингибиторы ксантиноксидазы.

Связь между подагрой и патологией почек установлена давно и общепризнана. В крупных исследованиях последних лет доказана роль подагры и гиперурикемии в качестве независимых факторов риска развития хронической болезни почек (ХБП) [1–5]. В то же время известно, что по мере снижения функции почек экскреция мочевой кислоты (МК) с мочой уменьшается, что способствует гиперурикемии и тем самым увеличению вероятности возникновения подагры, а также препятствует достижению целевых уровней МК при уже развившемся заболевании.
Парадигмой подагры считается воспаление, возникающее в местах отложения кристаллов натриевой соли МК и проявляющееся острыми приступами артрита [6]. Образование кристаллов возможно только в условиях гиперурикемии. При нормализации уровня МК кристаллы растворяются [7], что позволяет рассматривать подагру как потенциально излечимое заболевание [8].
Механизм развития микрокристаллического воспаления при подагре универсален вне зависимости от места его локализации, в том числе в случае отложения кристаллов МК в почках [9]. Клинические проявления и последствия острых приступов артрита и хронического воспаления при подагре напрямую связаны со стимуляцией кристаллами моноурата натрия инфламмасомы NLP3 с последующей секрецией путем активации каспазы 1 и высвобождением провоспалительных цитокинов, прежде всего интерлейкина (ИЛ) 1β, являющегося триггером воспалительного каскада [10, 11]. Этот механизм непрерывен, стоек и приводит к хроническому субклиническому воспалению, сохраняющемуся в суставах и других местах отложения кристаллов моноурата натрия в период ремиссии [11, 12]. Рецидивы острых приступов подагрического артрита, характеризующиеся сильнейшей болью, локальной гипертермией, нередко лихорадкой, непредсказуемостью, свидетельствуют о наличии в организме кристаллов [13].
В растворенном виде МК обладает достаточным провоспалительным потенциалом, чтобы индуцировать воспалительный процесс в почках [14–17].
МК оказывает аутокринное, паракринное и эндокринное воздействие. Высокая внутриклеточная концентрация уратов помимо транскрипционного фактора NF-κB стимулирует сигнальные пути митоген-активируемой протеинкиназы и факторы роста, вазоконстрикторы (ангиотензин II, тромбоксан, эндотелин), хемокины, способствует развитию митохондриальной дисфункции [17–20]. Гиперурикемия влияет на функцию эндотелиальных клеток за счет ингибиции их пролиферации и миграции, уменьшения биодоступности оксида азота в эндотелии [19, 21–23].
Подобный механизм развития воспаления при подагре приводит к развитию острого и хронического заболевания почек с повреждением почечных канальцев и формированием тубулоинтерстициального фиброза [9, 14].
Недавний метаанализ, включавший восемь исследований, продемонстрировал, что ХБП третьей стадии и более развивается у 24% (95%-ный доверительный интервал (ДИ) 19–28) пациентов с подагрой [24]. Согласно результатам ретроспективного когортного исследования A.G. Stack и соавт., в котором приняло участие 68 897 пациентов с подагрой и 554 964 человека из группы контроля, ХБП при подагре развивалась существенно чаще – 8,54 на 1000 пациенто-лет (95% ДИ 8,26–8,83) против 4,08 (95% ДИ 4,00–4,16) [2].
Необходимо отметить, что в общей популяции распространенность ХБП значительна и непрерывно увеличивается с возрастом. По данным глобального метаанализа, включавшего около сотни исследований, ХБП страдают от 11 до 13% населения, наиболее часто встречается ХБП третьей стадии – до 7,6% (более половины всех больных ХБП). При этом женщины болеют чаще, чем мужчины, – 14,6 против 12,8%. С возрастом распространенность ХБП возрастает, однако соотношение стадий не изменяется [25]. Частота встречаемости ХБП у пациентов с подагрой значительно выше. Таковая может достигать 20% [26]. При этом существенно повышается риск прогрессирования ХБП до терминальной стадии [1, 27].
Как было отмечено ранее, вероятность развития подагры при ХБП возрастает из-за уменьшения выведения МК. Распространенность подагры в когорте пациентов с расчетной скоростью клубочковой фильтрации (СКФ) ≥ 60 мл/мин/1,73 м2 составляет 16%, с расчетной СКФ < 30 мл/мин/1,73 м2 – 35,6%, то есть почти в два раза больше [28]. E. Mohammed и соавт. установили, что частота встречаемости подагры увеличивается по мере повышения стадии ХБП – с 7,5% при ХБП первой и второй стадий до 22,8% при ХБП четвертой и пятой стадий (p < 0,005) [29].
Хроническая болезнь почек оказывает существенное влияние на курацию пациентов с подагрой. Необходимо учитывать ограничения при выборе препарата и подборе дозы, а также потенциальное влияние такой терапии на прогрессирование и прогноз ХБП [30, 31].
Лечение подагры предполагает использование препаратов для купирования острого приступа артрита (нестероидные противовоспалительные препараты, колхицин, глюкокортикостероиды и ингибиторы ИЛ-1) и уратснижающих препаратов для поддержания сывороточного уровня МК, при котором приступы становятся маловероятными, а отложения кристаллов МК постепенно растворяются [8]. Поддерживать целевой уровень МК в крови следует пожизненно. Курсового лечения уратснижающими препаратами для этого будет недостаточно.
Каковы особенности назначения уратснижающей терапии пациентам с подагрой при ХБП?
В настоящий момент времени уратснижающая терапия представлена ингибиторами ксантиноксидазы, урикозуриками и препаратами пегилированной уриказы [32]. Наиболее часто используются ингибиторы ксантиноксидазы: аллопуринол и фебуксостат, которые снижают уровень МК за счет подавления ее образования.
Урикозурические препараты, такие как пробенецид, бензбромарон, сульфинпиразон и лезинурад, влияют на реабсорбцию МК и увеличивают ее выведение почками. Однако применение большей части урикозурических препаратов противопоказано или неэффективно при значительном снижении функции почек – СКФ < 30 мл/мин/1,73 м2. Лезинурад нельзя применять при СКФ менее 45 мл/мин/1,73 м2. Только бензбромарон имеет ограничение по СКФ 20 мл/мин/1,73 м2 [30]. Однако ни лезинурад, ни бензбромарон в Российской Федерации не зарегистрированы. Препараты данного класса, как правило, назначают в комбинации с ингибиторами ксантиноксидазы при их недостаточной эффективности.
Препараты пегилированной уриказы (пеглотиказы) превращают МК в аллантоин, резко снижая ее уровень в крови. Пеглотиказы, которые можно применять у пациентов с ХБП вне зависимости от ее стадии и которые не снижают СКФ [33], зарегистрированы к применению не во всех странах и также имеют ряд ограничений [34]. Возможность их использования ограничена из-за высокой стоимости и плохой переносимости.
Таким образом, основными препаратами для лечения подагры остаются ингибиторы ксантиноксидазы. Они способны оказывать положительное влияние на функцию почек за счет снижения сывороточного уровня МК [35, 36]. Потенциальный нефропротективный эффект также может быть связан со снижением окислительного стресса, воспаления, профилактикой развития гломерулярной гипертензии и утолщения стенок артериол [37, 38].
Согласно данным метаанализа, проведенного A. Pisano и соавт., в группе ингибиторов ксантиноксидазы существенно снижался риск прогрессирования ХБП до терминальной стадии по сравнению с контрольной группой (относительный риск (ОР) 0,42 (95% ДИ 0,22–0,80)) [39].
Препаратом первой линии терапии признан аллопуринол. Для лечения подагры его применяют более 50 лет. В организме аллопуринол превращается в активный метаболит – оксипуринол, который конкурентно ингибирует ксантиноксидазу, в результате чего снижается уровень ксантина и гипоксантина, а также выработка МК. Оксипуринол выводится почками преимущественно в неизмененном виде. При нормальной их функции период полувыведения составляет до 30 часов. При тяжелой ХБП время его выведения снижается параллельно с уменьшением СКФ и может увеличиваться до недели [40].
Максимальная доза аллопуринола при сохранной функции почек может составлять 900 мг/сут, но это небезопасно при выраженном снижении клиренса креатинина [41]. Основные риски при назначении аллопуринола связаны с развитием синдрома гиперчувствительности и тяжелых кожных реакций. Чаще это происходит при стартовой дозе 400 мг/сут и более, чем при дозе 100 мг/сут. В первом случае риск повышается в 23 раза [42].
У больных ХБП назначение аллопуринола сопряжено с более высокой частотой развития реакции гиперчувствительности, особенно если при инициации терапии доза не откорректирована в соответствии с СКФ [43]. В ряде исследований было продемонстрировано, что даже применение стандартных доз аллопуринола (200–400 мг/сут) у пациентов с ХБП повышает риск тяжелых кожных реакций. Таковые обусловлены накоплением оксипуринола и наиболее часто отмечаются в первые 60 дней лечения [41].
Таким образом, стартовая доза аллопуринола не должна превышать 100 мг/сут, дальнейшая ее эскалация проводится постепенно (50–100 мг/сут каждые две-четыре недели). Доза препарата должна лимитироваться в соответствии с показателями клиренса креатинина (таблица). Дозы аллопуринола представлены исходя из средней суточной дозы (300 мг/сут), максимально допустимая доза составляет 800–900 мг/сут (в зависимости от национальных рекомендаций).
Терапия аллопуринолом способна снизить риск развития ХБП. A.B. Vargas-Santos и соавт. доказали, что применение аллопуринола не менее 300 мг/сут ассоциировано с более низким риском прогрессирования ХБП до третьей стадии и более (ОР 0,87 (95% ДИ 0,77–0,97)) [44]. S. Golmohammadi и соавт. в плацебоконтролируемом исследовании с участием пациентов с ХБП третьей и четвертой стадий установили, что назначение аллопуринола в дозе 100 мг/сут в течение 12 месяцев достоверно снижало уровень МК (р = 0,004) [45]. Среди пациентов с более выраженным снижением расчетной СКФ не отмечалось прогрессирования ХБП. При умеренном нарушении функции почек уровень креатинина даже снижался и расчетная СКФ увеличивалась (р < 0,001). В группе плацебо аналогичного эффекта не наблюдалось.
Однако результаты других исследований не столь однозначны. Так, данные метаанализа восьми крупнейших исследований эффективности и безопасности аллопуринола при ХБП, в которые были включены пациенты с нарушением функции почек и гиперурикемией, не подтвердили выраженного влияния аллопуринола на функцию почек [46]. В пяти исследованиях из восьми динамика прогрессирования ХБП в группах аллопуринола и контроля достоверно не различалась (р = 0,1).
Важно подчеркнуть, что доза аллопуринола, назначенная исходя из клиренса креатинина, будет безопасна для пациентов, но зачастую не будет решать основную задачу – достижение целевого уровня МК. Так, при соблюдении данной стратегии дозирования вероятность достижения целевого уровня МК не превышает 50% [47]. В случае назначения аллопуринола пациентам с исходно сниженной СКФ, даже при ХБП менее третьей стадии, в связи с лимитированием дозы (часто в пределах 100–200 мг/сут) уровень МК снижается недостаточно, целевого уровня достигают менее 30% [48].
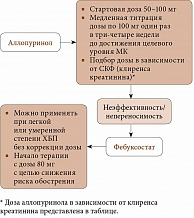
У пациентов с ХБП при высоком риске развития тяжелых кожных реакций, недостижении целевого уровня МК на фоне максимально допустимых доз аллопуринола возникает необходимость в назначении других уратснижающих препаратов, в частности фебуксостата (рисунок).
Фебуксостат, во-первых, чаще позволяет достигать целевого уровня МК, в том числе у большей части больных с неэффективностью аллопуринола, особенно при наличии сниженной функции почек [49], во-вторых, имеет преимущество перед аллопуринолом в отношении динамики СКФ в условиях почечной недостаточности [50, 51].
Среди возможных причин, обусловливающих большую эффективность фебуксостата у пациентов с ХБП, – преобладание метаболизма в печени (до 70%), то есть отсутствие зависимости от клиренса креатинина, а также ингибирование двух изоформ ксантиноксидазы [52].
Фебуксостат может применяться у пациентов с подагрой и ХБП в дозах 80 и 120 мг/сут без коррекции в зависимости от СКФ. Получены также данные об успешности применения в данной популяции фебуксостата в дозе 240 мг/сут, что превышает максимально рекомендованную суточную дозу. В исследовании H.R. Schumacher и соавт. пациенты, получавшие фебуксостат в любой дозе (80, 120 или 240 мг/сут), достоверно чаще достигали целевого уровня МК, чем принимавшие аллопуринол в дозах 100 или 300 мг/сут (корригировались в зависимости от функции почек) (р < 0,05) [53].
Результаты двойного слепого рандомизированного исследования CONFIRM, включавшего более двух тысяч пациентов с подагрой, показали, что при применении фебуксостата в дозе 80 мг/сут целевого уровня МК достигали 71,6% пациентов, тогда как при назначении аллопуринола в дозе 300 или 200 мг/сут при расчетной СКФ от 30 до 89 мл/мин/1,73 м2 таковых было только 42,3% [50].
Согласно данным X. Zhang и соавт., у пациентов с подагрой и ХБП, получавших фебуксостат, уровень МК был достоверно ниже, чем у применявших аллопуринол (р = 0,02). При этом риск снижения СКФ более чем на 10% от исходной был существенно меньше – 17,9 против 34,1% (р = 0,025) [51].
В когортном исследовании, проведенном H.W. Chou и соавт., 874 пациента были разделены на три группы: первая (n = 337) получала аллопуринол, вторая (n = 138) – фебуксостат, третья (n = 399) – бензбромарон [54]. В ходе исследования было показано, что фебуксостат эффективнее снижал уровень МК, чем аллопуринол и бензбромарон. Кроме того, применение фебуксостата и бензбромарона ассоциировалось с более низким риском развития терминальной почечной недостаточности, чем прием аллопуринола.
J.W. Lee и соавт. провели ретроспективное исследование, в которое был включен 141 пациент с ХБП третьей стадии и гиперурикемией [55], 30 из них получали фебуксостат, 40 – аллопуринол, 71 пациент не принимал уратснижающей терапии (контрольная группа). За период наблюдения (55,9 ± 31,8 месяца) средний уровень МК был значительно ниже в группе фебуксостата, чем в группе аллопуринола и контрольной группе, – 5,7 ± 1,0, 7,1 ± 1,2 и 8,0 ± 0,8 мг/дл соответственно (р < 0,001). Данный показатель очень важен в отношении прогрессирования ХБП. Так, в группе фебуксостата время без прогрессирования оказалось более длительным – 87,7 месяца (95% ДИ 71,2–104,2). Оно было достоверно больше, чем на фоне применения аллопуринола и в отсутствие уратснижающей терапии, – 77,6 месяца (95% ДИ 60,2–94,9; р < 0,001) и 48,7 месяца (95% ДИ 39,3–58,1; р < 0,001).
Метаанализ 11 исследований с участием 1317 пациентов показал, что расчетная СКФ была достоверно выше среди пациентов с ХБП третьей и четвертой стадий, получавших фебуксостат [56]. В исследовании EXCEL назначение фебуксостата по сравнению с назначением аллопуринола приводило к более стойкому снижению МК, что в свою очередь ассоциировалось с улучшением функции почек (р = 0,001) [57].
В 2019 г. X. Liu и соавт. опубликовали результаты одноцентрового проспективного исследования, в котором приняли участие пациенты с ХБП третьей – пятой стадий [58]. 112 больных получали терапию фебуксостатом, 96 – аллопуринолом. Критерием эффективности лечения выбрано достижение уровня МК < 360 мкмоль/л. Оценивалась также функция почек. Целевого уровня МК через шесть месяцев удалось достичь 96,4% в группе фебуксостата и 37,5% в группе аллопуринола. Расчетная СКФ в группе фебуксостата увеличилась с 28,45 до 30,65 мл/мин/1,73 м2, в группе аллопуринола снизилась с 28,06 до 24,39 мл/мин/1,73 м2. Линейный регрессионный анализ продемонстрировал, что снижение уровня МК было в значительной степени связано с увеличением расчетной СКФ и снижением протеинурии.
Коррекции дозы фебуксостата не требуется даже у пациентов с выраженным нарушением функции почек (ХБП третьей стадии и более). На старте терапии 80 мг/сут является оптимальной дозой. В случае недостижения целевого уровня МК в среднем через две недели ее целесообразно увеличить до максимальной – 120 мг/сут. Суточная доза фебуксостата, так же как суточная доза аллопуринола, назначается одномоментно.
Таким образом, несмотря на определенные сложности при подборе уратснижающей терапии пациентам с подагрой и ограниченной функцией почек, достижение целевого уровня МК и контроля над заболеванием возможно в большинстве случаев. Залог успеха терапии заключается в соблюдениии правил назначения препаратов.
A.M. Novikova, M.S. Yeliseyev, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Maksim S. Yeliseyev, elicmax@rambler.ru
Gout is often combined with kidney disease. At the same time, the pathology by itself and accompanying hyperuricemia are considered as independent nephrotoxic factors.
Urate-lowering therapy for gout can neutralize the pathogenic effect of uric acid, thus preventing the development and progression of chronic kidney disease. However, in patients with reduced kidney function, its selection should be more careful. It is important to select not only the optimal urate-lowering drug, but also the dosage regimen. In this population, certain difficulties also exist in establishing treatment goals and methods for evaluating its effectiveness.
In the presence of kidney pathology, xanthine oxidase inhibitors are the most promising.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.