Эффективность и безопасность различных режимов назначения эторикоксиба у пациентов с аксиальным спондилоартритом, включая анкилозирующий спондилит
- Аннотация
- Статья
- Ссылки
- English

Введение
Нестероидные противовоспалительные препараты (НПВП) являются средствами первой линии при многих воспалительных заболеваниях суставов (ревматоидном, псориатическом и подагрическом артритах) [1]. НПВП признаны едва ли не самыми употребляемыми во всем мире [1]. Нередко НПВП рассматривают и применяют как симптоматические средства для купирования боли и жара. Вместе с тем им принадлежит особая роль в лечении аксиальных спондилоартритов (аксСпА). НПВП воздействуют на метаболизм арахидоновой кислоты, изменяя тем самым активность циклооксигеназы (ЦОГ). Таким образом достигается противовоспалительный эффект. Это позволяет отнести лечение НПВП к патогенетическим видам терапии спондилоартритов (в том числе анкилозирующего спондилита (АС)) [2, 3]. Более того, уже имеются данные о способности НПВП не только подавлять воспаление в различных отделах опорно-двигательного аппарата, но и снижать прогрессирование структурных изменений в позвоночнике, замедляя рост синдесмофитов, возможно, за счет подавления активности мезенхимальных клеток-предшественников остеобластов [4–7]. Именно поэтому некоторые ученые и врачи стали рассматривать НПВП не только как симптом-модифицирующие, но и как болезнь-модифицирующие препараты при аксСпА.
Тем не менее до сих пор нет ответа на ряд важных для лечения аксСпА вопросов: как долго и в каких режимах назначать НПВП, когда отменять и возобновлять терапию? С одной стороны, учитывая персистирующий характер воспаления, больные аксСпА должны принимать НПВП длительно, а возможно, и постоянно. С другой – нежелательные явления (НЯ) со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы, системы гемостаза и почек [8, 9], связанные с приемом НПВП, ограничивают возможность продолжительного приема данных препаратов и требуют изучения различных режимов назначения НПВП для выбора оптимального с точки зрения соотношения «польза – риск» [10].
Целью настоящего исследования стало изучение клинико-лабораторных показателей эффективности и безопасности различных режимов применения эторикоксиба (ЭТ) у пациентов с аксСпА, включая АС.
Материал и методы исследования
В исследовании участвовали 40 пациентов с аксСпА в возрасте от 18 до 55 лет, находившихся на лечении в отделении ревматологии Областной клинической больницы г. Саратова в 2012 г. Пациенты включались в исследование после подписания формы информированного согласия на участие.
Все пациенты удовлетворяли критериям Международного общества специалистов по спондилоартритам (Assessment of SpondyloArthritis international Society, ASAS) для постановки диагноза аксСпА [11]. У 24 (60%) пациентов рентгенография показала признаки двустороннего сакроилеита II стадии или одностороннего сакроилеита III–V стадии [12] и удовлетворяла модифицированным Нью-Йоркским критериям для анкилозирующего спондилита [13]. 16 (40%) пациентов имели признаки остеита по данным магнитно-резонансной томографии в отсутствие признаков сакроилеита по данным рентгенографии [14]. Все участники показали высокую степень клинической активности аксСпА – индекс BASDAI (Bath Ankylosing Spondylitis Disease Activity Index – Батский индекс активности анкилозирующего спондилоартрита) ≥ 4. В исследование включали больных, ранее не принимавших НПВП, получавших НПВП прерывисто (курсами до 14 дней) или принимавших постоянно в дозах, ниже рекомендованных для конкретного препарата. Из исследования исключали тех, кто перенес инфаркт миокарда, инфаркт головного мозга, имел неконтролируемую артериальную гипертонию, страдал сахарным диабетом, почечной или печеночной недостаточностью, а также пациентов с указанием на наличие эрозивных или язвенных изменений ЖКТ, кровотечений в анамнезе, пациентов с бронхиальной астмой или обострением других хронических заболеваний, вирусными гепатитами, ВИЧ-инфекцией, онкологическими и онкогематологическими заболеваниями, беременных.
Выбор ЭТ для настоящего исследования определен тем, что постоянный прием НПВП в течение 12 недель требовал особого внимания к состоянию ЖКТ [15–17]. Вероятность развития сердечно-сосудистых событий в обследуемой популяции мы попытались снизить путем ограничения возраста обследуемых, исключения пациентов с сердечно-сосудистыми заболеваниями и высоким сердечно-сосудистым риском. C учетом указанных особенностей планируемого исследования для длительного приема нами выбран ЭТ (MSD, Аркоксиа®) как препарат с наилучшей желудочно-кишечной безопасностью, обусловленной максимальной селективностью в отношении ингибирования ЦОГ-2/ЦОГ-1 (105) [18], и как препарат, ранее показавший высокую эффективность в терапии АС [19].
Пациенты были рандомизированы (метод конвертов) на две группы. 30 пациентов из группы постоянного приема получали ЭТ в дозе 90 мг ежедневно, десять пациентов из группы прерывистого приема – 90 мг ЭТ один – три раза в неделю. Характеристика особенностей пациентов представлена в таблице.
Эффективность лечения оценивали на 2-й и 12-й неделе. Для этого изучали изменение индексов активности аксСпА (BASDAI [20], ASDAS – Ankylosing Spondylitis Disease Activity Score – индекс активности анкилозирующего спондилита) [21], динамику лабораторных показателей – скорости оседания эритроцитов (СОЭ) методом Панченкова и уровня С-реактивного белка (вчСРБ), определяемого высокочувствительным иммунофотодиметрическим методом с применением реактивов фирмы Diasis (аппарат Hitachi). Учитывали число (процент) пациентов, достигших ответа ASAS20, ASAS40 и частичной ремиссии ASAS, улучшения индекса BASDAI на 50% (BASDAI50) [22]. Удовлетворенность пациента и врача лечением оценивали с помощью индексов PASS (Patient Acceptable Symptom State – состояние приемлемых симптомов для пациента) и PhASS (Physician Acceptable Symptom State – состояние приемлемых симптомов для врача) [23, 24].
Безопасность лечения оценивали на 2, 6 и 12-й неделе путем подсчета числа НЯ, контроля общего состояния и показателей жизнедеятельности (частота сердечных сокращений, частота дыхательных движений, артериальное давление и др.), определения лабораторных показателей – общего анализа крови, общего анализа мочи, уровней общего билирубина и его фракций, аспартат- и аланинаминотрансфераз, гаммаглутамилтранспептидазы, щелочной фосфатазы, мочевины, креатинина и глюкозы.
Статистическую обработку полученных данных проводили с использованием программ Microsoft Excel и Statistica 6.0. Для проверки соответствия распределения признака нормальному распределению применяли критерии Колмогорова – Смирнова и Шапиро – Уилка. Нормальным считалось распределение при p > 0,05. Для описания нормально распределенных количественных признаков использовалось среднее значение признака и среднее квадратичное отклонение (M ± SD). Для описания выборочного распределения признаков, отличающегося от нормального, указывались медиана, верхний и нижний квартили – Me [Q25; Q75]. Чтобы сравнить две группы с нормальным распределением количественного признака, определяли t-критерий Стьюдента для независимых групп (с учетом вида дисперсии признака, определенного методом Левена). При изучении корреляции двух нормально распределенных количественных признаков использовали метод Пирсона, при отклонении распределения от нормального, а также при анализе ассоциации качественных признаков метод Спирмена. Подсчитывали число (процент) пациентов, достигших того или иного ответа на терапию, с расчетом доверительного интервала (ДИ) для получения окончательного результата. Достоверность разницы количественных значений внутри одной группы рассчитывали с помощью критерия Вилкоксона. Различие считалось достоверным при p < 0,05 [25].
Одобрение локального этического комитета Саратовского государственного медицинского университета им. В.И. Разумовского Минздрава России получено.
Результаты
Пациенты групп постоянного и прерывистого приема ЭТ были сопоставимы по возрасту, полу, активности аксСпА и соотношению пациентов с дорентгенографическим аксСпА и АС (см. таблицу).
Эффективность лечения в группе постоянного приема ЭТ оказалась выше. На 2-й неделе ответа ASAS20 достигли 25 (83,3%, 95% ДИ [56,6; 98,6]%) и 4 (40%, 95% ДИ [12,2; 72,8]%) пациента из групп постоянного и прерывистого приема соответственно, ответа ASAS40 – 17 (56,7%, 95% ДИ [37,4; 74,5]%) и 2 (20%, 95% ДИ [2,5; 55,6]%), частичной ремиссии ASAS – 7 (23,3%, 95% ДИ [9,9; 42,3]%) и 0 (0%, 95% ДИ [0,0; 30,8]%) пациентов соответственно (различия между группами достоверны, p < 0,01 для всех). На 2-й неделе улучшение индекса BASDAI на 50% наблюдалось только у 2 (20%, 95% ДИ [2,5; 55,6]%) пациентов из группы прерывистого приема и у 11 (36,67%, 95% ДИ [19,9; 56,1]%) больных из группы постоянного приема. На 12-й неделе в группах постоянного и прерывистого приема ответа ASAS20 достигли 28 (93,3%, 95% ДИ [68,7; 99,4]%) и 4 (40%, 95% ДИ [12,2; 73,8]%) пациента, ответа ASAS40 – 22 (73,3%, 95% ДИ [49,3; 85,6]%) и 2 (20%, 95% ДИ [2,5; 55,6]%) пациента, частичной ремиссии ASAS – 7 (23,3%, 95% ДИ [9,9; 42,3]%) и 1 (10%, 95% ДИ [0,3; 44,5]%) пациент соответственно (p < 0,01 для всех). Пациентов с положительным PASS в группе постоянного приема ко 2-й неделе было 11 (36,67%, 95% ДИ [19,9; 56,1]%), к 12-й неделе – 18 (60%, 95% ДИ [40,6; 77,3]%). Число больных с положительным PASS в группе прерывистого приема ко 2-й неделе составило 2 (20%, 95% ДИ [2,5; 55,6]%), к 12-й неделе – 4 (40%, 95% ДИ [12,2; 73,8]%). До начала исследования пациентов с положительным PASS в обеих группах не было.
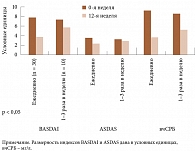
На фоне проводимой терапии у больных отмечалось уменьшение активности аксСпА. У пациентов из группы постоянного приема ко 2-й неделе индекс BASDAI снизился с 8 [4,6; 9,8] до 5,6 [2,8; 7,6], ASDAS – с 3,8 [2,6; 4,6] до 2,9 [2,3; 3,4], вчСРБ – с 9,5 [5,6; 13,3] до 4,5 [2,3; 6,7] мг/л соответственно. В группе прерывистого приема ко 2-й неделе индекс BASDAI уменьшился с 7,6 [3,9; 9,4] до 6,3 [3,7; 9,2], ASDAS – с 3,5 [2,8; 4,7] до 3,2 [2,6; 3,66], вчСРБ – с 8,8 [5,5; 12,3] до 6,5 [3,3; 7,4] мг/л соответственно. Различия всех показателей достоверны для обеих групп (p < 0,05). К 12-й неделе отмечено увеличение полученного эффекта – показатели активности снизились еще больше. Так, у пациентов группы постоянного приема к 12-й неделе индекс BASDAI снизился до 4 [2,2; 6,1], ASDAS – до 2,6 [2,1; 3,2], вчСРБ – до 3,9 [1,3; 5,6] мг/л соответственно. В группе прерывистого приема к 12-й неделе индекс BASDAI уменьшился незначительно по сравнению с группой, в которой пациенты принимали ЭТ постоянно (до 6,0 [3,2; 8,1]), индекс ASDAS снизился до 3,1 [2,5; 3,6], вчСРБ – до 4,5 [2,3; 7,2] мг/л соответственно. Различия всех начальных и итоговых показателей достоверны для обеих групп (p < 0,05). Существенной динамики значений СОЭ не отмечено. Изменения основных показателей активности представлены на рисунке.
В ходе контроля безопасности лечения зафиксировано пять НЯ: три – у пациентов с постоянным и два – у пациентов с прерывистым приемом ЭТ. НЯ были представлены изжогой, появившейся через семь дней постоянного приема ЭТ, купировавшейся после коррекции диеты и приема омепразола по 20 мг/сут (при эзофагогастродуоденоскопии изменений слизистой оболочки пищевода, желудка и двенадцатиперстной кишки не выявлено); повышением печеночных трансаминаз в пределах двух нормальных уровней на 2-й неделе у двух пациентов группы постоянного приема (показатели нормализовались на фоне коррекции диеты); у одного пациента с прерывистым приемом – появлением транзиторной микрогематурии (при обследовании дополнительный сосуд и дистопия правой почки); у пациента с прерывистым приемом – бессонницей на фоне эмоционального перенапряжения на 12-й неделе, НЯ купировалось после седативной терапии. Ни одно НЯ не потребовало отмены препарата. Серьезные НЯ не зарегистрированы.
Обсуждение
В настоящем исследовании показана эффективность приема ЭТ в дозе 90 мг при лечении пациентов с аксСпА. В цели настоящего исследования доказательство эффективности ЭТ при лечении АС не входило, поскольку эффективность НПВП и ЭТ, в том числе при аксСпА, была продемонстрирована в ряде контролируемых работ. Так, B. Amor и соавт. (1995) показали, что при терапии АС прием НПВП почти в четыре раза эффективнее, чем при устранении механической боли в спине [26]. В работе D. van der Heijde и соавт. (2005) отмечено превосходство ЭТ над плацебо при АС [19]. В других исследованиях продемонстрирована эффективность ЭТ в лечении аксиального поражения, ахиллобурсита и других проявлений аксСпА [27–30]. Коксибы уже включены в рекомендации первой линии для лечения АС, поскольку обладают максимальной желудочно-кишечной безопасностью и соответственно оптимально подходят для длительного лечения относительно молодой популяции пациентов с аксСпА [22, 30, 31]. Показано, что прием ЭТ снижает число эндоскопически выявляемых дефектов слизистой оболочки ЖКТ по сравнению с другими НПВП [28]. Анализ экономической эффективности применения эторикоксиба и других НПВП показывает, что ЭТ обладает экономическим превосходством над другими препаратами группы НПВП, если учитывать стоимость лечения желудочно-кишечных осложнений [31, 32]. Вместе с тем в применении коксибов у пациентов с АС остается много белых пятен. Неизвестно, насколько данные препараты уменьшают прогрессирование структурных повреждений позвоночника, есть ли необходимость в их ежедневном приеме. В настоящем исследовании мы установили преимущество постоянного приема ЭТ в дозе 90 мг/сут у пациентов с аксСпА по сравнению с прерывистым. Прием препарата один – три раза в неделю не только ассоциировался с худшими результатами лечения, но и характеризовался более медленным наступлением терапевтического эффекта. Интересно, что при обоих режимах дозирования препарата наблюдалось нарастание положительного эффекта, о чем свидетельствовало снижение как клинических, так и лабораторных показателей активности после двух недель терапии, и увеличение числа пациентов, достигших определенных результатов лечения. В известных нам исследованиях по эффективности НПВП при АС нарастания эффекта терапии не установлено [19, 33, 34]. Несоответствие данных, полученных нами, имеющимся данным, возможно, объясняется, во-первых, тем, что проводимые ранее исследования не включали пациентов с дорентгенографическим аксСпА. Ведь именно за счет улучшений у больных этой группы может нарастать положительный эффект лечения в целом. Во-вторых, во многих исследованиях при неэффективности НПВП пациентов переводили на лечение биологическими препаратами, не дожидаясь появления эффекта от терапии. Наши данные согласуются с результатами исследования INFAST (2014), в первой части которого показано, что у 35% пациентов с аксСпА, принимавших НПВП, развивается частичная ремиссия по критериям ASAS [35]. Более скромные результаты нашего исследования могут быть объяснены большей продолжительностью симптомов у пациентов (в INFAST участвовали с симптомами аксСпА, продолжавшимися менее трех лет). Д. Поддубным показано, что срок болезни менее трех лет – это прогностически благоприятный признак для лечения аксСпА [2, 6, 7, 8]. Частичная ремиссия у пациентов, не принимавших НПВП, сохранялась в течение 12 недель (медиана), у пациентов, принимавших НПВП, – до 26 недель [36]. Этот факт представляет несомненный интерес, поскольку в ходе настоящего исследования осталось неясным, как долго следует продолжать лечение ЭТ пациентам с частичной ремиссией.
Анализ литературы позволяет сделать следующий вывод: наше исследование является первым в изучении эффективности разных режимов применения НПВП. Полученные результаты согласуются с данными проспективных когортных исследований, показывающих, что чем выше суммарная доза принятого НПВП, тем эффективнее лечение и меньше риск прогрессирования аксСпА. Однако в указанных работах авторы принципиально учитывали среднее количество принятого пациентом препарата и не учитывали, в каком режиме и какой препарат принимали пациенты. Полученные нами данные представляются значимыми для клинической практики, хотя ввиду малочисленности выборки для расчета соотношения польза/риск необходимы длительные исследования с включением большего числа пациентов и оценкой не только клинико-лабораторной эффективности, но и структурно-модифицирующей составляющей эффективности лечения.
Заключение
На основании полученных данных можно сделать следующий вывод: ежедневный прием 90 мг ЭТ у пациентов с аксСпА, включая больных АС, превосходит по эффективности прерывистый режим применения препарата (три раза и менее в неделю).
Comparison of efficacy and safety of different etoricoxib regimens in axial spondyloarthritis/ankylosing spondylitis
I.Z. Gaydukova, A.P. Rebrov
V.I. Razumosky Saratov State Medical University of the Ministry of Health of Russia
Contact person: Inna Zurabievna Gaydukova, ubp1976@list.ru
Clinical and laboratory efficacy and safety of different etoricoxib regimens were estimated in patients with axial spondyloarthritis (SpA)/ankylosing spondylitis. Patients with active SpA were randomized into 2 groups:
30 patients received etoricoxib 90 mg daily (continuous treatment group), 10 patients were treated with the same dose of etoricoxib one to three times per week (intermittent treatment group). SpA activity indexes (BASDAI, ASDAS, ESR, hsCRP) were assessed initially, in the 2 and 12 week; adverse events were recorded initially, in the week 2, 6 and 12. Number of patients with ASA40 response was registered in the 2 and 12 week. In the continuous treatment group, in the 12 week, BASDAI decreased from 8 (4.6; 9,) to 4 (2.2; 6.1), ASDAS – from 3.8 (2.6; 4.6) to 2.6 (2.1; 3.2), hsCRP – from 9.5 (5.6; 13.3) to 3.9 mg/dl (1.3; 5.6). In intermittently treated patients, 12 week BASDAI decreased from 7.6 (3.9; 9.4) to 6.0 (3.2; 8.1), ASDAS – from 3.5 (2.8; 4.7) to 3.1 (2.5; 3.6), hsCRP – from 8.8 (5.5; 12.3) to 4.5 mg/dl (2.3; 7.2). In both groups, all activity parameters in the 12 week were significantly different from the initial values (p < 0.05). In the 12 week, ASAS40 response was achieved in 22 (73.3%) and 2 (20%) patients in the continuous and intermittent treatment groups, respectively (p < 0,01). No serious adverse effects were registered. Thus, in SpA/ankylosing spondylitis patients, daily treatment with etoricoxib 90 mg was more effective than intermittent therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.