Возможность применения нимесулида (Найза) у пациентов с анкилозирующим спондилитом после неэффективной терапии двумя другими противовоспалительными препаратами
- Аннотация
- Статья
- Ссылки
- English
При неэффективности двух НПВП, принимаемых последовательно в течение одного месяца, показаны ингибиторы фактора некроза опухоли альфа. Однако такая терапия требует существенных затрат.
В статье представлены результаты исследования эффективности нимесулида (препарата Найз) в форме таблеток у пациентов с анкилозирующим спондилитом после неэффективной предшествующей противовоспалительной терапии.
При неэффективности двух НПВП, принимаемых последовательно в течение одного месяца, показаны ингибиторы фактора некроза опухоли альфа. Однако такая терапия требует существенных затрат.
В статье представлены результаты исследования эффективности нимесулида (препарата Найз) в форме таблеток у пациентов с анкилозирующим спондилитом после неэффективной предшествующей противовоспалительной терапии.
Введение
Длительно персистирующий воспалительный процесс при анкилозирующем спондилите (АС) приводит к деструкции и прогрессированию структурных изменений опорно-двигательного аппарата. Пролиферативные изменения становятся причиной ограничения подвижности позвоночника и суставов и ухудшения качества жизни пациентов [1, 2].
Для торможения ремоделирования опорно-двигательного аппарата недостаточно купировать воспаление [3], необходимо воздействовать и на чрезмерную костную пролиферацию [4]. Указанными эффектами обладают нестероидные противовоспалительные препараты (НПВП) [5–8]. Международное общество по оценке спондилоартритов (Assessment of Spondyloarthritis International Society – ASAS) и Европейская лига по борьбе с ревматизмом (European League Against Rheumatism – EULAR) при АС в качестве препаратов первой линии рекомендуют НПВП, при сохраняющихся воспалении и высокой активности заболевания – их длительное применение [9]. В то же время указано, что в случае продолжительного использования НПВП возможно развитие нежелательных явлений (ульцерогенный, нефро- и гепатотоксические, сердечно-сосудистые эффекты) [5, 9].
Неэффективность двух НПВП, принимаемых последовательно в течение одного месяца, служит основанием для назначения ингибиторов фактора некроза опухоли альфа [9]. Эти препараты способны останавливать рентгенологическое прогрессирование АС (развитие синдесмофитов и анкилоза) только при длительной терапии [10], которая требует определенных ресурсов.
Однако вопрос, является ли отсутствие эффекта от приема двух НПВП в течение одного месяца весомым аргументом для отказа от подбора эффективного НПВП, остается открытым. Существуют работы, в которых была продемонстрирована эффективность нимесулида и эторикоксиба у пациентов с АС, не достигших ремиссии заболевания при приеме полных суточных доз двух других последовательно назначавшихся НПВП [11].
Целью настоящего исследования стало изучение эффективности нимесулида (препарата Найз, Dr. Reddy's) в форме таблеток у пациентов с АС после неэффективной предшествующей терапии двумя другими противовоспалительными препаратами.
Материал и методы
В исследовании приняло участие 40 пациентов старше 18 лет, отвечавших модифицированным Нью-Йоркским критериям анкилозирующего спондилита (1984) и подписавших информированное согласие на участие.
Критерием включения в исследование стало наличие боли в нижней части спины, оцениваемой по визуальной аналоговой шкале в 4 балла и более.
Все участники на протяжении трех месяцев до включения в исследование должны были принимать два разрешенных при АС противовоспалительных препарата в максимально переносимых терапевтических дозах. Отсутствие эффекта от проводимого лечения – обязательное условие.
Доза глюкокортикостероидов (эквивалентная преднизолону) не должна была превышать 10 мг в сутки и должна была оставаться стабильной в течение двух или более недель до первого визита (первый день). При применении пациентами метотрексата (не более 25 мг в неделю), сульфасалазина (не более 3 г в сутки), антигипертензивных препаратов их доза должна была быть стабильной в течение четырех и более недель до первого визита, анальгетиков – в течение недели.
Критерии исключения из исследования:
- боль в нижней части спины травматического характера или острая боль в нижней части спины (продолжительностью менее трех месяцев);
- любые хронические заболевания в стадии обострения;
- внутривенное, внутримышечное, интра- или периартикулярное введение глюкокортикостероидов за четыре и менее недели до скрининга;
- наличие противопоказаний к применению нимесулида;
- любая активная вирусная, бактериальная или грибковая инфекция на момент обследования, вирусный гепатит B или C, ВИЧ-инфекция;
- первичный или вторичный иммунодефицит;
- прием антикоагулянтов, двух дезагрегантов;
- острые психические заболевания, которые могли бы повлиять на способность пациента понимать требования исследования;
- фибромиалгия, алкогольная зависимость или употребление наркотических веществ в течение 12 месяцев, предшествовавших исследованию;
- вакцинация живыми вакцинами менее чем за 12 недель до первого визита; гиперчувствительность к любому компоненту исследуемого препарата;
- уровень гемоглобина < 85 г/л;
- нейтрофилов < 2000/мкл, тромбоцитов < 125 000/мкл, глюкозы в крови натощак ≥ 7 ммоль/л, креатинина сыворотки крови > 140 мкмоль/л (для женщин) или 160 мкмоль/л (для мужчин);
- повышение активности аспартатаминотрансферазы, или аланинаминотрансферазы, или щелочной фосфатазы, или гамма-глутамилтранспептидазы более чем в три раза относительно верхней границы нормы;
- бронхиальная астма, хроническая обструктивная болезнь легких или гиперреактивность бронхов, поллиноз;
- другая тяжелая неконтролируемая патология желудочно-кишечного тракта, печеночной, мочевыделительной, дыхательной, сердечно-сосудистой, нервной или эндокринной систем, онкогематологические заболевания.
Все пациенты получали нимесулид (препарат Найз, Dr. Reddy's) в суточной дозе 200 мг в течение четырех недель. Продолжительность наблюдения составила четыре недели.
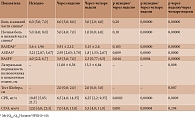
Эффективность терапии нимесулидом определяли по динамике общей оценки боли, ночной боли по данным числовых рейтинговых шкал (ЧРШ), функционального статуса после первой и четвертой недели наблюдения, подвижности позвоночника (тест Шобера и латеральная подвижность позвоночника в поясничном отделе) после первой и четвертой недели, показателей клинико-лабораторной активности заболевания после первой и четвертой недели.
Для определения активности АС рассчитывали BASDAI (Bath Ankylosing Spondylitis Activity Index) [13], ASDAS (ASAS-endorsed Disease Activity Score) [14, 15], оценивали уровень С-реактивного белка (СРБ) с помощью высокочувствительного метода с применением реактивов компании Diasis (аппарат Hitachi), скорость оседания эритроцитов (СОЭ) в общем анализе крови.
Для оценки функционального статуса определяли BASFI (Bath Ankylosing Spondylitis Functional Index) [16].
Статистический анализ выполнен с применением пакетов прикладных программ Statistica SPSS 17 и Statistica 8.0 (StatSoft).
Характер распределения данных оценивали графическим методом с использованием критериев Колмогорова – Смирнова и Шапиро – Уилка. Нормальным считалось распределение при p > 0,05.
Описание признаков, имеющих нормальное распределение, представлено в виде M ± SD, где М – среднее арифметическое, SD – стандартное отклонение. Для признаков с распределением, отличным от нормального, результаты представлены в виде Ме [Q25; Q75], где Me – медиана, Q25 и Q75 – первый и третий квартили.
Для сравнения результатов двух групп с нормальным распределением количественного признака определяли t-критерий Стьюдента для независимых групп (с учетом вида дисперсии признака, определенного методом Левена), парный t-тест для зависимых групп.
При характере распределения данных, отличном от нормального, применяли непараметрические методы: критерий Манна – Уитни, критерий Вальда – Вольфовица, критерий χ2, критерий Уилкоксона, критерий знаков.
Различия считались достоверными при p < 0,05 [17].
Результаты
Средний возраст пациентов составлял 36,69 ± 11,8 года. Из них 57,5% – мужчины.
Длительность заболевания – 5,0 [3,0; 14,0] года, приема НПВП – 1,0 [1,0; 2,0] года, глюкокортикостероидов – 0,0 [0,0; 1,0] года, болезнь-модифицирующих препаратов (метотрексата/сульфасалазина) – 0,0 [0,0; 1,0] года.
У всех участников отмечена высокая активность заболевания (BASDAI ≥ 4), уровень СРБ – 10,85 [5,85; 21,7] мг/л, СОЭ – 12,0 [6,0; 23,5] мм/ч.
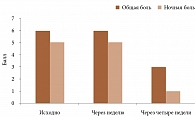
На фоне терапии нимесулидом достигнуто значимое снижение ночной и общей боли (см. рисунок).
Средние показатели клинико-лабораторной активности заболевания (СОЭ, СРБ, индекс ASDAS) уменьшились уже после первой недели приема нимесулида, улучшились также показатели функционального статуса пациентов (индекс BASFI) (см. таблицу).
Снижение показателей активности заболевания и улучшение функционального статуса продолжились и после четырех недель приема препарата.
Достоверное уменьшение выраженности болевого синдрома и улучшение подвижности позвоночника зафиксированы после четырех недель терапии (см. таблицу).
Обсуждение
Ранее НПВП считались симптоматическими средствами при АС, основной целью назначения которых было уменьшение болевого синдрома. Длительность использования таких препаратов надо было сокращать до минимума для предотвращения развития нежелательных явлений [9].
Сегодня НПВП относят к патогенетическим средствам. Как следствие, стали меняться и подходы к их применению [5–9, 18]. Так, получено достаточное количество данных, подтверждающих, что регулярный и длительный прием препаратов указанной группы достоверно эффективнее предотвращает прогрессирование структурных изменений опорно-двигательного аппарата, чем прием по требованию. В то же время результаты ряда исследований свидетельствуют, что нерегулярный/прерывистый прием НПВП связан с увеличением риска сердечно-сосудистой смерти пациентов с АС, регулярный прием – снижает риск развития сердечно-сосудистых событий [19].
К сожалению, приходится констатировать, что до сих пор нет четких схем использования НПВП. Отсутствуют и точные данные о том, когда именно должен наступить эффект от применения того или иного НПВП, какой показатель активности должен быть ориентиром для врача при принятии решения об изменении терапии. В клинической практике для этого, как правило, используют индекс BASDAI [13], который является субъективным показателем. При применении лабораторных маркеров, таких как СОЭ/СРБ, возникает вопрос о референсных значениях, которые необходимо считать значимыми для подтверждения эффективности лечения. Кроме того, клинико-лабораторная эффективность не всегда соответствует степени улучшения структурно-морфологических параметров. В частности, описан случай разрешения остеита у пациента с АС через две недели терапии НПВП [6]. Наше наблюдение за больным АС, принимавшим НПВП в непрерывном режиме, также подтвердило значительное снижение выраженности сакроилеита (по данным магнитно-резонансной томографии) через 12 недель терапии, однако купирование остеита было достигнуто лишь через 24 недели [11].
Поскольку рекомендации по подбору НПВП разрабатываются на основании мнения экспертов, эмпирически, в разных странах они различны [19]. Так, согласно рекомендациям ASAS после неэффективного применения двух последовательно назначенных НПВП в течение двух недель необходимо переходить на ингибиторы фактора некроза опухоли. В некоторых странах неэффективным признается применение в отсутствие эффекта от приема НПВП в течение трех месяцев [20]. Мы решили, что двух недель приема только двух НПВП недостаточно для констатации их эффективности или неэффективности у больных АС, поэтому провели исследование, показавшее эффективность и безопасность нимесулида в форме суспензии для лечения пациентов с АС, не достигших ремиссии или низкой активности заболевания на фоне двух других НПВП в полных дозах [11].
Вопрос безопасности оказался не менее актуальным: ранее мы публиковали данные клинической практики о высокой степени безопасности длительного применения нимесулида в отношении почек и печени [21]. Полученные результаты позволили сделать вывод: не следует отказываться от дальнейшего подбора НПВП при отсутствии эффекта от приема двух НПВП в течение двух недель, учитывая способность препаратов тормозить ремоделирование костной ткани [22, 23].
Результаты настоящего исследования продемонстрировали, что нимесулид (препарат Найз) в форме таблеток у пациентов с АС после неудачной предшествующей терапии двумя другими противовоспалительными препаратами способствует достоверному улучшению клинико-лабораторных показателей активности заболевания и функционального статуса, купированию болевого синдрома и улучшению подвижности позвоночника.
Исходя из полученных данных, считаем целесообразным продолжить изучение соотношения «риск/польза» у пациентов при приеме нимесулида в форме таблеток.
Вывод
Нимесулид (препарат Найз) может быть эффективен у пациентов с АС после неэффективной терапии двумя другими противовоспалительными препаратами.
E.V. Khondkaryan, I.Z. Gaydukova, A.V. Aparkina, A.P. Rebrov
Saratov State Medical University named after V.I. Razumovsky
Contact person: Inna Zurabiyevna Gaydukova, ubp1976@list.ru
Nonsteroidal anti-inflammatory drugs (NSAIDs) are considered as the first line drugs in therapy of ankylosing spondylitis. In case of inefficiency of two NSAIDs sequentially used within one month, it is prescribed to apply inhibitors of Tumor Necrosis Factor-alpha. However, such therapy requires substantial expenses. Here we present results from study assessing efficacy of nimesulide (Nise) tablets in patients with ankylosing spondylitis after previous inefficient anti-inflammatory therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.