Эффективность и безопасность введения мелоксикама (Мовалиса) в триггерные зоны при люмбоишиалгическом синдроме
- Аннотация
- Статья
- Ссылки
- English
Болевой спондилогенный синдром как междисциплинарная проблема остается объектом внимания врачей различных специальностей. В России на боль в нижней части спины приходится от 20 до 80% случаев временной нетрудоспособности в активной социальной группе и 20,4% в общей структуре инвалидности при дегенеративных заболеваниях костно-суставной системы [1, 2].
В отечественной классификации люмбоишиалгический синдром отнесен к рефлекторным вертеброгенным болевым синдромам и предполагает боль в поясничной области с иррадиацией в ногу без неврологического дефицита. В качестве источников рефлекторной импульсации рассматриваются дегенеративно-дистрофические изменения мышечно-связочных структур позвоночно-двигательного сегмента, включая изменения в диске, межпозвонковых (фасеточных) суставах и др.
В Международной классификации болезней 10-го пересмотра люмбоишиалгический синдром может кодироваться как М54.1 «Радикулопатия», М.54.4 «Люмбалгия с ишиасом», M.54.5 «Боль в нижней части спины». В данную рубрику включены болевые синдромы, не сопровождающиеся симптомами выпадения функций спинномозговых корешков или спинного мозга. Кроме того, люмбоишиалгический синдром в большинстве случаев сопровождает спондилогенные радикулопатии, которые в МКБ кодируются как М51.1 «Дегенерация межпозвонковых дисков поясничного и других отделов с радикулопатией».
Несомненно, значительную долю в структуре неспецифических болевых синдромов составляет миофасциальная боль, которую Д.Г. Симонс и Ж.Г. Трэвелл определяют как «локальную неспецифическую мышечную боль, обусловленную возникновением в мышце фокусов повышенной раздражимости (триггерных точек)». Важно, что для постановки диагноза миофасциального болевого синдрома необходимо воспроизвести ту боль, на которую жалуется больной, надавив на активную триггерную точку. Воспроизводимость боли – одно из необходимых условий диагностики миофасциальных синдромов [3].
Имеются данные о предпочтительном (ввиду развития более быстрого анальгетического эффекта) введении различных препаратов (анестетиков, бетаметазона, толперизона и др.) в триггерные точки перед внутримышечным введением [4, 5].
Абсолютно доказана целесообразность как можно скорейшего обезболивания пациента. Чем раньше начато лечение и быстрее достигнут значимый обезболивающий эффект, тем меньше вероятность хронизации боли и лучше общий прогноз. Общепризнанным для болей в спине является обезболивание с помощью нестероидных противовоспалительных препаратов [6, 7].
Нами предпринята попытка изучить эффективность и безопасность инъекционного введения в триггерные точки селективного ингибитора циклооксигеназы 2 мелоксикама (Мовалиса) при лечении люмбоишиалгического синдрома. Этот препарат был выбран по ряду причин. Во-первых, на сегодняшний день на российском рынке Мовалис – единственный селективный ингибитор циклооксигеназы 2 в инъекционной форме. Во-вторых, результаты многих клинических исследований свидетельствуют о низкой частоте развития побочных явлений на фоне применения Мовалиса и его эффективности в ступенчатой терапии болей в нижней части спины. В-третьих, одним из осложнений при локальном введении некоторых нестероидных противовоспалительных препаратов являются местное раздражение и очаговый некроз тканей, подтвержденные повышением уровня креатинфосфокиназы – изофермента, специфического для скелетных мышц. Ни в исследованиях на добровольцах, ни в клинических исследованиях повышения креатинфосфокиназы после внутримышечного введения мелоксикама отмечено не было. Данный препарат не вызывает местного раздражения и очагового некроза тканей, это несомненное преимущество при введении препарата в триггерные зоны. Кроме того, мелоксикам показал эффективность и безопасность не только в консервативном лечении артрозов, анкилозирующего спондилита, почечной колики, дисменореи, но и в хирургической практике при проведении эндопротезирования [8–10].
Материал и методы
С целью изучения эффективности различных лечебных комплексов проведено рандомизированное контролируемое клиническое исследование. Обязательным критерием включения в исследование было наличие болевого люмбоишиалгического синдрома. Критерии исключения – непереносимость мелоксикама, «аспириновая триада», язвенная болезнь желудка и/или двенадцатиперстной кишки в стадии обострения, клинически значимые нарушения функции печени или почек, а также беременность и кормление грудью.
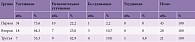
Обследованные 94 пациента распределялись по группам с помощью генератора случайных чисел, при этом в группах не отмечалось существенных различий по профессиональному составу, возрасту, сопутствующей патологии, которые могли влиять на исход заболевания. Продолжительность болевого анамнеза, люмбоишиалгии, обострения люмбалгии в группах была сопоставима (р > 0,05) (табл. 1).
В первой (основной) группе (n = 45) Мовалис вводился в триггерные точки по 15 мг/1,5 мл ежедневно в течение трех суток с последующим приемом препарата перорально 15 мг ежедневно в течение 20 дней. Наиболее часто триггерные зоны локализовались у гребня подвздошной кости (место прикрепления средней ягодичной мышцы), в проекции крестцово-подвздошного сочленения паравертебрально. Во второй группе (n = 28) Мовалис вводился внутримышечно по 15 мг/1,5 мл (одна ампула) ежедневно в течение трех суток с последующим приемом препарата перорально 15 мг ежедневно в течение 20 дней. В третьей (контрольной) группе (n = 21) пациенты не принимали Мовалис и/или другие нестероидные противовоспалительные препараты. Всем больным были назначены массаж пояснично-крестцовой области, лечебная физкультура по стандартным методикам.
Эффективность лечения оценивалась по Визуальной аналоговой шкале, Пятибалльной шкале оценки вертеброневрологической симптоматики [4]. Самочувствие больных отслеживалось в динамике: до лечения, после первого и третьего дня и после завершения курса лечения. До и после лечения пациентов просили заполнить Опросник нарушений жизнедеятельности при болях в нижней части спины Освестри (индекс Освестри), опросник Мак-Гилла. Для изучения функционального состояния нервов был использован метод стимуляционной электронейромиографии. Исследование проводилось по общепринятой методике на аппарате «Нейрон-Спектр-4» фирмы «Нейрософт» (г. Иваново). Анализировались показатели М-ответа и скорость проведения импульса до и после лечения.
Обработка данных проводилась с использованием пакета прикладных программ Primer of Biostatistics 4.03 («БИОСТАТ») общепринятыми методами вариационной статистики.
Результаты
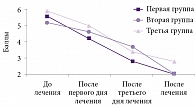
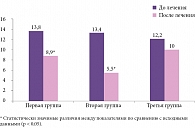
По Визуальной аналоговой шкале начальный уровень выраженности болевого синдрома в группах был сопоставим, хотя в первой группе был несущественно выше. Интенсивность болевого синдрома достоверно уменьшалась с первого дня лечения в первой и второй группах (p < 0,05). На третий день более значимый анальгетический эффект отмечался в первой группе (инъекции Мовалиса в триггерные зоны) по сравнению со второй группой (внутримышечное введение Мовалиса). Улучшение в третьей группе наблюдалось с третьего дня лечения. К концу курса лечения выраженность болевого синдрома в первой и второй группах выровнялась (рис. 1), при этом достоверно отличаясь от таковой в третьей группе.
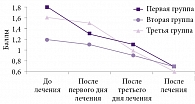
Оценка состояния пациентов по Пятибалльной шкале оценки неврологической симптоматики по объему движений и нейродистрофическому синдрому выявила положительную динамику во всех группах. Показатели объема движений в первой группе существенно улучшились уже с первого дня лечения, во второй и третьей группах – с третьего дня (p < 0,05) (рис. 2), хотя изначально в первой группе уровень ограничения движений и показатель нейродистрофического синдрома были выше, чем во второй и третьей группах (p < 0,05). К концу лечения улучшение объема движений было более выражено в первой группе.
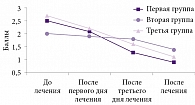
После завершения курса лечения выраженность нейродистрофического (миофасциального) синдрома в первой группе была достоверно ниже, чем до лечения (p > 0,05), а во второй и третьей группах имела место тенденция к уменьшению степени нейродистрофических проявлений (рис. 3).
Положительная динамика по показателю «корешковый синдром» наблюдалась в первой и второй группах с третьего дня лечения (p < 0,05). В третьей группе достоверной разницы до и после лечения не установлено (p > 0,05). Динамики по сколиозу не отмечено ни в одной из групп (p > 0,05).
При оценке эффективности лечения по опроснику Мак-Гилла, детализирующему интенсивность и характер болевых ощущений, выявлено, что сумма рангов и число слов-дескрипторов в группах до лечения сопоставимы. Достоверное улучшение по сумме рангов определялось во всех группах, но во второй группе (8,6 ± 1,7) было более отчетливым, чем в первой (17,8 ± 2,3) и третьей (17,3 ± 2,6). По количеству слов-дескрипторов достоверное улучшение наблюдалось в первой (8,9 ± 1,0) и больше во второй группе (5,5 ± 1,0) (рис. 4).
При оценке эффективности лечения по индексу Освестри, оценивающему качество жизни пациентов, получены достоверные различия во всех группах (p < 0,05). Улучшение было более выраженным в первой группе: 42,0 ± 2,6 до лечения и 28,1 ± 2,7 после лечения соответственно (p < 0,01). Менее выражено улучшение во второй (30,1 ± 2,4 и 19,6 ± 2,0 до и после лечения соответственно) и в третьей (31,6 ± 3,6 и 23,4 ± 3,3 до и после лечения соответственно) группах.
При проведении элекронейромиографии анализировались показатели М-ответа и скорость проведения импульса. У 38 (84,4%) пациентов в первой группе, 26 (92,9%) пациентов во второй и 16 (76,2%) пациентов в третьей группе при исследовании мышц ног выявлялись уменьшение амплитуды ЭМГ и единичные потенциалы фасцикуляций, а также снижение скорости проведения импульса и увеличение латентного периода М-ответа. Положительная динамика – повышение скорости проведения импульса и уменьшение латентности М-ответа – отмечалась у 20 (44,4%) больных в первой группе, семи (25,0%) во второй и девяти (42,9%) в третьей группе. Динамика скорости проведения импульса и М-ответа отсутствовала у шести (13,3%) больных в первой группе, девяти (32,1%) во второй и шести (28,6%) в третьей группе. Отрицательная динамика, то есть снижение скорости проведения импульса и увеличение латентного периода М-ответа, наблюдалась у одного (2,2%) больного в первой группе, у двух (7,1%) во второй и трех (14,3%) в третьей группе.
В целом более высокий эффект от лечения (положительная динамика неврологической симптоматики, улучшение по Визуальной аналоговой шкале, опроснику Мак-Гилла и индексу Освестри) получен в первой (75,6%) и второй (64,3%) группах (в третьей только 33,3%) (табл. 2). Доля пациентов с незначительным улучшением (улучшение по Визуальной аналоговой шкале, опроснику Мак-Гилла и индексу Освестри, но отсутствие неврологической динамики) в первой и второй группах была сопоставима (22,2 и 25,0% соответственно) и выше в третьей группе (42,9%). Отсутствие динамики по опросникам и неврологической симптоматике после проведенного курса лечения реже встречалось в первой группе (2,2%), чуть чаще во второй и третьей группах (10,7 и 19,0% соответственно). В третьей группе в одном случае (4,8%) наблюдалась отрицательная неврологическая динамика, что потребовало корректировки и продолжения лечения.
Введение Мовалиса как в триггерные зоны, так и внутримышечно не сопровождалось развитием местных побочных явлений. В первой группе у двух (4,4%) больных регистрировалось повышение артериального давления, еще у двух (4,4%) – диспепсические расстройства. У одного (2,2%) пациента развилась головная боль после первой блокады Мовалисом, тем не менее лечение было продолжено и впоследствии головные боли не повторялись. Во второй группе повышение артериального давления отмечено у двух (7,1%) больных, диспепсические расстройства – также у двух (7,1%) больных. В одном (3,6%) случае зарегистрировано обострение хронического эрозивного гастрита. В третьей группе в одном случае наблюдались спонтанная головная боль и тошнота.
Таким образом, улучшение субъективных показателей и результатов клинико-инструментального обследования после проведенного курса лечения в первой группе составило 75,6%, во второй группе – 64,3%, в третьей группе – 33,3%. При этом на третий день более выраженный анальгетический эффект регистрировался в первой группе (инъекции Мовалиса в триггерные зоны), но к окончанию курса лечения эффективность, оцениваемая по Визуальной аналоговой шкале, в первой и второй группах была сопоставима.
Выводы
При введении Мовалиса как в триггерные зоны, так и внутримышечно не отмечено местных побочных явлений. Количество больных с диспепсическими расстройствами и кратковременным повышением артериального давления было сопоставимо в первой и второй группах.
Анальгетический эффект на третий день был более выражен при введении Мовалиса в триггерные зоны по сравнению с внутримышечным введением, но к окончанию курса лечения эффективность, оцениваемая по Визуальной аналоговой шкале, в обеих группах была сопоставима.
Эффективность лечения после проведенного курса лечения по показателям Визуальной аналоговой шкалы, индекса Освестри и Пятибалльной шкале оценки вертеброневрологической симптоматики была выше в первой группе и составила 75,6% (во второй группе – 64,3%, в третьей группе – 33,3%).
V.A. Shirokov, A.V. Potaturko
Yekaterinburg Medical Research Center for Prophylaxis and Health Protection in Industrial Workers
Contact person: Vasily Afonasyevich Shirokov, vashirokov@gmail.com
The results of the evaluation of the efficacy and safety of Movalis (meloxicam) introduction at the trigger zones in vertebral lumbar sciatica syndrome are provided. 94 patients were treated, randomized into three groups. For the patients of the first group Movalis was administered in trigger points for three days, with subsequent use of the drug orally in the amount of 15 mg/day for 20 days. In the second group of patients Movalis was administered intramuscularly for three days, followed by taking the drug orally in the amount of 15 mg/day for 20 days. The patients of the third group (control) didn’t receive non-steroidal anti-inflammatory drugs. Treatment efficacy was evaluated by Visual Analogue Scale, the Five-Point Scale of Vertebroneurological Symptoms Assessing, the Oswestry Disability Index, the McGill Pain Questionnaire, as well as the results of stimulation electroneuromyography. In the case of both Movalis introduction in the trigger zones, and intramuscular injections local side effects were not noticed. Analgesic effect after injection in the trigger zones was more expressed than after intramuscular administration. Effectiveness of treatment was higher in the first group, amounting to 75.6%, compared with the second – 64.3%, and the third is 33.3%.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.