Эффективный контроль острой боли как важнейший элемент предупреждения ее перехода в хроническую: возможности применения нового препарата диклофенака калия
- Аннотация
- Статья
- Ссылки
- English
Острая интенсивная боль независимо от причины (ургентная патология, дебют хронического заболевания или его обострение) требует самого пристального внимания и активной врачебной помощи. Очевидно, что сильная боль вызывает тяжелые страдания и существенно снижает качество жизни пациента, поэтому первостепенной задачей лечащего врача должно быть ее быстрое и максимально полное устранение [1]. Следует напомнить, что возможность получить действенную обезболивающую терапию относится к числу базовых прав человека, провозглашаемых Всемирной организацией здравоохранения. В декларации 2014 г. облегчение боли и страданий называется этическим долгом медицинских работников [2].
Немаловажно, что именно эффективность купирования боли является для пациента одним из основных критериев качества лечения в целом, и недостаточный уровень обезболивания нередко становится причиной недовольства и жалоб больных. Так, недавно были опубликованы данные C. Kahlenberg и соавт. [3], которые оценили удовлетворенность больных после эндопротезирования коленного сустава. Это был метаанализ 208 исследований (n = 95560), в которых о результатах лечения судили на основании оценки пациента. В 84% работ более 80% больных были удовлетворены результатом операции. При этом главнейшим параметром, который определял положительное мнение пациента об исходе эндопротезирования, был низкий уровень послеоперационной боли.
Для пациентов, страдающих наиболее распространенными ревматическими заболеваниями, в частности ревматоидным артритом и остеоартритом, боль остается одним из основных симптомов, обусловливающим тяжесть патологии [4]. Так, до 90% больных ревматоидным артритом считают купирование боли приоритетным показателем эффективности лечения [5]. С этим согласны и эксперты Американской коллегии ревматологов (2010), которые отмечают, что устранение боли является, вероятно, самым важным оцениваемым пациентом результатом в ревматологии [6].
Надежный контроль боли позволяет добиться доверия пациента и хорошей приверженности терапии, что особенно значимо в том случае, когда заболевание носит хронический характер и требует длительного лечения. Недостаточный контроль острой боли становится одним из ключевых факторов ее хронизации. Как известно, хроническая боль – одна из наиболее актуальных глобальных медицинских и социальных проблем. Это причина стойкой потери трудоспособности, социальной активности и финансовых проблем для сотен миллионов жителей Земли. При этом лечение хронической боли требует больших усилий, сложной многокомпонентной терапии, включающей препараты с различным механизмом действия и немедикаментозные методики [1, 7, 8].
Связь острой и хронической боли
Предикторы перехода острой боли в хроническую активно изучались учеными всего мира. Так, имеются веские доказательства того, что плохо купированная боль в раннем послеоперационном периоде ассоциировалась с ее хронизацией при длительном наблюдении, особенно у пациентов с изначальной генетически или психологически обусловленной болевой гиперчувствительностью [9–11]. M. Blichfeldt-Eckhardt и соавт. проанализировали четыре работы, в которых оценивалось развитие послеоперационной боли при разных хирургических вмешательствах: холецистэктомии, лобэктомии и подключичной блокаде диафрагмального нерва [12]. Во всех случаях появление боли в послеоперационном периоде определялось чувствительностью к острой боли непосредственно после вмешательства и эффективностью анальгетической терапии (анестезиологического пособия). По данным метаанализа 32 исследований (n = 30 000), в которых изучались исходы эндопротезирования коленного сустава, важную роль в развитии хронической послеоперационной боли играли высокая интенсивность боли в раннем послеоперационном периоде, ее катастрофизация и связанные с этим психологические нарушения [13].
Аналогичная ситуация отмечается и в отношении развития хронической скелетно-мышечной боли. Здесь также имеются факторы, способствующие персистенции болевых ощущений и переходу их в хроническое состояние. Это психические нарушения (депрессия и тревожность), катастрофизация своего состояния, рентные установки, физический труд, избыточная масса тела и, конечно, высокая интенсивность боли в дебюте заболевания в сочетании с недостаточно эффективным лечением [14–16].
Влияние выраженности исходной боли на функциональный исход продемонстрировано в работе В. Friedman и соавт. [17]. Они оценивали функциональное состояние (по шкале Роланда – Морриса) 295 пациентов с неспецифической болью в спине через три месяца после первого визита в зависимости от результатов лечения в первую неделю. Худший функциональный результат четко ассоциировался с сохранением боли через неделю терапии – отношение шансов (ОШ) 4,0 (95%-ный доверительный интервал (ДИ) 2,1–7,7).
Большой интерес вызывает работа J. Clark и соавт. [18]. В ней изучались предикторы развития хронической боли по данным девяти исследований, в которых рассматривались такие патологические состояния, как хлыстовая травма, распространенная боль и дисфункция нижнечелюстного сустава. Основными факторами хронизации боли были высокая болевая чувствительность, катастрофизация, а также низкая оценка выздоровления в преморбидном и остром периоде.
Чтобы понять важность купирования острой боли для предупреждения ее хронизации, нужно четко представлять механизм развития этой патологии. Первичное повреждение живой ткани, вызванное любой причиной (травмой, микроорганизмами, аутоиммунным процессом), возбуждает специализированные периферические болевые рецепторы. Они формируют первичный ноцицептивный сигнал, который ощущается центральной нервной системой как острая боль. Активация ноцицептора происходит и за счет механического раздражения, и под воздействием субстанций, появляющихся в межклеточном пространстве при разрушении клеток. Это так называемый молекулярный паттерн повреждения (Damage-Associated Molecular Pattern – DAMP), представляющий собой смесь гистоновых белков, различных ферментов, обломков ДНК и РНК, мочевины, ионов К+, Н+, Са2+ и др. Кроме прямого воздействия на ноцицептор, DAMP взаимодействует с Toll- и Nod-подобными рецепторами клеток, осуществляющими биологическую защиту, макрофагов, синовиальных фибробластов, дендритных клеток и др. В результате происходит активация внутриклеточных сигнальных путей, которая вызывает синтез провоспалительных цитокинов (интерлейкинов 1-бета и 6, фактора некроза опухоли альфа, интерферона гамма и др.), запускающих воспалительный каскад. Активированные макрофаги М1, нейтрофилы и другие мезенхимальные клетки начинают продуцировать медиаторы воспаления, среди которых одно из центральных мест занимает простагландин Е2. Далее в области повреждения развивается локальное воспаление, а болевой рецептор оказывается погруженным в «воспалительный суп», представляющий собой раствор биологически активных субстанций. И цитокины, и медиаторы воспаления (простагландин Е2) способны взаимодействовать с рецепторами на поверхности нейрональной клетки, вызывая открытие особых трансмембранных каналов: TRPV, Nav 1.3, 1.7, 1.9, VGKCs, VGCCs, HVCN1, ASIC. Это приводит к изменению потенциала мембраны рецептора и значительному повышению чувствительности последнего к болевым и неболевым стимулам [19–24]. Возникает феномен периферической сенситизации и гипералгезии. Он хорошо известен и врачам, и пациентам: при развитии выраженного локального воспаления даже легкое прикосновение к области поражения вызывает сильную боль. При остром повреждении эти процессы цикличны и обратимы. Индуцированная воспалением репарация снижает ноцицептивную стимуляцию. Если дальнейшее повреждение ткани (источника DAMP) не происходит, то и само воспаление разрешается – провоспалительные клетки подвергаются апоптозу, медиаторы воспаления метаболизируются специальными ферментами и элиминируются [19].
К сожалению, иная ситуация отмечается при патологии, приводящей к значительным повреждениям ткани, например серьезных травмах и больших операциях. В этом случае нормальное восстановление ткани невозможно – ее замещает грубый фиброз (рубец), следствием чего становятся нарушения естественной биомеханики и дегенеративные процессы (неоангиогенез, неонейрогенез), которые существенно повышают чувствительность к механическим стимулам. То же самое происходит при хронических заболеваниях, сопровождающихся прогрессирующими структурными изменениями: остеоартрите коленных и тазобедренных суставов, хронической неспецифической боли в спине, которая связана с остеоартритом фасеточных и крестцово-подвздошных суставов, а также поражении межпозвонковых дисков и позвонков (остеите типа Modic). В этом случае длительная и интенсивная периферическая ноцицептивная стимуляция становится причиной изменений в вышележащих отделах болевой системы – возникает феномен центральной сенситизации. Его запускает стойкая активация нейронов, обусловливающая изменение трансмембранного потенциала и дисбаланс нейромедиаторов. Возникает реакция со стороны нейронального окружения – астроцитов и микроглиальных клеток, активация которых способствует развитию нейрогенного воспаления. Здесь также синтезируются цитокины интерлейкины 1-бета и 6, фактор некроза опухоли альфа, появляется циклооксигеназа 2 и образуется простагландин Е2. Кроме того, синтезируются и выделяются нейромедиаторы и нейротрофические факторы: фактор роста нервов, брадикинин, субстанция Р, глутамат и др. Активация соответствующих рецепторов (при этом важную роль играет рецептор глутамата NMDA) приводит к открытию лиганд-зависимых трансмембранных каналов. По сути, в вышележащих отделах ноцицептивной системы происходит процесс, близкий по природе периферической сенситизации. В итоге центральная сенситизация меняет восприятие боли – она приобретает характерную невропатическую окраску (боль описывают как «разрезающую», «холодящую», «бьющую током»), появляются такие симптомы, как отдаленная гипералгезия и аллодиния, распространенная боль и вторичная фибромиалгия [20, 21].
Таким образом, при сочетании периферических и центральных механизмов развивается хроническая скелетно-мышечная боль – отдельный синдром, который протекает по собственным патологическим законам. Но пусковым моментом этого страдания, конечно, являются периферическое повреждение и воспаление.
Лечение острой и хронической боли: роль диклофенака
Как было отмечено ранее, развитие периферической сенситизации зависит от локального воспаления, которое следует за повреждением ткани. Ключевую роль здесь играет простагландин Е2, который, взаимодействуя со специальными рецепторами (ЕР1-4), моделирует болевой порог ноцицептора, во многом определяя развитие его гиперчувствительности [25, 26]. Соответственно, препараты, блокирующие синтез простагландина Е2, в значительной степени уменьшают периферическую сенситизацию, а значит, выраженность и стойкость возбуждения самих болевых нейронов, провоцирующих появление феномена центральной сенситизации. Эти лекарства – хорошо известные НПВП, ингибиторы циклооксигеназы 2, оказывающие выраженное обезболивающее и противовоспалительное действие. Без сомнения, назначение НПВП для купирования острой боли полностью патогенетически обосновано. Более того, по мнению многих зарубежных экспертов, также совершенно оправданно включение в комплексную терапию хронической боли НПВП как средств, устраняющих периферическую составляющую этой патологии [27–29].
Самым известным и востребованным в мире представителем группы НПВП является диклофенак. Этот препарат был создан швейцарской фирмой Ciba-Geigy, появился на фармацевтическом рынке в 1974 г. и всего через два года вошел в практику врачей Советского Союза. Диклофенак – эффективное обезболивающее и противовоспалительное средство. Его высокий лечебный потенциал был доказан во всех клинических ситуациях, когда применяются НПВП: в анестезиологической практике и травматологии, для контроля онкологической боли, купирования почечной и печеночной колики и, конечно, обезболивания при самых разных ревматических заболеваниях [30].
P. McGettigan и D. Henry проанализировали использование различных НПВП в 15 разных странах мира, включая Великобританию, Канаду и Китай (данные на 2013 г.) [31]. Диклофенак уверенно занимал первое место по уровню продаж, опережая такие популярные НПВП, как ибупрофен и напроксен. По данным сайта www.drugs.com, на сегодняшний день в мире зарегистрировано более 1500 дженериков диклофенака. Препарат представлен во всевозможных лекарственных формах для перорального приема (таблетки, капсулы SR, быстродействующие формы, саше, сироп), в виде инъекций (для внутривенного и внутримышечного введения), ректальных и вагинальных свечей, глазных капель, назального спрея и разнообразных вариантах для местного применения (растворах, гелях и мазях).
В последние годы открылись новые аспекты фармакологического действия диклофенака. Этому вопросу посвящен специальный обзор F. Atzeni и соавт. [32], опубликованный в 2018 г. Оказалось, что помимо традиционного действия (блокады циклооксигеназы 2 и снижения синтеза простагландина Е2) диклофенак способен блокировать внутриклеточный сигнальный путь NO/cGMP, подавлять активность фосфолипазы А2, блокировать NMDA-рецепторы и Ca2+-каналы нейронов, снижать синтез субстанции Р, повышать концентрацию бета-эндорфинов, блокировать рецептор PPARγ и кислотозависимые клеточные каналы ASIC3 и ASIC1, опосредованно снижать синтез интерлейкинов 1-бета и 6, а также появление многих факторов роста.
Обилие дженериков, многие из которых откровенно плохого качества, существенно испортило славу диклофенака, особенно в нашей стране. Тем не менее диклофенак остается надежным препаратом с предсказуемым действием, весьма удачным инструментом для лечения и острой, и хронической боли.
Имеется обширная доказательная база, подтверждающая эффективность диклофенака. Так, К. Pavelka провел систематический обзор 37 исследований, в которых сравнивалась эффективность диклофенака и эторикоксиба, целекоксиба, рофекоксиба, лумиракоксиба, ацеклофенака, декскетопрофена, этодолака, лорноксикама, набуметона, нимесулида при остеоартрите [33]. Согласно полученным данным, диклофенак не уступал препаратам сравнения. Так, автор заключает, что диклофенак остается таким же эффективным, как и новые лекарства для лечения боли, применяемые при остеоартрите, и является для врачей эталоном фармакотерапии остеоартрита.
В 2016 г. в журнале Lancet опубликован сетевой метаанализ 74 рандомизированных клинических исследований (n = 58 556), в котором сравнивалась эффективность различных НПВП при остеоартрите. Диклофенак продемонстрировал наилучшие показатели лечебного действия. Это позволило авторам прийти к выводу, что диклофенак 150 мг/сут – наиболее эффективный препарат из доступных НПВП как для купирования боли, так и для улучшения функции суставов [34].
Наиболее аргументированным подтверждением преимуществ диклофенака стала работа А. van Walsem и соавт. [35], которые провели метаанализ 176 рандомизированных клинических исследований продолжительностью 6–12 недель (n = 146 524). В них диклофенак 100–150 мг сравнивался с целекоксибом 200 мг, напроксеном 1000 мг, ибупрофеном 2400 мг, эторикоксибом 60 мг, парацетамолом 4000 мг и плацебо при остеоартрите и ревматоидном артрите. Суммарно диклофенак превосходил плацебо и препараты сравнения по всем параметрам: динамике интенсивности боли (по Визуальной аналоговой шкале), глобальной оценке активности заболевания пациентом (по Визуальной аналоговой шкале), частоте отмен терапии из-за неэффективности.
Конечно, диклофенак, как и любые другие НПВП, способен вызывать нежелательные реакции со стороны желудочно-кишечного тракта, сердечно-сосудистой системы и почек. Однако вопреки сформировавшемуся в последние годы среди российских клиницистов мнению, эти осложнения на фоне диклофенака возникают не столь часто.
Весьма показательны результаты метаанализа J. Castellsague и соавт. [36]. В него вошли 28 эпидемиологических работ, выполненных с января 1980 г. по май 2011 г., по изучению относительного риска развития желудочно-кишечных кровотечений на фоне приема разных НПВП. ОШ для ацеклофенака, целекоксиба и ибупрофена было ниже, чем для диклофенака, у которого ОШ составило 3,34 (95% ДИ 2,79–3,99). Однако риск желудочно-кишечных кровотечений на фоне применения многих других НПВП был еще выше: у мелоксикама – 3,47 (95% ДИ 2,19–5,50), нимесулида – 3,83 (95% ДИ 3,2–4,6), кетопрофена – 3,92 (95% ДИ 2,70–5,69), напроксена – 4,1 (95% ДИ 3,22–5,23), индометацина – 4,14 (95% ДИ 2,19–5,90). Как видно, опасность развития желудочно-кишечных осложнений на фоне приема диклофенака оказалась даже ниже, чем при использовании многих популярных в России НПВП.
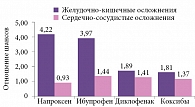
Одной из самых масштабных работ, в которых оценивалась суммарная частота желудочно-кишечных и сердечно-сосудистых осложнений при использовании разных НПВП, стало исследование N. Bhala и соавт. [37]. Они провели метаанализ 280 рандомизированных клинических исследований, где НПВП сравнивались с плацебо (n = 124 513), и 474 рандомизированных клинических исследований, где разные НПВП сравнивались между собой (n = 229 296). Изучив такой обширный материал, авторы пришли к следующим выводам: все НПВП (диклофенак, ибупрофен и селективные ингибиторы циклооксигеназы 2, коксибы рассматривались как единая группа) имеют схожий риск развития больших сердечно-сосудистых событий (нефатального инфаркта миокарда, нефатального инсульта или смерти от сердечно-сосудистых осложнений). Только у напроксена наблюдался низкий риск сердечно-сосудистых осложнений. В то же время частота серьезных желудочно-кишечных осложнений на фоне приема напроксена и ибупрофена была выше, чем у диклофенака и коксибов. Это исследование демонстрирует реальный уровень безопасности диклофенака. Частота желудочно-кишечных осложнений у диклофенака практически равна таковой у коксибов и существенно ниже таковой у неселективных НПВП. А риск развития сердечно-сосудистых осложнений на фоне применения диклофенака и других НПВП, за исключением напроксена, существенно не отличается (рис. 1) [37].
Популяционный риск развития острой почечной недостаточности на фоне приема НПВП рассматривался в метаанализе пяти когортных исследований, проведенном Р. Ungprasert и соавт. [38]. Установлено, что опасность данного осложнения при использовании диклофенака сопоставима или ниже таковой других представителей этой лекарственной группы. Так, ОШ для диклофенака составило 1,8, целекоксиба – 1,3, напроксена – 1,7, мелоксикама и ибупрофена – 2,0, пироксикама и индометацина – 2,2.
Современная наука предлагает новые решения для модификации действующего вещества и лекарственных форм традиционных НПВП, которые существенно улучшают фармакодинамику, повышают скорость наступления и выраженность анальгетического эффекта этих лекарств [39]. Так, в клиническую практику нашей страны входит новый препарат диклофенака калия – Диалрапид. Он представляет собой саше (быстрорастворимый порошок со стабилизирующим буфером) и содержит полную разовую терапевтическую дозу диклофенака (50 мг). Это истинно быстрая (англ. rapid – быстрый) фармакологическая форма: лечебный эффект наступает уже через пять минут после перорального приема, а пиковая концентрация действующего вещества в плазме крови достигается в среднем через десять минут. При этом продолжительность действия после однократного приема составляет до 12 часов [40, 41]. Согласно результатам ряда фармакологических исследований, по быстродействию новый препарат значительно превосходит обычные таблетки диклофенака калия и не уступает инъекционной форме диклофенака для внутримышечного введения.
Серия клинических исследований показала преимущества быстрорастворимой формы диклофенака калия при мигрени, острой боли, связанной со стоматологическими операциями и дисменореей [42–45].
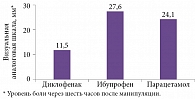
Ярко продемонстрированы достоинства нового препарата в работе G. Gazal и К. Al-Samadani [46]. Они сравнили эффект однократного приема быстрорастворимого диклофенака калия 50 мг, ибупрофена 400 мг и парацетамола 1000 мг у 120 пациентов, перенесших болезненные стоматологические манипуляции (экстракцию зуба или обработку глубоких кариозных полостей). Все препараты назначались за 15 минут до процедуры, выраженность боли оценивалась через два, четыре и шесть часов после завершения манипуляции. На всех этапах наблюдения диклофенак показал себя более эффективным анальгетиком. Интенсивность боли при использовании этого препарата была достоверно ниже, чем на фоне приема парацетамола через два, четыре и шесть часов (p < 0,05) и ибупрофена через четыре и шесть часов (p < 0,05) (рис. 2) [46]. Кроме того, при применении диклофенака значительно меньшему числу больных потребовался прием дополнительного анальгетика (10% по сравнению с 35 и 35% в группах препаратов контроля).
Заключение
Купирование острой боли, связанной с ургентным заболеванием или обострением хронической патологии, относится к числу первоочередных задач реальной клинической практики. Эффективный контроль острой боли не только устраняет страдания и улучшает качество жизни пациента, но и снижает риск развития хронической боли. Основное место среди лекарств, используемых для терапии острой и подострой ноцицептивной боли, занимают НПВП, в частности диклофенак – мощный, проверенный временем анальгетик. Появление нового быстродействующего препарата диклофенака калия в виде саше (Диалрапид) существенно расширяет возможности лечения и острой, и хронической боли. Этот препарат может рассматриваться как средство выбора для купирования острой боли в дебюте скелетно-мышечных заболеваний, подавления прорывов боли при хронической патологии, а также как замена небезопасным внутримышечным инъекциям диклофенака.
A.Ye. Karateyev, DM
Research Institute of Rheumatology named after V.A. Nasonova, Moscow
Contact person: Andrey Yevgenyevich Karateyev, aekarat@yandex.ru
The main duty of the attending physician is to alleviate the suffering of the patient. First of all, it concerns the control of intense pain caused by acute pathology or exacerbation of chronic disease. Effective pain relief not only improves the general condition of the patient, but also is an important element in the prevention of chronic pain – the independent clinical syndrome, which often develops in musculoskeletal diseases. The treatment of pain should be complex, as its pathogenesis includes both peripheral mechanisms (damage, local inflammation, degenerative processes, biomechanics disorders and peripheral sensitization) and central ones associated with neuroplastic changes of the nociceptive system itself (central sensitization). A necessary component of analgesic therapy – nonsteroidal anti-inflammatory drugs (NSAIDs). They block the most important element of the acute and chronic pain pathogenesis local inflammation, which is accompanied by hyper production of one of the central pain mediators, prostaglandin E2. Diclofenac, which has been in use for 45 years, remains the world's most popular representative of NSAIDs. There is clear evidence presented in a series of meta-analyses of well-organized studies that diclofenac is not inferior to or superior to other NSAIDs in analgesic and anti-inflammatory action. Contrary to popular belief, according to numerous clinical and population studies, diclofenac is well tolerated in the gastrointestinal tract compared to most other NSAIDs. The risk of cardiovascular complications when taking diclofenac is approximately equal to or lower than that in the application of coxibs (in the whole group) and most non-selective NSAIDs. The emergence of a new drug diclofenac potassium – soluble sachet, stabilized buffer and containing a full single dose (50 mg) of the active substance (Dialrapid), expands the control of acute and chronic pain. This medicine should be used for relief of acute pain in urgent pathology, control of exacerbations of chronic musculoskeletal diseases, as well as an alternative to intramuscular injections of diclofenac.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.