Эффективность и безопасность локального инъекционного введения Мовалиса в лечении миофасциального люмбоишиалгического синдрома
- Аннотация
- Статья
- Ссылки




В отечественной классификации заболеваний периферической нервной системы люмбоишиалгический синдром был отнесен к рефлекторным вертеброгенным болевым синдромам, предполагая боль в поясничной области с иррадиацией в ногу без неврологических дефицитов. Источником рефлекторной импульсации являются дегенеративно-дистрофические изменения мышечно-связочных структур позвоночно-двигательного сегмента, включая изменения в фиброзном кольце диска, межпозвонковых (фасеточных) суставах, микроповреждения сухожильно-связочных структур и др. (7). Кроме этого, понятие люмбоишиалгический синдром используется отечественными неврологами при характеристике болевых проявлений при компрессионных и/или ишемических повреждениях спинномозговых нервов – радикулопатиях, и в этом случае данная дефиниция приобретает более широкое толкование.
В последние годы значительно возрос интерес не только неврологов, но и врачей других специальностей (ревматологов, хирургов) к проблеме миофасциального болевого синдрома. Во многом это обусловлено появлением исследовательского труда авторов Д.Г. Симонса и Ж.Г. Трэвелла, (2005 г.), по определению которых «миофасциальная боль – это локальная неспецифическая мышечная боль, обусловленная возникновением в мышце фокусов повышенной раздражимости (триггерных точек)». Принципиальным положением является и то, что миофасциальный болевой синдром может быть первичным. Чаще в клинической практике гиперраздражимый участок в уплотненном тяже скелетной мышцы или ее фасции формируется вторично под влиянием разнообразных экзогенных и эндогенных факторов (микро- и макротравмы, вирусные инфекции, патология внутренних органов, гинекологические заболевания и др.).
До настоящего времени нет однозначного мнения о патоморфологическом субстрате и нейрофизиологической основе болевого паттерна, исследования этого феномена продолжаются. Тем не менее основными звеньями патогенеза соматогенных болевых синдромов, в том числе и мышечной боли, являются раздражение ноцицепторов при повреждении тканей и выделение алгогенов и сенситизация рецепторов в области повреждения. Вследствие этого происходит усиление ноцицептивного афферентного потока и сенситизация ноцицептивных нейронов на различных уровнях ЦНС.
В огромном разнообразии клинических форм болевых проявлений миофасциальный болевой синдром проявляется рефлекторными тоническими изменениями в мышце или на ее ограниченном участке и локальной вазомоторной дисфункцией (7).
В тех случаях, когда такая вазомоторная и мышечно-тоническая дисфункция может претерпеть обратное развитие, компенсироваться, можно говорить о функциональной или мышечно-тонической стадии поражения, которую называют миалгией. Однако ее целесообразнее обозначить как алгическую стадию, не подчеркивая исключительного значения мышечных расстройств и учитывая также значение начальных нейродистрофических нарушений в фиброзных тканях. Алгическая стадия на том или ином этапе заболевания, как правило, переходит в органическую, мышечно-дистрофическую или триггерную, которую обозначают как миозит или фибромиозит. При этом определение мышечно-дистрофической стадии подразумевает поражение мышцы с ее сухожильно-связочным комплексом – миофиброз (7).
Патогномоничным признаком миофасциального болевого синдрома является наличие миофасциальных триггерных точек. Миофасциальная триггерная точка представляет локальную зону исключительно высокой чувствительности, расположенную обычно в пределах «тугого» тяжа заинтересованной мышцы. Существенно, что для постановки диагноза миофасциального болевого синдрома необходимо воспроизвести ту боль, на которую жалуется больной, надавив на активную триггерную точку. Воспроизводимость боли – одно из необходимых условий диагностики миофасциальных синдромов (8).
Стимуляция триггерных точек вызывает боль в удаленном от давления, но строго определенном месте. При таком надавливании пациент непроизвольно пытается устранить вызвавший боль раздражитель, что известно под названием «симптом прыжка», который является характерным признаком миофасциального болевого синдрома. Помимо боли, миофасциальный болевой синдром часто вызывает напряженность мышц, сопровождающуюся мышечной утомляемостью, что усиливает функциональные нарушения, возникающие при этом заболевании, и осложняет его лечение. Диагноз миофасциальный болевой синдром ставится на основе клинического обследования и требует систематизированного подхода, включающего тщательное изучение анамнеза заболевания, целенаправленное выявление триггерных точек и обнаружение сопутствующих соматических, психологических и поведенческих нарушений. Критерии диагностики миофасциального болевого синдрома делятся на 2 группы.
I группа – «большие» критерии (необходимо наличие всех 5 признаков):
- жалобы на региональную боль;
- пальпируемый «тугой» тяж в мышце;
- участок повышенной чувствительности в пределах «тугого» тяжа;
- характерный паттерн отраженной боли или чувствительных расстройств;
- ограничение объема движений.
II группа – «малые» критерии (необходимо наличие одного из трех):
- воспроизводимость боли или чувствительных нарушений при стимуляции триггерных точек;
- локальное вздрагивание при пальпации триггерных точек заинтересованной мышцы или при инъекции в триггерные точки;
- уменьшение боли при растяжении или при инъекции в мышцу.
Разнообразные лечебные методики воздействия на триггерные зоны предлагались с момента описания данного феномена. При лечении болевого синдрома имеются данные о предпочтительном введении в триггерные точки перед обычным внутримышечным введением новокаина и лидокаина (8), кортикостероидов (9, 11), мидокалма (2, 10) .
Абсолютно доказанной является необходимость, как можно скорейшего обезболивания пациента. Чем раньше начато лечение и быстрее достигнут значимый анальгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз. Общепризнанным для болей в спине является обезболивание с помощью нестероидных противовоспалительных препаратов (11, 14, 16).
Была предпринята оценка эффективности воздействия на триггерные точки инъекциями селективного ингибитора циклооксигеназы-2 мелоксикама (Мовалиса) при лечении люмбоишиалгического синдрома. Этот препарат был выбран по ряду причин. Во-первых, на данный момент на российском рынке Мовалис® является единственным селективным ингибитором циклооксигеназы-2 в инъекционной (раствор) форме. Во-вторых, результаты многих клинических исследований свидетельствуют о достаточно низкой частоте развития побочных явлений Мовалиса и достаточной эффективности в лечении болей в нижней части спины (1, 3, 5, 12, 13). В-третьих, одним из осложнений при локальном введении нестероидных противовоспалительных препаратов является местное раздражение и очаговый некроз тканей, подтвержденное повышением уровня креатинфосфокиназы. Ни в исследованиях на добровольцах, ни в клинических исследованиях повышения креатинфосфокиназы, изофермента, специфического для скелетных мышц, после внутримышечного введения мелоксикама отмечено не было (3, 5). Данный препарат не вызывает местного раздражения и очагового некроза тканей, что представляет несомненное преимущество при введении препарата в триггерные зоны.
Материал и методы
С целью изучения эффективности различных лечебных комплексов проведено рандомизированное контролируемое клиническое исследование. Обследованные 94 пациента распределялись по группам с помощью генератора случайных чисел, при этом в группах не отмечалось существенных различий по профессиональному составу, возрасту, сопутствующей патологии, которые могли влиять на исход заболевания.
Критерием включения являлось наличие болевого люмбоишиалгического синдрома, сопровождающегося формированием миофасциальных триггерных зон. Критериями исключения являлись: непереносимость мелоксикама, наличие «аспириновой триады», язвенная болезнь желудка и/или 12-перстной кишки в стадии обострения, клинически значимые нарушения функции печени или почек, а также беременность и кормление грудью.
Продолжительность болевого анамнеза, а также обострения люмбалгии и люмбоишиалгии в исследуемых группах были сопоставимы (р > 0,05) (таблица 1).
В I группу (основную) было включено 45 пациентов, которым вводился Мовалис® в триггерные точки по 15 мг/1,5 мл ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. Наиболее часто триггерные зоны локализовались у гребня подвздошной кости (место прикрепления средней ягодичной мышцы), в проекции крестцово-подвздошного сочленения, паравертебрально. Во II группе (28 человек) пациентам проводилось внутримышечное введение Мовалиса по 15 мг/1,5 мл (1 ампула) ежедневно в течение 3 суток с последующим назначением таблетированной формы 15 мг ежедневно в течение 20 суток. В III группу (контрольную) было включен 21 пациент, которые не принимали Мовалис® и/или другие нестероидные противовоспалительные препараты. Все больные также получали массаж пояснично-крестцовой области, лечебную физкультуру по стандартным методикам.
Оценка эффективности лечения проводилась по визуально-аналоговой шкале (ВАШ) (Quadruple Visual Analogue Scale), шкале пятибалльной оценки вертебро-неврологической симптоматики (4). Динамика самочувствия больных оценивалась до лечения, после первого и третьего дня и после завершения курса лечения. До и после лечения использовался Освестровский опросник нарушений жизнедеятельности при болях в нижней части спины (по J. Fairbank, 1980), а также опросник Мак-Гилла. Для изучения функционального состояния нервов был использован метод стимуляционной электронейромиографии (ЭНМГ). Исследование проводилось по общепринятой методике на аппарате «Нейрон-Спектр-4» («Нейрософт» г. Иваново). Анализировались показатели М-ответа и скорость проведения импульса (СПИ) до и после лечения.
Обработка данных проводилась с использованием пакета прикладных программ Primer of Biostatistics 4.03 («БИОСТАТ») общепринятыми методами вариационной статистики.
Результаты
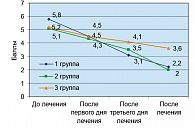
По визуально-аналоговой шкале начальный уровень выраженности болевого синдрома был сопоставим в группах, хотя в I группе был несущественно выше. Достоверное уменьшение интенсивности болевого синдрома отмечено с первого дня лечения в I и II группах (p < 0,05). Более выраженный анальгетический эффект отмечался после третьей инъекции Мовалиса в триггерные зоны по сравнению с внутримышечным введением. Улучшение в III группе отмечено с третьего дня лечения. К концу курса лечения показатели выраженности болевого синдрома в I и II группах выравнивались (рисунок 1), имея достоверные различия в сравнении с III группой.
Оценка состояния пациентов по шкале пятибалльной оценки неврологической симптоматики, по объему движений и нейродистрофическому синдрому выявила положительную динамику во всех группах. Существенное улучшение показателей объема движений отмечалось в I группе уже с первого дня лечения, во II и III группах с третьего дня лечения (p < 0,05) (рисунок 2), хотя изначально в I группе уровень ограничения движений и показатель нейродистрофического синдрома были выше, чем во II и III (p < 0,05). К концу лечения улучшение объема движений было более выражено в I группе.
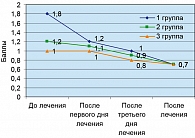
После завершения курса лечения снижение показателей выраженности нейродистрофического (миофасциального) синдрома в I группе имели достоверные отличия (1 ± 0,1) (p > 0,05), а во II (1,4 ± 0,2) и III (1,6±0,3) группах наблюдалась тенденция к уменьшению степени нейродистрофических проявлений (рисунок 3).
Положительная динамика по показателю «корешковый синдром» отмечена в I и II группе с третьего дня лечения (p < 0,05). В III группе достоверной разницы до и после лечения не выявлено (p > 0,05). Динамики по сколиозу не отмечено ни в одной из групп (p > 0,05).
При оценке эффективности лечения по Мак-Гилловскому опроснику, детализирующему интенсивность и характер болевых ощущений, выявлено, что сумма рангов и число слов-дескрипторов в группах до лечения сопоставимы. Достоверное улучшение по сумме рангов отмечается во всех группах, но во II группе (8,6 ± 1,7) оно более выражено, чем в I (17,8 ± 2,3) и III (17,3 ± 2,6). По количеству слов-дескрипторов достоверное улучшение наблюдается в I (8,9 ± 1) и более во II группе (5,5 ± 1).
При оценке эффективности лечения по Освестровскому опроснику, оценивающему качество жизни пациентов, получены достоверные различия во всех группах (p < 0,05). Улучшение отмечено во всех 3 группах, но более выражено в I группе (42,0 ± 2,6) до и (28,1 ± 2,7) после лечения (p < 0,01). Менее выражено улучшение во II группе до и после лечения (30,1 ± 2,4 и 19,6 ± 2 соответственно) и в III – до (31,6 ± 3,6) и после (23,4 ± 3,3) лечения.
При проведении электронейромиографии анализировались показатели М-ответа и скорость проведения импульса (СПИ). У 38 (84,4%) человек в I группе, 26 (92,9%) человек во II и 16 в III группе (76,2%) были обнаружены изменения: при исследовании мышц ног снижение амплитуды ЭМГ и единичные потенциалы фасцикуляций, а также снижение СПИ и увеличение латентного периода М-ответа. Положительная динамика – повышение СПИ и уменьшение латентности М-ответа отмечалась у 20 больных (44,4%) в I группе, 7 (25,0%) во II и 9 (42,9%) в III группах. Динамики СПИ и М-ответа не наблюдалось у 6 больных (13,3%) в I группе, 9 (32,1%) и 6 (28,6%) во II и III группах соответственно. Отрицательная динамика, т.е. снижение СПИ и увеличение латентного периода М-ответа, отмечена у 1 больного (2,2%) в I группе, у 2 (7,1%) во II и 3 (14,3%) в III группах.
В понятие «улучшение» была включена положительная динамика неврологической симптоматики, улучшение по ВАШ, Мак-Гилловскому и Освестровскому опросникам. Более высокий эффект от лечения отмечен в I группе (75,6%), затем во II группе (64,3%), в III всего лишь в 33,3% случаев (таблица 3). «Незначительное улучшение» – улучшение по ВАШ, Мак-Гилловскому и Освестровскому опросникам, но отсутствие неврологической динамики. Незначительное улучшение в I и II группах одинаково (22,2% и 25% соответственно), оно более выражено в III группе (42,9%). Отсутствие динамики по опросникам и неврологической симптоматике после проведенного курса лечения чаще имело место во II и III группах (10,7% и 19% соответственно), реже в I – (2,2%). В III группе в одном случае (4,8%) отмечена отрицательная неврологическая динамика, что потребовало корректировки и продолжении лечения.
При ведении Мовалиса как в триггерные зоны, так и внутримышечно не было отмечено местных побочных явлений. В I группе у 2 (4,4%) больных отмечалось повышение артериального давления. Диспепсические расстройства – у 2 (4,4%). В одном случае (2,2%) отмечено появление головной боли после первой блокады Мовалисом, тем не менее лечение было продолжено и впоследствии головные боли у больной не повторялись.
Во II группе: повышение артериального давления у 2 (7,1%) больных, диспепсические расстройства – у 2 (7,1%). В одном случае (3,6%) зарегистрировано обострение хронического эрозивного гастрита.
В III группе в одном случае наблюдались спонтанная головная боль и тошнота.
Таким образом, улучшение субъективных показателей и результатов клинико-инструментального обследования после проведенного курса лечения в I группе составило 75,6%, во II группе – 64,3%, в III группе – 33,3%. При этом более выраженный анальгезирующий эффект отмечался после 3-й инъекции Мовалиса в триггерные зоны, но к окончанию курса лечения эффективность, оцениваемая по визуально-аналоговой шкале, в обеих группах была сопоставима.
Выводы
При введении Мовалиса как в триггерные зоны, так и внутримышечно не было отмечено местных побочных явлений. Количество больных с диспепсическими расстройствами и кратковременным повышением артериального давления были сопоставимы в I и II группах.
Эффективность лечения после проведенного курса по показателям визуально-аналоговой шкалы, Освестровского опросника и пятибалльной шкале оценки вертебро-неврологической симптоматики была выше среди пациентов I группы, которым Мовалис® вводился в триггерные зоны пояснично-крестцовой области (75,6%), по сравнению с группой больных получавших Мовалис® внутримышечно (64,3%). При этом анальгетический эффект после 3-кратной инъекции Мовалиса в триггерные зоны был более выраженным, чем при внутримышечном введении, что позволяет получить анальгетический эффект в более ранние сроки.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.