Эффективность локальных форм нестероидных противовоспалительных препаратов для купирования боли и воспаления при ревматических заболеваниях
- Аннотация
- Статья
- Ссылки
- English
Хронические ревматические заболевания опорно-двигательного аппарата характеризуются болевым синдромом, который имеет различный генез: воспалительный, механический, сосудистый, неврогенный. В возникновении боли участвуют периферические ноцицепторы, широко представленные в тканях сустава; сигнал с периферии передается через спинной мозг в таламус, где боль осознается и вырабатывается ответ на болевой сигнал. Воспалительная боль инициируется различными альгогенами, наиболее мощными из них являются простагландины – продукты метаболизма арахидоновой кислоты, вырабатывающиеся под воздействием циклооксигеназы (ЦОГ), преимущественно ее второй изоформы – ЦОГ-2.
Оптимальной стратегией купирования хронической боли представляется комплексный подход с использованием патогенетической и симптоматической терапии. Среди симптоматических средств, применяемых в ревматологии, ведущее место отводится нестероидным противовоспалительным препаратам (НПВП). Наиболее важный механизм действия НПВП, определяющий их эффективность, – подавление активности ЦОГ. НПВП, назначаемые, как правило, в таблетированной или капсулированной форме, дают отчетливый анальгетический и противовоспалительный эффект. Однако на фоне даже краткосрочного применения НПВП возникают нежелательные явления. В первую очередь это желудочно-кишечное кровотечение из-за ульцерогенного действия НПВП на слизистую оболочку желудочно-кишечного тракта – от пищевода до кишечника. Риск этого осложнения ограничивает применение НПВП, особенно у лиц, имеющих язвенный анамнез. НПВП могут вызвать повышение артериального давления, нарушение свертывающей системы крови. Появление НПВП нового поколения, избирательно подавляющих провоспалительную ЦОГ-2, отчасти обезопасило терапию ревматических заболеваний.
Для современной ревматологии актуальной проблемой является не только и не столько эффективность терапии, сколько ее безопасность. Именно вопросами безопасности объясняется широкое внедрение в клиническую практику методов локальной терапии НПВП (в лекарственной форме кремов, мазей, гелей). В тех случаях, когда процесс носит ограниченный характер (моно-, олигоартрит), а также в ситуациях, когда требуется купировать боль и воспаление в мягких периартикулярных тканях (миозит, бурсит и др.), местная терапия НПВП имеет преимущество перед системным использованием препарата. Местное применение НПВП предпочтительно и при остеоартрите по причине минимально выраженного воспаления и достаточно интенсивного болевого синдрома. Локальное применение НПВП способно уменьшить потребность в системно назначаемых средствах, что важно для пожилых людей, у которых прием системных НПВП ограничивается сопутствующими заболеваниями и выше риск развития нежелательных явлений. Накожное нанесение НПВП создает повышенную концентрацию препарата над местом воспаления, при этом в общий кровоток поступает лишь незначительное количество действующего вещества, что позволяет избежать системных нежелательных эффектов.
В последние годы разработаны специальные требования, которым должны соответствовать лекарственные препараты локального применения:
- высокая эффективность при лечении заболевания, то есть препарат должен обладать анальгетическим свойством;
- отсутствие местных токсических и аллергических реакций, связанных с применением препарата;
- способность проникать через кожу, достигая органа-мишени;
- концентрация препарата в сыворотке и крови не должна достигать уровня, приводящего к зависимым от дозы побочным эффектам;
- метаболизм и выведение препарата должны быть такими же, как при системном применении.
Для оценки клинической эффективности локальной терапии в соответствии с принципами доказательной медицины R.A. Moore и соавт. проанализировали данные 86 исследований (в том числе плацебоконтролируемых), в которые в общей сложности вошло более 10 000 пациентов [1]. Проведенный метаанализ показал, что локальные формы НПВП достоверно эффективнее плацебо, при этом при острой боли эффект более выражен в первую неделю, а при хронической – во вторую.
Тем не менее у ряда врачей оставалось сомнение: действительно ли НПВП проникают трансдермально и достигают биофазы в достаточных для воздействия концентрациях. Для проверки этой гипотезы проведено исследование фармакокинетики нимесулида с измерением концентрации препарата в синовиальной жидкости и плазме крови после местного нанесения (область коленного сустава) в сравнении с пероральным применением [2]. Нимесулид в таблетках назначали дважды в сутки по 100 мг. Нимесулид в лекарственной форме геля наносили на кожу над коленным суставом 3 раза в сутки (около 0,4 мг / 10 см²). Оценивали индекс WOMAC (Western Ontario and McMaster Universities Arthritis Index – индекс артрита университетов Западного Онтарио и МакМастера), удовлетворенность врача и пациента, а также проводили артроскопическое исследование у 34 пациентов, давших на это согласие. При местном нанесении нимесулида средняя концентрация препарата составила 22,1 ± 10,5 нг/мл в синовиальной жидкости и 11,8 ± 3,0 нг/мл в плазме, что свидетельствует о трансдермальном проникновении геля. При пероральном приеме нимесулида эти показатели были значительно выше: 2080,7 ± 402,8 нг/мл в синовиальной жидкости и 3631,9 ± 799,3 нг/мл в плазме. Проведенное исследование показало, что нимесулид при локальном применении проникает трансдермально и достигает синовиальной жидкости в достаточной для ингибирования ЦОГ концентрации.
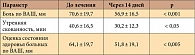
В Научно-исследовательском институте ревматологии им. В.А. Насоновой РАМН проведено исследование клинической эффективности Найз® геля (1%-ный гель нимесулида), лидера среди селективных ингибиторов ЦОГ-2 в местной форме выпуска. В исследовании приняли участие 30 больных ревматоидным артритом, преимущественно женщин (n = 26), в возрасте 59 ± 11,7 лет, у которых выраженность боли по визуально-аналоговой шкале (ВАШ) была более 70 мм, то есть пациенты нуждались в анальгетической терапии. Для оценки локального действия Найз® геля пациенты должны были получать терапию базисными препаратами в течение не менее 6 месяцев до включения в исследование. Во время исследования, продолжительность которого составила 14 дней, исключался прием других препаратов или применение методов терапии, обладающих анальгетическим эффектом. Гель наносили 3 раза в день с учетом площади пораженного сустава. Динамика клинических параметров представлена в таблице. Время наступления обезболивающего эффекта колебалось от 15 до 30 минут, а его длительность – от 30 минут до 6 часов.
Для объективизации оценки противовоспалительного действия Найз® геля провели сонографию суставов на аппарате Sono Diagnost 360 с линейным датчиком 7,5 мГц в режиме реального времени. Оценивали количество выпота в суставе, толщину синовиальной оболочки, толщину хряща. Статистически значимых различий по данным сонографии за 14-дневный период исследования не получено, однако отмечено, что у 5 пациентов исчез выпот в суставе, у 8 уменьшились размеры кисты Бейкера, у 4 – толщина синовиальной оболочки. Побочных реакций, связанных с терапией нимесулидом, зарегистрировано не было [3].
Таким образом, локальное нанесение НПВП может использоваться в качестве аддитивной терапии при воспалительных заболеваниях суставов. В частности, Найз® гель хорошо проникает трансдермально в достаточной концентрации для оказания анальгетического и противовоспалительного действия у больных с заболеваниями опорно-двигательного аппарата. Одновременное применение системной и местной формы препарата Найз® усиливает и ускоряет обезболивающий и противовоспалительный эффекты, сохраняет достаточную концентрацию нимесулида непосредственно в очаге воспаления, обеспечивает хондропротекторное действие [4]. Найз® гель уменьшает утреннюю скованность и припухлость суставов, способствует увеличению объема движений, не раздражает кожу, может применяться в острый период заболевания [5]. Благодаря большей биодоступности препарата в очаге воспаления местная форма препарата Найз® особенно показана у лиц пожилого возраста с отягощенным язвенным анамнезом или при наличии сопутствующих заболеваний (артериальная гипертония, болезни почек и др.).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.