Постковидный синдром: что скрывается в тени
- Аннотация
- Статья
- Ссылки
- English
В статье представлены данные, позволяющие рассматривать ПКС, ФМ, а также другие формы хронических болевых синдромов перекрытия как сеть взаимосвязанных расстройств с общим патогенетическим механизмом. На этом основании высказывается предположение о том, что для лечения ПКС целесообразно использовать весь арсенал методов, предназначенных для коррекции фибромиалгии, в том числе различные виды когнитивно-поведенческой терапии, такие как медитация, йога, тай-чи, иглоукалывание/акупрессура, трициклические антидепрессанты, габапентиноиды и ингибиторы обратного захвата серотонина и норадреналина. Подчеркивается необходимость дальнейших исследований патогенетических механизмов ФМ-подобных вариантов ПКС, а также совершенствования существующих и поиска новых методов терапии пациентов с ПКС.
В статье представлены данные, позволяющие рассматривать ПКС, ФМ, а также другие формы хронических болевых синдромов перекрытия как сеть взаимосвязанных расстройств с общим патогенетическим механизмом. На этом основании высказывается предположение о том, что для лечения ПКС целесообразно использовать весь арсенал методов, предназначенных для коррекции фибромиалгии, в том числе различные виды когнитивно-поведенческой терапии, такие как медитация, йога, тай-чи, иглоукалывание/акупрессура, трициклические антидепрессанты, габапентиноиды и ингибиторы обратного захвата серотонина и норадреналина. Подчеркивается необходимость дальнейших исследований патогенетических механизмов ФМ-подобных вариантов ПКС, а также совершенствования существующих и поиска новых методов терапии пациентов с ПКС.
С декабря 2019 г., когда в китайском Ухане был обнаружен новый коронавирус – Severe Acute Respiratory Coronavirus 2 (SARS-CoV-2), пандемия коронавирусной инфекции (COVID-19) распространилась по всему миру. Согласно данным некоторых авторов, за первые два года она стала причиной не менее 18 млн летальных исходов [1].
По мере накопления данных о новом заболевании стало очевидным, что его тяжесть не ограничивается проявлениями острой фазы инфицирования SARS-CoV-2. Нередки случаи длительно сохраняющихся симптомов после выздоровления. Так, некоторые пациенты, перенесшие тяжелый COVID-19, в том числе получавшие лечение в отделении интенсивной терапии, сообщали об одышке, усталости и других симптомах. Эти проявления считаются неспецифичными и связанными с остаточным воспалением, повреждением органов, последствиями длительной госпитализации или вентиляции легких [2]. Перенесшие COVID-19 в легкой и среднетяжелой форме также отмечали гетерогенные симптомы, в том числе аносмию, агевзию, распространенную мышечно-скелетную и головную боль, нейрокогнитивную дисфункцию [2–4], которые большинством исследователей рассматриваются в рамках постковидного синдрома (ПКС) [5, 6].
Согласно определению Всемирной организации здравоохранения 2021 г., ПКС представляет собой состояние, которое возникает у лиц с анамнезом вероятной или подтвержденной инфекции, вызванной SARS-CoV-2, как правило в течение трех месяцев от момента дебюта заболевания и характеризуется наличием симптомов не менее двух месяцев, а также невозможностью их объяснения альтернативным диагнозом [7]. При этом может отмечаться как появление симптомов вслед за периодом выздоровления после острой инфекции COVID-19, так и их персистенция с момента первоначально перенесенной болезни. Кроме того, с течением времени возможно рецидивирование симптомов.
По мнению некоторых авторов, в настоящее время назрела необходимость создания новой системы классификационных критериев ПКС, которые можно было бы использовать для сравнительных эпидемиологических исследований и изучения биомаркеров. Так, L. Boekel и соавт. в ходе проспективного когортного исследования оценили риск развития ПКС с контролем времени до его разрешения, а также сопоставили распространенность симптомов, наблюдаемых при ПКС, у пациентов с иммуновоспалительными ревматическими заболеваниями и здоровых лиц с COVID-19 в анамнезе и без такового [8]. Частота развития симптоматики ПКС в группе больных оказалась выше, чем в контрольной группе, – 21 и 13% соответственно. Однако после поправки на потенциальные искажающие факторы (конфаундеры) значимых различий получено не было. Клиническая характеристика и продолжительность обратного развития симптоматики ПКС в обеих группах не различались. Примечательно, что пациенты с иммуновоспалительными ревматическими заболеваниями без COVID-19 в анамнезе чаще, чем здоровые лица, сообщали о стойких симптомах, которые применяются для выявления постковидного статуса в течение первых двух лет пандемии. Таковых было 21 и 11% соответственно. По мнению авторов, общность симптоматики иммуновоспалительных ревматических заболеваний и ПКС, а также отсутствие валидированных критериев последнего могут быть причиной смещения данных и нарастания частоты случаев установления постковидного статуса среди ревматологических пациентов.
Патогенез указанного выше феномена остается недостаточно ясным и требует дальнейшего изучения. Имеющиеся на сегодняшний день данные позволяют предположить участие аутоиммунитета, тромбовоспаления, латентной вирусной реактивации, дисбиоза и др. [9].
В некоторых исследованиях предпринимались попытки выявить объективные маркеры ПКС. Однако результаты ни одного из них не были достаточно убедительными. Не доказана также персистенция SARS-CoV-2 у пациентов с ПКС. Продолжается изучение потенциальных аутоиммунных путей патогенеза ПКС. Так, A. Bodansky и соавт. выявили спектр аутоантител, впервые образовавшихся у ранее здоровых людей после инфицирования SARS-CoV-2 и не сформировавших типичного для ПКС паттерна [10]. C. Phetsouphanh и соавт. обнаружили, что экспрессия интерферонов I и III оставалась устойчиво высокой у лиц с ПКС в течение восьми месяцев после заражения по сравнению с лицами контрольной группы [11]. Однако полученные в этом исследовании результаты следует трактовать с осторожностью, поскольку группы не были сопоставимы статистически. В другом исследовании с использованием протеомного анализа у пациентов с ПКС также был выявлен интерфероновый автограф [12]. Полученные в нем данные также требуют уточнения.
Обращает внимание сходство некоторых проявлений ПКС с проявлениями миалгического энцефаломиелита/синдрома хронической усталости (MЭ/CХУ) [2] и фибромиалгии (ФМ) [13, 14]. Гипотеза о существовании связи между ПКС и ФМ базируется на доказательствах общности механизма дисфункции центральной нервной системы, включая глиальную активацию [15] и центральную сенсибилизацию [16].
Фибромиалгия широко распространена в общей популяции (до 6,6%), при этом чаще встречается у женщин (от 2:1 до 30:1 в зависимости от используемых диагностических критериев) [17].
Патогенез ФМ до конца не изучен. Считается, что в его основе лежит взаимодействие таких факторов, как генетическая предрасположенность, стресс и воспалительный процесс, в результате чего нарушается восприятие боли вследствие центральной сенсибилизации и происходят нейроморфологические изменения (ноципластическая боль) [13]. Ноципластическая (дисфункциональная) боль – боль, возникающая в отсутствие активации ноцицепторов и видимого органического повреждения, в том числе со стороны нервной системы. Концепция и термин были официально добавлены в таксономию Международной ассоциации по изучению боли по рекомендации целевой группы в 2017 г. Причины ноципластической боли пока изучаются. Предполагается, что это дисфункция центральной нервной системы, при которой обработка болевых сигналов стала искаженной или повышенной.
Главное отличие дисфункционального типа боли от ноцицептивной и нейропатической в том, что при традиционном обследовании не удается выявить причину боли или органические заболевания, которые могли бы объяснить ее происхождение. Ее диагностируют по клиническим особенностям и отсутствию реакции на обычные анальгетики. Боль ощущается в нескольких частях тела и часто является широко распространенной и интенсивной. Возможно ее сочетание с ощущением усталости и проблемами с памятью, настроением и сном, что наблюдается при ПКС. Она может возникать при таких состояниях, как головная боль напряжения (ГБН) или фибромиалгия, сочетаться с другими категориями боли, например с хронической болью в спине [4, 18–20].
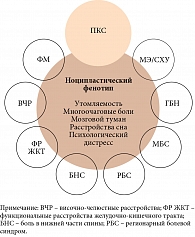
Большинство исследователей относят ФМ и MЭ/CХУ к хроническим болевым синдромам перекрытия (ХБСП), которые включают в себя распространенные болевые состояния, такие как ГБН, синдром раздраженного кишечника, боль в спине, синдром болевой дисфункции височно-нижнечелюстного сустава, вульводиния и интерстициальный цистит, или мочепузырный болевой синдром (МБС) [21]. В основе клинических проявлений ХБСП лежит ноципластическая боль, нередко сочетающаяся с ноцицептивными болевыми состояниями, при которых боль возникает в результате воспалительных изменений и которые преобладают при аутоиммунных заболеваниях. Действительно, более чем у трети пациентов с аутоиммунными заболеваниями отмечается ФМ или центральная сенсибилизация. Факторы риска включают женский пол, низкий социально-экономический статус, дефицит сна, недостаточную физическую активность и курение и соответствуют установленным факторам риска развития ПКС [22, 23]. В исследованиях болевого синдрома, развившегося как вследствие COVID-19, так и вследствие других респираторных заболеваний, показано, что после выздоровления у пациентов с ХБСП с большей вероятностью отмечалось появление или усугубление болевой симптоматики, которую соотносили с перенесенной инфекцией [24–26]. J.D. Clauw и соавт. высказали предположение, что ПКС – гетерогенное заболевание с несколькими клиническими эндотипами. Следовательно, ПКС, ФМ, а также другие формы ХБСП целесообразно рассматривать как сеть взаимосвязанных расстройств с общим патогенетическим механизмом (рисунок) [14].
Согласно данным нашего исследования, у больных ревматоидным артритом без ФМ в анамнезе наиболее частыми проявлениями ПКС были слабость, снижение внимания, нарушения сна, усиление боли в суставах (63,6%), повышенная утомляемость, ухудшение памяти (54,5%), которые также характерны для ФМ [27].
A.C. Wong и соавт. установили, что для ПКС характерно снижение уровня серотонина в плазме крови, вызванное интерфероном I, и что эта аномалия может наблюдаться после любой вирусной инфекции [28].
Известно, что снижение уровня серотонина в плазме крови играет ключевую роль в развитии депрессивных расстройств, которые часто ассоциируются с ФМ [29].
Роль психологических факторов в этих ноципластических состояниях спорна. Ранние исследования в этом направлении базировались на том, что у большинства пациентов с ноципластической болью будет выявлена та или иная форма стресса. Позднее было доказано, что улучшение психологического статуса у лиц с хроническим болевым синдромом и депрессивными расстройствами коррелировало с успешным лечением болевого синдрома [30, 31]. Полученные данные свидетельствуют о наличии выраженной двунаправленной связи.
Подтверждением патогенетического сходства некоторых форм ПКС и ФМ стали результаты исследования CONSTANCE, проведенного во Франции в общей популяции после первой волны COVID-19 [32]. В ходе исследования были проанализированы результаты опроса более 26 тыс. респондентов о том, перенесли ли они COVID-19 и имеют ли у них место постоянные симптомы ПКС. Кроме того, всем опрошенным был проведен серологический тест на наличие антител к SARS-CoV-2 для подтверждения иммунологического статуса с целью верификации анамнестических данных. Показано, что все симптомы ПКС, за исключением аносмии, ассоциировались с положительными ожиданиями респондентов в отношении перенесенного COVID-19, но не с серологическим статусом. Был сделан вывод, что основной причиной высокой частоты ПКС в период первой волны COVID-19, скорее всего, был социальный стресс, а не последствия инфекции.
На крупной норвежской когорте, включавшей более 200 тыс. обследованных, установлено, что сопутствующие психологические отклонения были наиболее важным предиктором ПКС (относительный риск 2,12 при 95%-ном доверительном интервале 1,84–2,44). Следовательно, развитию ПКС в значительной степени могут благоприятствовать ранее существовавшие психологические факторы [33].
В исследовании, проведенном в Страсбурге, показано, что при одном и том же штамме вируса частота возникновения ПКС после первой волны COVID-19 была почти в два раза выше, чем после второй волны [34]. По мнению исследователей, полученные результаты можно объяснить гораздо менее значительным влиянием социального стресса во время второй волны COVID-19.
Случаи развития ПКС значительно реже выявлялись после волн заболеваемости, вызванных штаммом «Омикрон», то есть спустя два года после начала пандемии COVID-19 [5]. Это означает, что влияние разных штаммов вируса на формирование ПКС может быть различным.
Несмотря на прогресс в терапии ревматических заболеваний, эффективная коррекция воспалительного процесса не всегда позволяет добиться полной реабилитации пациента. Утомляемость, болевой синдром различной локализации, нарушения сна и когнитивных функций нередко сохраняются на фоне удовлетворительного контроля воспалительной активности болезни.
Клинические и терапевтические аспекты ФМ и других тесно связанных с ней хронических болевых состояний достаточно широко изучены и могут служить моделями для поиска новых подходов к терапии ПКС. Наиболее эффективными при этих ноципластических болевых состояниях признаны различные виды когнитивно-поведенческой терапии, в том числе медитация, йога, тай-чи, а также иглоукалывание/акупрессура [35]. При указанных расстройствах болевой синдром, как правило, плохо поддается лечению нестероидными противовоспалительными препаратами. Эффективными могут быть трициклические антидепрессанты, габапентиноиды и ингибиторы обратного захвата серотонина и норадреналина, точкой приложения которых является центральная нервная система. X. Mariette высказал предположение, что селективные ингибиторы обратного захвата серотонина, недостаточная эффективность которых была доказана при остром течении COVID-19 [36], могут оказывать протективное воздействие в отношении ФМ-подобных проявлений ПКС [37].
Для лечения пациентов с ПКС обоснован мультидисциплинарный подход с привлечением психологов, психиатров, реабилитологов.
Таким образом, если рассматривать ПКС как ноципластический болевой синдром, то для его лечения можно применять весь арсенал как медикаментозных, так и немедикаментозных методов, используемых для коррекции фибромиалгии.
Понимание природы стрессового фактора, в роли которого у больных ПКС выступает инфекция, вызванная SARS-CoV-2, способно улучшить прогноз этого состояния [38].
Необходимы дальнейшие исследования патогенетических механизмов ХБСП-подобных вариантов ПКС, а также совершенствование уже существующих и поиск новых методов лечения.
Заявление о конфликте интересов
Статья подготовлена в рамках научно-исследовательской работы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7.
Исследование не имело спонсорской поддержки.
Конфликт интересов отсутствует.
E.S. Aronova, PhD, B.S. Belov, MD, PhD, G.I. Gridneva, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Eugenia S. Aronova, eugpozd@mail.ru
Over the past three years since the beginning of the COVID-19 pandemic, an increasing number of patients have noted long-lasting symptoms after recovery, which are considered within the framework of post-Covid syndrome. As data on PCS accumulate, attention is drawn to the similarity of some of its manifestations with myalgic encephalomyelitis/chronic fatigue syndrome and fibromyalgia (FM).
The article presents data that allows us to consider PCS, FM, and other forms of chronic pain overlap syndromes as a network of interconnected disorders with a common pathogenetic mechanism. On this basis, the authors suggest that for the treatment of PCS it is advisable to use the entire arsenal of methods used to correct fibromyalgia, including various types of cognitive behavioral therapy, such as meditation, yoga, tai chi, acupuncture/acupressure, tricyclic antidepressants, gabapentinoids and serotonin and norepinephrine reuptake inhibitors. Further research is needed to study the pathogenetic mechanisms of FM-like variants of PCS, as well as to improve existing and search for new methods of treating patients with PCS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.